急性淋巴细胞性白血病(acute lymphoblastic leukemia, ALL)是儿童最常见的恶性肿瘤,其发病原因受环境、遗传等因素影响。研究表明多种代谢酶基因多态性与ALL发生有关[1, 2]。细胞色素氧化酶P4501A1(cytochrome P450 proteins, CYP1A1)是催化代谢前致癌物的关键酶,其基因多态性与儿童ALL易感性相关,CYP1A1*2A多态性发生在CYP1A13'端非编码区下游第264位碱基,导致T→C置换,进而可改变酶活性并最终导致癌变发生。近年国内、外关于CYP1A1*2A多态性与儿童ALL易感性的研究逐渐增多,但研究结论尚不一致,缺乏相关文献的汇总分析,因此,本研究对目前国内外已发表相关研究进行Meta分析,以期为儿童ALL发病的遗传学研究提供循证依据。
1 资料与方法 1.1 纳入标准(1)已发表的CYP1A1*2A多态性与儿童ALL易感性的相关文献,病例组为确诊的ALL患儿,对照组年龄不限;(2)研究人群种族不限;(3)研究设计为病例对照研究;(4)纳入文献中应包括种族来源、基因检测方法和CYP1A1*2A多态性位点各基因型分布情况;(5)语种限定为英文和中文。
1.2 排除标准(1)重复发表文献;(2)数据不全文献;(3)对照组基因分布不符合Hardy-Weinberg(H-W) 遗传平衡定律。
1.3 文献检索中文检索词为“细胞色素氧化酶P4501A1”、 “急性淋巴细胞白血病”和“儿童”;英文检索词包括“polymorphism”、“acute lymphocytic leukemia”、 “CYP1A1*2A” 和“childhood leukemia”。检索数据库包括PubMed、OVID数据库、中国生物医学文献数据库、中国知网和万方数据库,文献检索起止时间为1999年1月至2015年4月,并手工检索所有文献的相关参考文献。
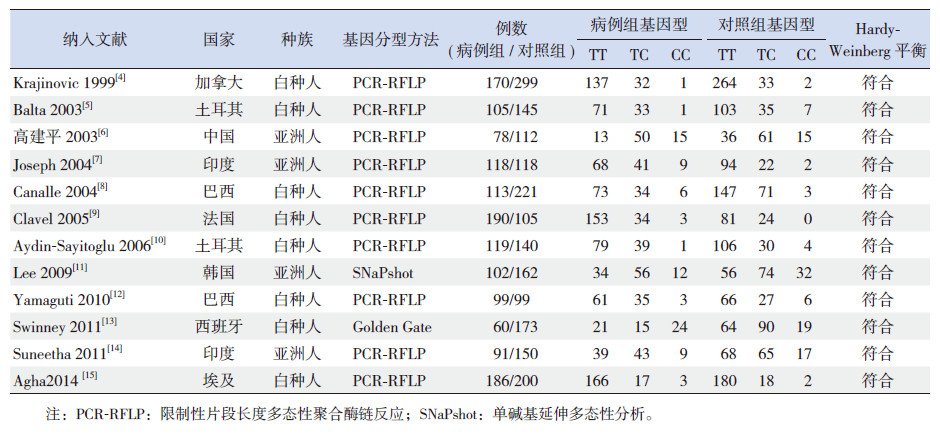
1.4 文献资料提取根据纳入、排除标准严格筛选文献,并提取相关内容,包括作者、发表年份、国家、种族、样本量、实验方法和CYP1A1*2A多态位点各基因型分布情况,资料不全者联系通讯作者予以补齐。
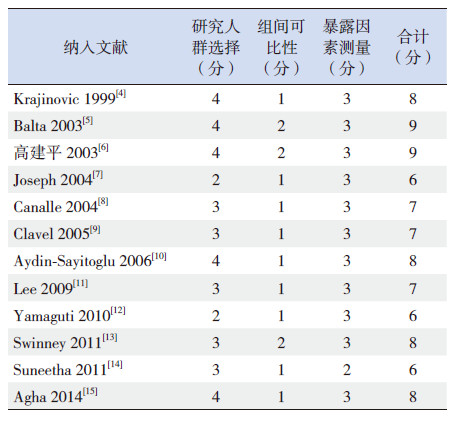
1.5 文献质量评价文献质量评价根据纽卡斯尔-渥太华量表Newcastle-Ottawa Scale(NOS)[3]中的3个方面,包括研究对象的选择(总分4分)、组间可比性(总分2分)及暴露因素(总分3分)对各纳入文献进行评价,总得分≥5分表示高质量文献。
1.6 统计学分析用卡方检验对纳入文献的对照组行H-W 平衡检验,P>0.05为符合遗传平衡;利用STATA 12.0软件进行Meta分析,以风险比(odds ratio, OR)及 95%可信区间(confidence intervals, CI)表示各基因模型与ALL易感性的关系;用Q检验和I2统计量判断文献间的异质性,若无统计学异质性(I2≤50%),采用固定效应模型进行Meta分析,否则用随机效应模型。采用Begg秩相关法和Egger回归法评估文献是否存在发表偏倚。
2 结果 2.1 文献检索结果初检得到相关文献39篇(英文33篇,中文6篇),剔除重复文献4篇以及不符合纳入标准文献23篇,最终纳入文献12篇(英文11篇,中文1篇)。
2.2 纳入文献基本特征纳入的12篇文献涉及9个国家,发表年份为1999~2014,其中4篇文献的研究对象为亚洲人,8篇为白种人,包含的总病例数为3 355例。对纳入文献用NOS量表进行质量评价,结果表明均为高质量的病例-对照研究(表 1),且均符合H-W遗传平衡定律。纳入文献的基本情况见表 2。
| 表 1 纳入文献的质量评估 |
| 表 2 纳入文献的基本情况 |
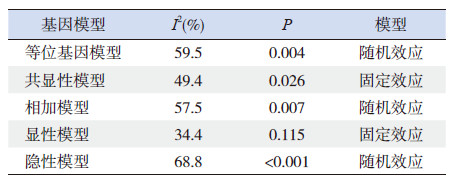
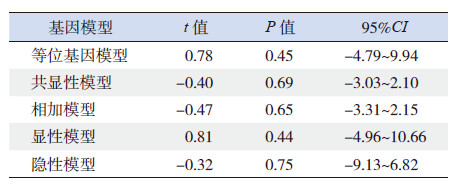
对纳入12篇文献的CYP1A1*2A多态位点各基因模型进行异质性检验(表 3),发现等位基因模型(C vs T)、相加模型(CC vs TT)和隐性模型(CC vs TC+CC)表现出统计学异质性,采用随机效应模型进行Meta分析,而显性模型(CC+TC vs TT)和共显性模型(TC vs TT)不存在统计学异质性,采用固定效应模型进行Meta分析。
| 表 3 文献间异质性分析 |
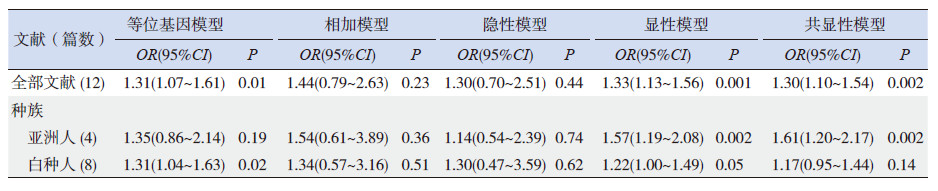
Meta分析结果提示,等位基因模型(C vs T)(OR=1.31,95%CI: 1.07~1.61)(图 1)、显性模型(CC+TC vs TT)(OR=1.33,95%CI: 1.13~1.56)(图 2)和共显性模型(TC vs TT)(OR=1.30,95%CI: 1.10~1.54)(图 3)中基因多态性可增加儿童ALL发生风险,而相加模型(CC vs TT)(OR=1.44,95%CI: 0.79~2.63)和隐性模型(CC vs TC+CC)(OR=1.30,95%CI: 0.70~2.51)中基因多态性与儿童ALL易感性无关,见表 4。
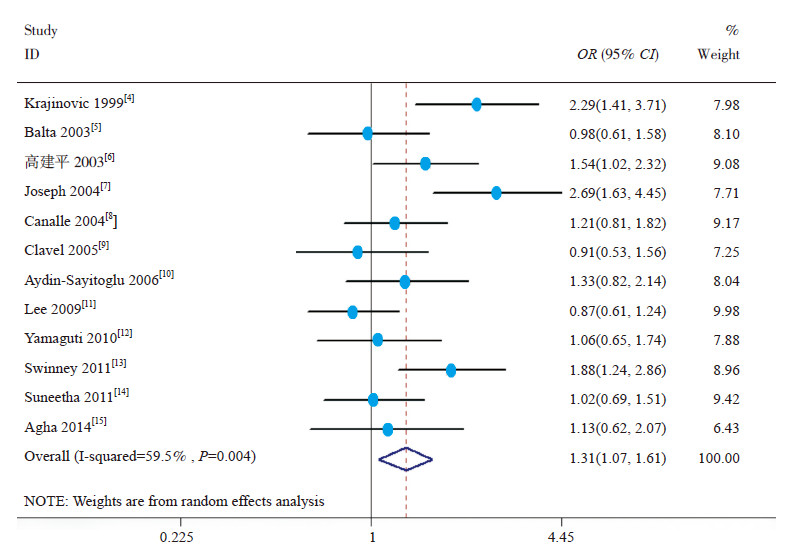 |
图 1 CYP1A1*2A 多态性等位基因模型与儿童ALL 易感性的关系 |
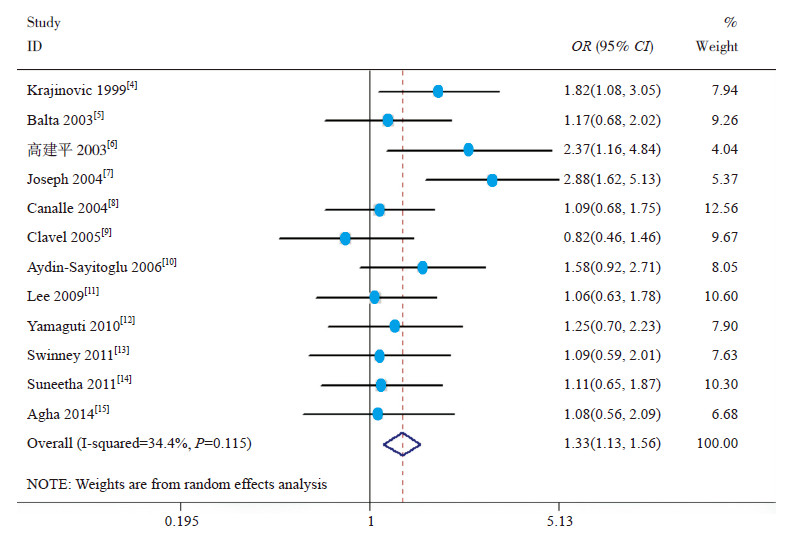 |
图 2 CYP1A1*2A 多态性显性模型与儿童ALL 易感性的关系 |
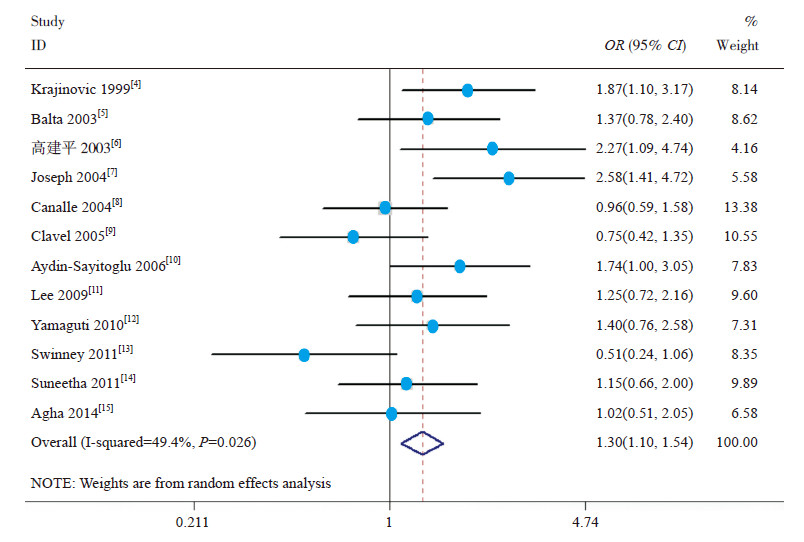 |
图 3 CYP1A1*2A 多态性共显性模型与儿童ALL 易感性的关系 |
| 表 4 CYP1A1*2A 多态性与儿童ALL 易感性的Meta 分析结果 |
按照种族进行亚组分析,结果发现亚洲人的显性模型(CC+TC vs TT)(OR=1.57,95%CI: 1.19~2.08)和共显性模型(TC vs TT)(OR=1.61,95%CI: 1.20~2.17)以及白种人的等位基因模型(C vs T)(OR=1.31,95%CI: 1.04~1.63)和显性模型(CC+TC vs TT)(OR=1.22,95%CI: 1.00~1.49)与增加儿童ALL发生风险相关,其余各基因模型与儿童ALL易感性无关,见表 4。
2.5 敏感性分析通过逐一排除的方法进行敏感性分析,以相加模型(CC vs TT)进行分析,发现剔除Swinney 2011[13]等研究后合并效应值最小(OR=1.18,95%CI: 0.82~1.70),而剔除Lee 2009[11]等研究后合并效应值最大(OR=1.79,95%CI: 1.24~2.57),前后结果不稳定,即纳入文献间存在一定异质性。
2.6 发表偏倚用Begg秩相关法和Egger回归法对各基因模型进行发表偏倚分析,Egger回归法结果显示均P>0.05,且95%CI均包括0(表 5),提示各基因模型均无发表偏倚。
| 表 5 CYP1A1*2A 多态性与儿童ALL 易感性Meta 分析的发表偏倚分析 |
CYP1A1酶可催化代谢前致癌物(如多环芳烃化合物),并通过一系列的环氧化作用,使其具有致癌性。大量研究发现CYP1A1基因多态性与多种肿瘤易感性相关,其中CYP1A1*2A多态性为研究热点,其突变纯合型CC可使酶活性增加[16, 17]。Steffen等[18]研究表明儿童ALL易感性可能和多环芳烃化合物接触史相关,然而,由于研究方法、样本来源等不同,目前关于CYP1A1*2A多态性与儿童ALL发生风险的相关研究尚未得出确切结论,因此,本研究对国内外已发表的相关研究进行汇总分析,研究结果更加可靠。
本研究根据纳入、排除标准,最终纳入12篇文献,各研究质量评分均显示为高质量文献,并且各对照组基因分布符合H-W遗传平衡定律,即具有群体代表性,表明本次研究结果基本真实可信。另外,为降低其他混杂因素对Meta分析结果的影响,本研究就种族来源进行亚组分析,排除种族差异对结果的影响。本研究通过各基因模型探讨CYP1A1*2A多态性与儿童ALL易感性的关系,结果如下:(1)等位基因模型、显性模型和共显性模型中基因多态性与儿童ALL易感性相关,此结果和Han等[19]关于CYP1A1*2A多态性与儿童白血病易感性的Meta分析结果相似,且该研究[19]发现CYP1A1*2A多态性和急性髓细胞性白血病预后有关,携带等位基因C者预后较T者差[20],这可能和等位基因C能使CYP1A1酶活性增加有关,从而影响白血病的易感性和预后。除外,同时携带CYP1A1*2A和NQO1*2多态性位点者ALL预后更差[21];(2)基于种族来源的亚组分析结果发现,亚洲人的显性模型和共显性模型,以及白种人的等位基因模型和显性模型与增加儿童ALL发生风险相关,说明排除种族干扰后,CYP1A1*2A多态性与儿童ALL易感性仍相关,即CYP1A1*2A多态性增加儿童ALL发生风险并无种族差异性。然而,目前国内外尚未见关于CYP1A1*2A多态性与不同性别ALL患儿易感性的相关报道,故未能做对比分析。另外,本Meta 分析敏感性分析发现,排除不同研究后,Meta分析合并效应量不同,说明纳入文献间存在一定异质性。本研究就不同基因模型采用不同方法进行合并效应量的计算,进而提高了结果的可信度。发表偏倚是影响Meta分析结果的重要因素之一,本研究就纳入文献各基因模型进行了发表偏移评估,结果显示各基因模型均未见发表偏倚,肯定了本研究结果的可信性。
本研究的局限性:(1)仅就亚洲人和白种人进行分析,缺少其他人群的相关报道;(2)由于各文献报道情况不一,未能对年龄、性别等情况进行亚组分析;(3)仅就正式发表文献进行分析,并未纳入正在发表、尚未发表的相关文献,可能存在发表偏倚;(4)缺乏中英文以外其他语言形式的相关信息。
综上所述,本Meta分析显示CYP1A1*2A多态性与增加儿童ALL发生风险有关,该多态性可能是导致ALL发生的遗传易感因素之一。
| [1] | Moulik NR,Parveen F,Kumar A,et al.Glutathione-Stransferase polymorphismand and acute lymphoblastic leukemia (ALL) in north Indian children:a case-control study and metaanalysis[J].J Hum Genet,2014,59(9):529-535. |
| [2] | Li X,Liao Q,Zhang S,et al.Association of methylenetetrahytrofolate reductase (MTHFR) C677T and A1298C polymorphisms with the susceptibility of childhood acute lymphoblastic leukaemia (ALL) in Chinese population[J]. Eur J Med Res,2014,19(1):5. |
| [3] | Margulis AV,Pladevall M,Riera-Guardia N,et al.Quality assessment of observational studies in a drug-safety systematic review,comparison of two tools:the Newcastle-Ottawa Scale and the RTI item bank[J].Clin Epidemiol,2014,6:359-368. |
| [4] | Krajinovic M,Labuda D,Richer C,et al.Susceptibility to childhood acute lymphoblastic leukemia:influence of CYP1A1, CYP2D6,GSTM1,and GSTT1 genetic polymorphisms[J]. Blood,1999,93(5):1496-1501. |
| [5] | Balta G,Yuksek N,Ozyurek E,et al.Characterization of MTHFR,GSTM1,GSTT1,GSTP1,and CYP1A1 genotypes in childhood acute leukemia[J].Am J Hematol,2003,73(3):154-160. |
| [6] | 高建平,黄跃东,梁建平,等.CYP1A1基因多态性与急性淋巴细胞白血病的关系[J].中国优生与遗传杂志,2003,11(5): 21-24. |
| [7] | Joseph T,Kusumakumary P,Chacko P,et al.Genetic polymorphism of CYP1A1,CYP2D6,GSTM1 and GSTT1 and susceptibility to acute lymphoblastic leukaemia in Indian children[J].Pediatr Blood Cancer,2004,43(5):560-567. |
| [8] | Canalle R,Burim RV,Tone LG,et al.genetic polymorphisms and susceptibility to childhood acute lymphoblastic leukemia[J]. Environ Mol Mutagen,2004,43(2):100-109. |
| [9] | Clavel J,Bellec S,Rebouissou S,et al.Childhood leukaemia, polymorphisms of metabolism enzyme genes,and interactions with maternal tobacco,coffee and alcohol consumption during pregnancy[J].Eur J Cancer Prev,2005,14(6):531-540. |
| [10] | Aydin-Sayitoglu M,Hatirnaz O,Erensoy N,et al.Role of cyp2d6,cyp1a1,cyp2e1,gstt1,and gstm1 genes in the susceptibility to acute leukemias[J].Am J Hematol,2006,81(3): 162-170. |
| [11] | Lee KM,Ward MH,Han S,et al.Paternal smoking,genetic polymorphisms in CYP1A1 and childhood leukemia risk[J]. Leuk Res,2009,33(2):250-258. |
| [12] | Yamaguti GG,Louren?o GJ,Silveira VS,et al.Increased risk for acute lymphoblastic leukemia in children with cytochrome p450a1(cyp1a1)-and nad (p) h_quinone oxidoreductase 1(nqo1)-inherited gene variants[J].Acta Haematol,2010,124(3):182-186. |
| [13] | Swinney RM,Beuten J,Collier AB 3rd,et al.Polymorphisms in CYP1A1 and ethnic-specific susceptibility to acute lymphoblastic leukemia in children[J].Cancer Epidemiol Biomarkers Prev,2011,20(7):1537-1542. |
| [14] | Suneetha KJ,Nancy KN,Rajalekshmy KR,et al.Role of glutathione-s-transferase and CYP1A1*2A polymorphisms in the therapy outcome of south Indian acute lymphoblastic leukemia patients[J].Indian J Med Paediatr Oncol,2011,32(1): 25-29. |
| [15] | Agha A,Shabaan H,Abdel-Gawad E,et al.Polymorphism of CYP1A1 gene and susceptibility to childhood acute lymphoblastic leukemia in Egypt[J].Leuk Lymphoma,2014, 55(3):618-623. |
| [16] | Liu C,Jiang Z,Deng QX,et al.Meta-analysis of association studies of CYP1A1 genetic polymorphisms with digestive tract cancer susceptibility in Chinese[J].Asian Pac J Cancer Prev, 2014,15(11):4689-4695. |
| [17] | Zhan P,Wang Q,Qian Q,et al.CYP1A1 MspI and exon7 gene polymorphisms and lung cancer risk:an updated meta-analysis and review[J].J Exp Clin Cancer Res,2011,30:99. |
| [18] | Steffen C,Auclerc MF,Auvrignon A,et al.Acute childhood leukaemia and environmental exposure to potential sources of benzene and other hydrocarbons:a case-control study[J].Occup Environ Med,2004,61(9):773-778. |
| [19] | Han F,Tan Y,Cui W,et al.Novel insights into etiologies of leukemia:a HuGE review and meta-analysisof CYP1A1 polymorphisms and leukemia risk[J].Am J Epidemiol,2013, 178(4):493-507. |
| [20] | Voso MT,D'Alo'F,Gumiero D,et al.The CYP1A1*2a allele is an independent prognostic factor for acute myeloid leukemia[J]. Haematologica,2005,90(7):982-984. |
| [21] | Krajinovic M,Labuda D,Mathonnet G,et al.Polymorphisms in genes encoding drugs and xenobiotic metabolizing enzymes, DNA repair enzymes,and response to treatment of childhood acute lymphoblastic leukemia1[J].Clin Cancer Res,2002,8(3):802-810. |
 2015, Vol. 17
2015, Vol. 17