动脉粥样硬化(atherosclerosis, AS)是一种以脂质沉积、斑块形成、动脉管腔狭窄为特征的慢性炎性病理改变,其发病机制仍未完全阐明。文献报道AS可发生于儿童时期[1, 2]。近年研究发现,硫化氢(hydrogen sulfide, H2S)能够在心血管组织中主要经胱硫醚-γ-裂解酶(cystathionine-γ-lyase, CSE)代谢生成,被认为是心血管系统的新型气体信号分子[3, 4],本课题组前期研究发现在AS的发病过程中存在CSE/H2S通路的紊乱,而H2S能够通过抑制ICAM-1的表达发挥抗AS作用[5],H2S在AS中的保护效应也日益受到广泛关注[6, 7],越来越多的研究指出H2S对AS具有潜在的治疗效应[8, 9]。肾上腺髓质素(adrenomedullin, ADM)和心钠素(atrial natriuretic peptide, ANP)均为重要的血管活性多肽,对维持心血管系统稳态具有重要作用,是参与AS发生发展的重要分子标志物之一。但是作为气体信号分子的H2S对AS发生发展过程中血管活性肽ADM及ANP的表达是否产生影响,目前尚不清楚。NaHS在体内能够转化生成H2S,作为H2S供体是研究内源性H2S生物学效应公认的工具药,在本研究中以NaHS作为H2S供体,在AS大鼠模型中研究H2S对ADM及ANP表达的调节作用。
1 材料与方法 1.1 实验动物及模型的建立、标本取材雄性SD大鼠(购自北京大学第一医院动物实验中心)30只,体重200~220 g,随机分为3组:对照组、AS组和AS+NaHS组(n=10)。AS组和AS+NaHS 组大鼠按每只700 000 U/kg的总剂量腹腔注射维生素D3,分3 d给药,随后给予高脂饲料(2%胆固醇、0.5%胆酸钠、0.2%丙基硫氧嘧啶、10%猪油、5%白糖和82.3%基础饲料)连续喂养8周[10]。三组大鼠常规饲养条件相同。AS+NaHS 组大鼠腹腔注射H2S供体NaHS(每日56 μmol/kg,共8周),对照组和AS组大鼠每日腹腔内注射相同剂量的生理盐水。
高脂喂养8周后,应用20%乌拉坦(10 mL/kg)腹腔注射对大鼠进行麻醉,经腹主动脉取血,分离血浆,用于H2S含量及ADM、ANP浓度的测定,分别分离主动脉近心端组织约0.5 cm2及冠状动脉起始部连同心肌组织约0.3 cm2大小,用于主动脉和冠状动脉动脉粥样硬化病变的评估。
1.2 主动脉和冠状动脉AS病变的评估取分离的主动脉近心端组织及冠状动脉起始部连同心肌组织,应用4%多聚甲醛固定8 h,去离子水冲洗后浸泡至20%蔗糖溶液中,待OCT包埋,制备冰冻切片。将主动脉根部及冠状动脉起始部组织冰冻切片进行油红O染色,莱卡图像分析系统对油红O染色阳性的粥样硬化病变面积进行分析。病变面积百分比计算方法是主动脉根部(或冠状动脉)油红O染色阳性的面积除以主动脉内膜和中膜总面积(或冠状动脉总面积)。
1.3 血浆H2S含量的测定动脉取血在4℃条件下,3 000转/min离心10 min分离血浆,用敏感硫电极法(PXS-270,上海)测定血浆中的H2S含量。取0.5 mL的血浆及标准溶液分别与等体积抗氧化液充分混合后,将敏感硫电极与参比电极同时浸入,待读数稳定后记录,根据S2-溶液的标准曲线计算出血浆中H2S的含量。
1.4 血浆ADM及ANP浓度的测定动脉血予EDTA和抑肽酶抗凝,4℃条件下,3 000转/min,离心10 min,取上清得到血浆。血浆ADM及ANP含量的测定应用放射免疫试剂盒(解放军总医院放射免疫所,北京,中国)。
1.5 统计学分析采用SPSS 13.0统计软件进行统计学分析,计量资料以均数±标准差( x±s)表示,多组间均数的比较采用单因素方差分析(one-way ANOVA),组间两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果 2.1 大鼠主动脉根部及冠状动脉AS斑块的面积分析各组大鼠主动脉根部AS斑块面积比较差异有统计学意义(F=155.62,P<0.001)。对照组大鼠主动脉根部无粥样硬化斑块形成,AS组大鼠主动脉根部出现明显的AS斑块(12.2%±2.8%,P<0.01);AS+NaHS组大鼠主动脉根部粥样硬化斑块面积较AS组显著缩小(1.5%±0.9%,P<0.01),与对照组比较差异无统计学意义(P>0.05)。见图 1~2。
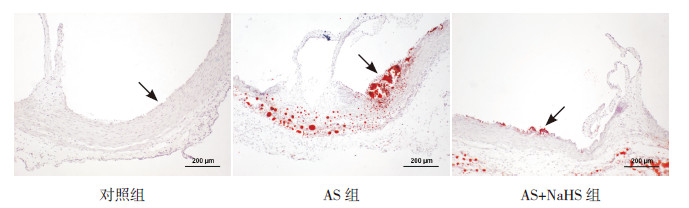 |
图 1 各组大鼠主动脉根部粥样硬化斑块比较(油红O 染色,×100) 对照组大鼠主动脉根部无粥样硬化斑块形成(箭头所示);AS 组大鼠主动脉根部出现明显的粥样硬化斑块(箭头所示);AS+NaHS 组大鼠主动脉根部粥样硬化斑块面积较AS 组显著缩小(箭头所示)。 |
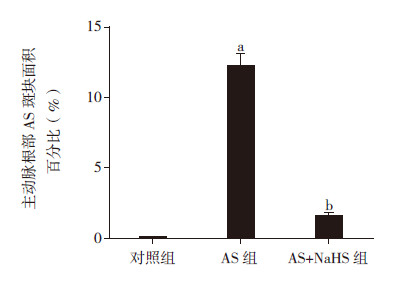 |
图 2 各组大鼠主动脉根部AS 斑块面积比较(n=10) a 示与对照组比较,P < 0.01;b 示与AS 组比较,P < 0.01。 |
各组大鼠冠状动脉AS斑块面积比较差异有统计学意义(F=144.89,P<0.001)。对照组大鼠冠状动脉无粥样硬化斑块形成,AS组大鼠冠状动脉出现明显的AS斑块(20.5%±4.8%,P<0.01);AS+NaHS组大鼠冠状动脉AS斑块面积较AS组显著缩小(P<0.01),但仍大于对照组(P<0.01)。见图 3~4。
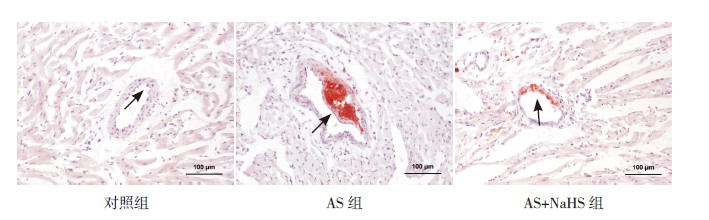 |
图 3 各组大鼠冠状动脉AS 斑块比较(油红O 染色,×200) 对照组大鼠冠状动脉无明显AS 斑块形成(箭头所示);AS 组大鼠冠状动脉形成明显的AS 斑块(箭头所示);AS+NaHS 组大鼠冠状动脉AS 斑块面积显著缩小(箭头所示)。 |
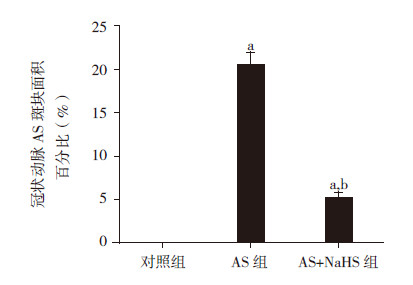 |
图 4 各组大鼠冠状动脉AS 斑块面积比较(n=10) a 示与对照组比较,P < 0.01;b 示与AS 组比较,P < 0.01。 |
各组大鼠血浆H2S、ADM和ANP含量比较差异有统计学意义(P<0.01)。与对照组比较,AS组大鼠血浆H2S和ANP含量明显降低,而ADM含量明显升高(P<0.01);给予NaHS后,AS大鼠血浆H2S和ANP含量显著升高,ADM含量明显下降(P<0.01)。AS+NaHS组大鼠与对照组比较,血浆H2S升高(P<0.05),ANP及ADM差异无统计学意义(P>0.05)。见表 1。
| 表 1 各组大鼠血浆H2S、ADM、ANP 浓度比较 |
AS是众多心血管疾病共同的病理基础,阐明其发病机制是心血管领域的研究热点和难点。H2S作为一种新型内源性气体信号分子,具有广泛的心血管生物学特性,并参与AS的发生发展[5, 6, 7]。研究表明高脂饮食小鼠肝组织CSE表达减少,H2S生成明显不足[11],内源性H2S生成减少可显著促进AS的形成[12],而过表达CSE基因或给予H2S供体均能够明显抑制AS的形成[13, 14];临床研究发现,北京地区血脂紊乱儿童的H2S水平与血脂成分异常具有明确的相关性[15],血浆H2S水平在成人心血管疾病患者中也发生着不同程度的改变[16]。本研究以大剂量维生素D及高脂饮食喂养构建大鼠AS模型,发现AS大鼠主动脉根部和冠状动脉出现明显的AS斑块,而应用H2S供体NaHS干预后,AS斑块面积显著减小,提示H2S能够显著地抑制AS斑块形成。分析其原因,可能与H2S可通过维持内皮功能稳态、抑制血管平滑肌细胞增殖、调节炎症反应和抑制氧化应激等途径来拮抗AS的形成有关[17, 18, 19, 20]。
血管活性多肽是由心血管系统合成和分泌的小分子活性物质,对AS相关心血管疾病的诊断治疗发挥重要作用[21]。ADM是一种由52个氨基酸组成的血管活性肽,广泛分布于机体的各种组织和器官中,并对心血管系统具有重要的调节作用。研究认为,AS的危险因素能够促使血浆ADM升高,补充ADM能够缓解apoE-/-小鼠主动脉AS的发展[22],此作用可能与其改善内皮功能、抑制血管平滑肌细胞的增殖和迁移、影响动脉硬化斑块发展早期血流动力学的改变有关[23, 24]。本研究发现,AS组大鼠血浆ADM含量明显增高,考虑与机体在病理损伤过程中反应性激活保护性因子ADM生成有关;而给予NaHS能够降低血浆ADM含量,可能是因为随着体内H2S含量回升,可改善内皮功能及调节血管平滑肌的增殖,AS的损伤程度明显减轻。
ANP是由126个氨基酸组成的多肽,是主要由心房肌细胞产生和分泌的一种多肽激素,其通过与受体结合,引起cGMP水平升高,发挥有效的利尿、利钠、舒张血管的作用,进而维持水盐平衡及血压的稳定,对心血管系统具有十分重要的调节作用[25]。研究认为,ANP能够降低内皮细胞渗透性,调节细胞凋亡,抑制平滑肌细胞增殖和迁移和氧化应激[26, 27, 28, 29]。本研究发现AS组大鼠血浆ANP含量明显下降;而给予NaHS能够使血浆H2S水平接近正常,同时升高血浆ANP的含量,提示NaHS可通过提高血浆ANP来拮抗AS形成。
综上,本研究发现,应用H2S供体NaHS可以抑制AS大鼠主动脉和冠状动脉AS斑块的形成和发展,其对ADM及ANP具有一定的调节作用,虽然其具体作用环节及详细机制尚待进一步研究,但此研究为AS为模型的疾病状态下气体信号分子与心血管活性物质之间的相互关系的研究提供了研究基础。
| [1] | Herouvi D, Karanasios E, Karayianni C, et al. Cardiovascular disease in childhood: the role of obesity[J]. Eur J Pediatr, 2013, 172(6): 721-732. |
| [2] | Berenson GS, Srinivasan SR, Bao W, et al. Association between multiple cardiovascular risk factors and atherosclerosis in children and young adults[J]. N Engl J Med, 1998, 338(23): 1650-1656. |
| [3] | Yu XH, Cui LB, Wu K, et al. Hydrogen sulfide as a potent cardiovascular protective agent[J]. Clin Chim Acta, 2014, 437: 78-87. |
| [4] | 王新宝, 金红芳, 杜军保. 新型气体信号分子硫化氢在心血管疾病中的意义[J]. 中国当代儿科杂志, 2009, 11(9): 790-793. |
| [5] | Wang Y, Zhao X, Jin H, et al. Role of hydrogen sulfide in the development of atherosclerotic lesions in apolipoprotein E knockout mice[J]. Arterioscler Thromb Vasc Biol, 2009, 29(2): 173-179. |
| [6] | Mani S, Untereiner A, Wu L, et al. Hydrogen sulfide and the pathogenesis of atherosclerosis[J]. Antioxid Redox Signal, 2014, 20(5): 805-817. |
| [7] | Qiao W, Chaoshu T, Hongfang J, et al. Endogenous hydrogen sulfide is involved in the pathogenesis of atherosclerosis[J]. Biochem Biophys Res Commun, 2010, 396(2): 182-186. |
| [8] | Xu S, Liu Z, Liu P. Targeting hydrogen sulfide as a promising therapeutic strategy for atherosclerosis[J]. Int J Cardiol, 2014, 172(2): 313-317. |
| [9] | Lynn EG, Austin RC. Hydrogen sulfide in the pathogenesis of atherosclerosis and its therapeutic potential[J]. Expert Rev Clin Pharmacol, 2011, 4(1): 97-108. |
| [10] | Huang ZY, Yang PY, Almofti MR, et al. Comparative analysis of the proteome of left ventricular heart of arteriosclerosis in rat[J]. Life Sci, 2004, 75(26): 3103-3115. |
| [11] | Peh MT, Anwar AB, Ng DS, et al. Effect of feeding a high fat diet on hydrogen sulfide (H2S) metabolism in the mouse[J]. Nitric Oxide, 2014, 41: 138-145. |
| [12] | Mani S, Li H, Untereiner A, et al. Decreased endogenous production of hydrogen sulfide accelerates atherosclerosis[J]. Circulation, 2013, 127(25): 2523-2534. |
| [13] | Cheung SH, Kwok WK, To KF, et al. Anti-atherogenic effect of hydrogen sulfide by over-expression of cystathionine gammalyase (CSE) gene[J]. PLoS One, 2014, 9(11): e113038. |
| [14] | Liu Z, Han Y, Li L, et al. The hydrogen sulfide donor, GYY4137, exhibits anti-atherosclerotic activity in high fat fed apolipoprotein E-/- mice[J]. Br J Pharmacol, 2013, 169(8): 1795-1809. |
| [15] | 刘颖, 米杰, 丁亚光, 等. 北京地区部分儿童血脂现状调查及气体分子硫化氢在血脂紊乱中的变化[J]. 北京大学学报( 医学版), 2006, 38(2): 146-150. |
| [16] | Peter EA, Shen X, Shah SH, et al. Plasma free H2S levels are elevated in patients with cardiovascular disease[J]. J Am Heart Assoc, 2013, 2(5): e000387. |
| [17] | Altaany Z, Moccia F, Munaron L, et al. Hydrogen sulfide and endothelial dysfunction: relationship with nitric oxide[J]. Curr Med Chem, 2014, 21(32): 3646-3661. |
| [18] | Baskar R, Sparatore A, Del Soldato P, et al. Effect of S-diclofenac, a novel hydrogen sulfide releasing derivative inhibit rat vascular smooth muscle cell proliferation[J]. Eur J Pharmacol, 2008, 594(1-3): 1-8. |
| [19] | Wang XH, Wang F, You SJ, et al. Dysregulation of cystathionine γ-lyase (CSE)/hydrogen sulfide pathway contributes to ox-LDLinduced inflammation in macrophage[J]. Cell Signal, 2013, 25(11): 2255-2262. |
| [20] | Wen YD, Wang H, Kho SH, et al. Hydrogen sulfide protects HUVECs against hydrogen peroxide induced mitochondrial dysfunction and oxidative stress[J]. PLoS One, 2013, 8(2): e53147. |
| [21] | Watanabe T, Sato K, Itoh F, et al. Emerging roles for vasoactive peptides in diagnostic and therapeutic strategies against atherosclerotic cardiovascular diseases[J]. Curr Protein Pept Sci, 2013, 14(6): 472-480. |
| [22] | Pan CS, Zhang J, Yu F, et al. Adrenomedullin ameliorates the development of atherosclerosis in apoE-/- mice[J]. Peptides, 2010, 31(6): 1150-1158. |
| [23] | Nakayama M, Takahashi K, Murakami O, et al. Adrenomedullin in monocytes and macrophages: possible involvement of macrophage-derived adrenomedullin in atherogenesis[J]. Clin Sci (Lond), 1999, 97(2): 247-251. |
| [24] | Gotts?ter M, Ford LB, Ostling G, et al. Adrenomedullin is a marker of carotid plaques and intima-media thickness as well as brachial pulse pressure[J]. J Hypertens, 2013, 31(10): 1959-1965. |
| [25] | De Vito P. Atrial natriuretic peptide: an old hormone or a new cytokine[J]? Peptides, 2014, 58: 108-116. |
| [26] | Ichiki T1, Izumi R, Cataliotti A, et al. Endothelial permeability in vitro and in vivo: protective actions of ANP and omapatrilat in experimentalatherosclerosis[J]. Peptides, 2013, 48: 21-26. |
| [27] | Larifla L, Déprez I, Pham I, et al. Inhibition of vascular smooth muscle cell proliferation and migration in vitro and neointimal hyperplasia in vivo by adenoviral-mediated atrial natriuretic peptide delivery[J]. J Gene Med, 2012, 14(7): 459-467. |
| [28] | Gao P, Huang L. New insights into the role of natriuretic peptides in the regulation of apoptosis in cardiovascular system [J]. Saudi Med J, 2009, 30(5): 595-604. |
| [29] | De Vito P, Incerpi S, Pedersen JZ, et al. Atrial natriuretic peptide and oxidative stress[J]. Peptides, 2010, 31(7): 1412-1419. |
 2015, Vol. 17
2015, Vol. 17



