多种疾病引起,也可以是肿瘤浸润,尤其是无痛性的实性结节更应警惕恶性病变,初诊医师应慎重对待患者的最初病理结果,必要时多家医院会诊,避免可能的漏诊。当疾病进展合并有出血瘀斑及血象改变时除考虑常见白血病等血液系统疾病外,需考虑到特殊类型的淋巴瘤等疾病的皮肤及骨髓浸润。
1 病例介绍患儿女,7岁,因左下肢结节5月余,全身淋巴结肿大2个月,皮肤瘀斑3 d入院。患儿于9个月前无明显诱因于左大腿后部中段出现无痛性结节并于当地医院行局部肿块切除术,术后病理结果未发现异常(具体不详)。当时无淋巴结肿大,血常规无异常,无发热等其他不适,故未行进一步治疗。2个月后新发左腹股沟淋巴结肿大,血常规检查提示中性粒细胞稍高,自行予局部敷中药后淋巴结缩小,仍未行进一步治疗。2个月后患儿皮肤多处瘀斑,双眼呈“熊猫眼征”,遂入我院诊治。
入院体查:体温36.7℃,脉搏87次/分,呼吸23次/分,血压115/80 mm Hg。眼眶周围、结膜、口腔黏膜、腹股沟区及原结节活检处均出现呈片状散在分布的皮肤出血及瘀斑,直径约4 cm (图 1);颈部、腋窝、腹股沟区均可触及肿大淋巴结,最大约为3 cm×4 cm、质地硬、表面光滑,可活动、无明显压痛;肝肋下约15 mm,脾肋下约16 mm,边缘光滑,质韧,无压痛。血常规检查示:Hb 45 g/L,WBC 15.3×109/L,RBC 3.98×1012/L,PLT 2×109/L,N 9.0×109/L,L 33%。血生化检查示乳酸脱氢酶505.0 U/L (参考范围100~300 U/L),余正常。凝血功能检查示纤维蛋白原1.97 g/L (参考范围2~4 g/L),血浆纤维蛋白原降解产物32.36 mg/L (参考范围<10 mg/L),D-二聚体2.00 mg/L (参考范围0~0.50 mg/L),余正常。入院后彩超示:双侧颈部及左侧锁骨上窝、腹股沟淋巴结肿大,颈部较大者20 mm×7 mm,左侧锁骨上窝较大者7 mm×6 mm,腹股沟淋巴结肿大,最大达40 mm×25 mm,腹膜后淋巴结较大约为28 mm×16 mm,肝稍大,肋下约15 mm,脾稍大,肋下16 mm。骨髓细胞学检查示骨髓细胞增生活跃,可见约36%分型不明的异常细胞,胞体偏大,胞浆量少,未见明显颗粒,部分可见拖尾现象,核椭圆型。POX (-),苏丹B染色(-),酸性磷酸酶(ACP)阳性率82%,非特异性酯酶94%,氟化钠抑制试验64%。幼稚细胞PAS染色96%阳性,呈细颗粒弥散状。骨髓流式免疫分析示CD45表达较单核细胞弱且SSC较淋巴细胞稍大区域可见异常细胞群,占有核细胞的19%,主要表达CD4(+),CD33(+),CD56(+),CD123(+),部分表达CD117、CD304。结合患儿骨髓形态学及免疫分析考虑急性髓细胞白血病(AML) M5型或瘤性白血病可能,但无法对其进一步分型。行腹股沟区皮肤结节活检示:皮肤真皮纤维组织增生,少量炎性细胞浸润,未发现明显异常细胞。故再次会诊起病时的皮肤结节病理片,考虑淋巴造血细胞恶性肿瘤,并结合免疫组化反应,母细胞性浆细胞样树突状细胞肿瘤(blastic plasmacytoid dendritic cell neoplasm,BPDCN)可能性大。免疫组化示CD56(3+)、CD4(+)、CD3(-)、CD8(-)、CD20(-)、CD79a (-)、Tdt (-)、Ki67(40%)、CD30(+)、ALK (-)、MPO (-)(图 2)。同时送中山大学肿瘤防治中心病理科会诊示:镜下见带表皮组织一块,真皮及皮下大量深染小圆细胞弥漫浸润,与增生的胶原纤维交织,肿瘤细胞胞浆少,染色质细,核膜、核仁不明显,核分裂相易见(图 3)。免疫组化示CD56(+),CD4弥漫(+),CD123弥漫(+),Tdt (-),MPO (-),Ki67热点区域40%,原位杂交EBERS (-),TCR基因重排(-)。
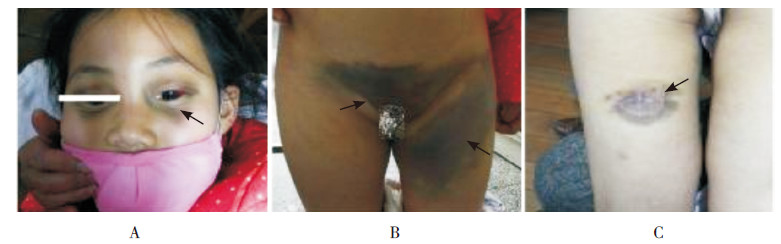 |
图 1 患儿的皮肤表现 眼眶周围(A)、腹股沟区皮肤(B)及皮肤活检处(C)皮肤出血及瘀斑(箭头所示)。 |
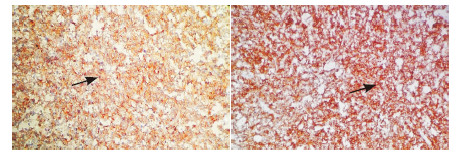 |
图 2 病理切片免疫组化结果(×400) A:以CD4单抗抗体染色后见瘤细胞染浅棕色(箭头所示),呈中度阳性,故为CD4(+);B:以CD56单抗体染色后见瘤细胞广泛染深棕色,呈强阳性(箭头所示),故为CD56(3+)。 |
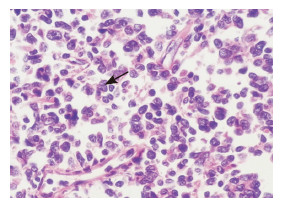 |
图 3 皮肤活检病理切片(×200) 镜下见带表皮组织一块,真皮及皮下大量深染小圆细胞弥漫浸润,与增生的胶原纤维交织,肿瘤细胞胞浆少,染色质细,核膜、核仁不明显,核分裂相易见(箭头所示)。 |
本例患儿以皮肤出现无痛性结节起病,2个月后出现左腹股沟淋巴结肿大,而后患儿皮肤多处瘀斑,双眼呈“熊猫眼征”。入院体查见眼眶周围、结膜、口腔黏膜、腹股沟区及原结节活检处均出现呈片状散在分布的皮肤出血及瘀斑;颈部、腋窝、腹股沟区均可触及肿大淋巴结,肝脾肿大,无压痛。由于临床表现以皮肤浸润症状为主,故曾考虑急性非淋巴细胞白血病及一些皮肤恶性淋巴瘤的可能。AML虽然可出现弥散性斑丘疹、硬性结节、肿块及淋巴结肿大,但表达T细胞相关抗原,且可出现骨髓完全缓解但皮肤损害进一步加重的现象。而一些瘤性白血病如原发皮肤结外NK/T细胞淋巴瘤(鼻型)少数病例可无典型的鼻腔侵犯表现(鼻堵、鼻腔分泌物增多、鼻衄、呼吸不畅等),发病早期仅有皮肤结节、皮疹、皮肤瘀斑等皮损症状,并伴贫血和血小板减少[1, 2],多来源于NK细胞或毒性T细胞,并高表达T细胞细胞内抗原-1(TIA-1),与EB病毒的感染有关。组织病理上可出现大片样坏死、血管浸润和多型细胞[3, 4]。蕈样肉芽肿则病情进展较慢,分为4个阶段,起初为皮肤小面积斑点,后逐渐扩大,直至出现肝、肺、骨髓等各器官的浸润症状,为T细胞源性[5],免疫组化示CD4(+)、CD56(-)、CD123(-)。BPDCN患儿临床症状多以皮肤损害为主,常为挫伤样皮损,表现为各种大小、形状、颜色如无痛性结节、肿块、淡紫色瘀斑、淤青或斑点,直径从几毫米到10 cm不等,少数可出现溃疡。儿童BPDCN大多以皮肤损害为首发表现[6, 7]。Sakashita等[8]通过收集已报道的33名BPDCN患儿的临床资料发现其中仅有8名患儿无皮肤损害表现。Jegalian等[9]通过对29名BPDCN患儿的研究发现,仅7名患儿无皮肤损伤症状(这一比例高于成人)。除可侵犯皮肤外,还可迅速浸润黏膜、淋巴结、肌肉、肝脾、骨髓、外周血等处,中枢神经系统累及较为少见,临床上可呈现口腔内淡紫色斑块[10],全身多处浅表淋巴结肿大,肝脾肿大、贫血、发热、感染等。本例患儿以皮肤结节、瘀斑为首发症状,且病情进展迅速,数月内即侵犯黏膜、肝脾、骨髓、外周血等,并伴发热。根据其临床表现及骨髓形态学初步考虑诊断为瘤性白血病,但却难以对其进一步分型,此时应考虑为一些特殊类型的造血系统肿瘤的骨髓受累,如BPDCN等。
3 进一步检查(1) 骨髓细胞学检查:有助于鉴别临床上一些原因不明的发热、原因不明的肝、脾、淋巴结大,外周血出现幼稚细胞、可疑细胞以及血细胞的单项或多项原因不明的减少是否由造血系统疾病引起。本例患儿骨髓细胞学检查结果示:可见约36%分型不明的异常细胞,故提示为造血系统恶性疾病或恶性肿瘤骨髓受累。
(2)骨髓流式免疫分析:骨髓形态学已经可以确定为急性白血病或恶性肿瘤骨髓受累,免疫学、分子生物学和遗传学检查对于目前的血液肿瘤疾病的诊断以及急性白血病分型和预后具有重要的意义。本例患儿骨髓流式免疫分析结果示:CD45表达较单核细胞弱且SSC较淋巴细胞稍大区域可见异常细胞群,占有核细胞的19%,主要表达HLA-DR(+)、CD4(+)、CD33(+)、CD56(+)、CD123(+),部分表达CD117、CD304。免疫组化结果示:CD56(3+)、CD4(+)、CD3(-)、CD8(-)、CD20(-)、CD79a(-)、Tdt(-)、Ki67(40%)、CD30(+)、ALK(-)、MPO(-),EBER原位杂交(-)。以上结果提示BPDCN的可能性大。
(3)染色体和基因检查:不同的白血病常有各自的特征性染色体异常,因此染色体检查有助于白血病的诊断和预后判定。染色体和基因决定细胞生长增殖、分化成熟与衰老死亡,也就是说血细胞的异常增多或减少、分化成熟障碍、过度衰老死亡是由染色体、基因掌控的。如果染色体、基因出现异常,必然会影响血细胞的细胞生长增殖、分化成熟与衰老死亡,使之失控,导致疾病的产生与发展。本例患儿染色体检查:46XY。基因检测:白血病基因筛查未检测出相关基因。
(4)皮肤结节病理切片及免疫组化:了解病变的性质,协助临床对病变做出诊断或为排除诊断提供线索。本例患儿皮肤结节病理切片结果示淋巴造血细胞恶性肿瘤、肿瘤细胞为非亲表皮浸润,此为BPDCN的特征性皮肤浸润表现,同时也排除了原发皮肤结外NK/T细胞淋巴瘤(鼻型)的诊断;免疫组化提示:CD56(3+)、CD4(+)CD3(-)、CD8(-)、CD20(-)、CD79a(-)、Tdt(-)、Ki67(40%)、CD30(+)、ALK(-)、MPO(-),EBER原位杂交(-)。从患儿的免疫组化及骨髓流式免疫分析结果可知,表达CD4、CD56、CD123且不表达T、B细胞相关抗原,故排除了AML和其他瘤性白血病,可以明确诊断为BPDCN。
4 确诊依据确诊依据包括:(1)病程进展迅速;(2)皮肤出现无痛性结节、淡紫色瘀斑;(3)有淋巴结、肝脾及骨髓受累;(4)皮肤活检病理切片为非亲表皮浸润;(5)免疫组化示CD4(+)、CD56(+)、CD123(+),不表达T、B细胞相关抗原。并伴骨髓受累,骨髓流式分析同时表达CD4(+)、CD56(+)、CD123(+)。
5 临床经过在骨髓形态学及免疫分析提示瘤性白血病后,予以阿糖胞苷100 mg/m2及泼尼松60 mg/m2对患儿进行诱导治疗,患儿体温正常,血常规检查结果好转,浅表淋巴结肿大明显缩小。在确诊为BPDCN后,对患儿予以高危ALL方案,行VDLD(长春新碱+柔红霉素+门冬酰胺酶+地塞米松)化疗后,继续以CAM(环磷酰胺+阿糖胞苷+6-巯基嘌呤)化疗[6, 9],参考高危ALL方案对患儿行VDLD-CAM化疗。目前随访3个月,瘀斑消退,肿大淋巴结缩小。复查骨髓细胞形态学示:未见明显异常细胞。流式免疫分析提示原始前体区占1.5%,表达CD33、CD34、CD123、CD117,较前明显缓解。现正在贯序治疗随访中。
6 讨论BPDCN曾被命名为母细胞性NK细胞淋巴瘤,CD4(+)/CD56(+)血液皮肤肿瘤。大多数患者为老年人,但也可发生于50岁以下的年轻人,甚至可见于儿童[11]。其病情进展迅速,通常以皮肤损害症状为主,并可在短时间内侵犯肝脾、骨髓、外周血等多处组织和器官,不伴皮肤损害的患者亦有报道[12]。免疫表型方面,可特征性地共表达CD4、CD56以及浆细胞样树突状细胞(plasmacytoid dendritic cells,PDCs)相关免疫学标志(CD123、CD303、TCL1),而不表达T、B细胞和NK细胞相关抗原[13]。据报道,CD303的表达和高比例的Ki-67与患者的长期生存率密切相关[14]。自1994年被发现,并将其命名为CD4(+)/CD56(+)皮肤血液肿瘤后,国内外陆续有少量报道[15]。儿童BPDCN十分罕见,Wiesner等[16]研究发现8名无皮肤损伤的患儿的总体存活率为100%,其中有两名患儿于第1个或第2个缓解期接受了异体造血干细胞移植(HSCT),而24名伴皮肤损伤患儿总体存活率为40.5%,骨髓浸润则对总体生存率无影响,且无皮肤浸润表现的发生率于儿童中较高,故可推测儿童预后较成人好。BPDCN患儿通常以淋巴结肿大或无痛性结节起病,病情进展迅速,恶性程度高,可在短时间内浸润皮肤、淋巴结、骨髓等处[17]。BPDCN皮肤侵犯表现为非亲表皮浸润,肿瘤细胞通常分布于真皮下,表皮与真皮之间无异常细胞的分布[13]。本例患儿以无痛性结节起病,两个月后即出现淋巴结肿大,随后于眼结膜、眼眶周围、腹股沟等多处出现皮肤瘀斑、多发性淋巴结肿大以及肝脾肿大,并伴高热及骨髓转移。全血细胞在短时间内急剧下降,显微镜下可见真皮及皮下大量深染小圆细胞弥漫浸润,病情进展十分迅速,与上述症状相符。
BPDCN诊断和鉴别诊断主要依赖于组织病理切片和免疫组化检查。特别是对于本例伴骨髓侵犯的患儿而言,同时表达CD4、CD56、CD123是确诊BPDCN的重要标志[18, 19, 20],且通常不表达T、B细胞相关抗原如CD3、CD79a、CD2、CD5、CD20、MPO。Danielle等[21]通过对23名髓细胞性皮肤白血病和12名BPDCN患者的免疫组化结果对比分析发现,所有BPDCN患者的MPO均阴性,髓细胞性皮肤白血病MPO阳性率为30%;CD4、CD56在BPDCN中的阳性率均达100%,而在髓细胞性皮肤白血病中则分别为25%和9%;至于CD123,在BPDCN中为83%,髓细胞性白血病中则为17%。因此这就为BPDCN与其他类型白血病的鉴别诊断提供了良好的依据。S100在儿童中表达率为75%,而在成人中仅25%,亦可作为儿童BPDCN诊断和判断预后的标志[9]。在此病例中,患儿强表达CD56、CD4、CD123,TdT(-)、MPO(-),且Ki57达40%,提示细胞增殖活跃,考虑恶性肿瘤可能性较大,并具有BPDCN特征性免疫表型,但并未表达S100。经我科与中山大学肿瘤防治中心病理科会诊,最终确诊为BPDCN。
BPDCN呈高度恶性,侵袭性较强,进展快,中位生存期仅12~24个月,尚无长期缓解或治愈的报道[3, 16]。正是由于这个特点,所以早期诊断在BPDCN的治疗中显得尤为关键。此病例中,在治疗初期,曾考虑可能为AML M5型。因AML在发病时皮肤亦可出现弥散性斑丘疹、硬性结节、肿块,也可有淋巴结肿大等,与BPDCN的皮肤表现相似,且骨髓肿瘤细胞形态学上与幼稚淋巴细胞相似,故较易误诊,后对其活检病理切片多方会诊后才得以明确诊断。
BPDCN在化疗初期症状可有明显缓解,但极易复发,且预后极差。其在人群中发病率较低,由于儿童发病甚为罕见,故临床尚无统一的治疗方案。目前采取的治疗主要包括AML样化疗方案,高危ALL样化疗方案和骨髓移植等。通过Jegalain等[9]对29名BPDCN患儿研究的数据发现,其中15名接受高危ALL化疗方案的患儿平均生存时间为4年,而3名接受AML样化疗方案的患儿,有1名死亡,另外2名的生存时间分别为37个月和27个月。故现主要以高危ALL样化疗为一线治疗方案。但也有个别病例记载仅对BPDCN患儿行AML样化疗亦取得了理想的疗效[22, 23]。虽然患儿对化疗十分敏感,可使病情在短时间内得到较大的缓解,但却极易复发且预后极差。特别是对于年幼患者来说,在高剂量的化疗药物治疗后行骨髓移植是获得长期缓解的主要方法。Pagano等[24]提出对于年轻的患者在给予高剂量的化疗药物之后行骨髓移植的效果较年长者好。至于具体的移植方案,Jegalain等[9]认为骨髓移植适合已达第2个缓解期或化疗无效者。而有学者在参考Dalle等[25]对47名BPDCN患者的研究后,发现在9名接受了HSCT治疗的患者中,有5名处于第1个缓解期,其中3名患者达到了长期无病生存。而其余4名患者中有2名达到长期无病生存,故认为HSCT适合处于第1个缓解期的患者,而不适合处于第2个缓解期患者[18, 19]。本例患儿伴有皮肤侵犯表现,提示可能预后不良,应考虑行HSCT。本例患儿对早期诱导治疗后反应良好,后对高危ALL方案亦敏感,且已拟行HSCT准备。由于儿童BPDCN发病率较低,且移植的供体不足,现对于BPDCN患儿的骨髓移植仍有待研究。
7 结语儿童BPDCN是一种极为罕见,呈高度侵袭性的疾病。临床绝大多数存在皮肤损害症状,多可进展至浸润骨髓、淋巴结等,现尚无公认的明确治疗方案。本例患儿治疗上采取高危ALL化疗方案,且疗效较好。初始多药联合化疗有效,却极易复发和并发耐药,导致预后极差。虽然患儿的预后与肿瘤的分化程度、基因及染色体、临床表现、年龄、性别等有关,但改善患儿预后的方法主要还是早期的明确诊断。确诊主要依赖于组织病理切片和免疫组化检查,CD4(+)、CD56(+)、CD123(+)为诊断的重要标志。该病例的诊断过程提示在骨髓的免疫标记不能用常见的B系/T系及髓系白血病或瘤性白血病解释时需考虑少见的瘤性白血病可能,并结合病人的临床特点分析,以避免误诊。
| [1] | Au WY, Weisenburger DD, Intragumtornchai T, et al. Clinical differences between nasal and extranasal natural killer/T-cell lymphoma: a study of 136 cases from the International Peripheral T-Cell Lymphoma Project[J]. Blood, 2009, 113(17): 3931-3937. |
| [2] | 苏改秀, 吴凤岐, 邹继珍, 等.儿童鼻型NK/T细胞淋巴瘤1例并文献复习[J]. 中国循证儿科杂志, 2010, 5(2): 141-145. |
| [3] | Yu G, Wang W, Han Y, et al. Blastic plasmacytoid dendritic cell neoplasm presenting with a cutaneous tumor alone as the first symptom of onset: a case report and review of literature[J].Oncol Lett, 2015, 9(2): 819-821. |
| [4] | Pongpruttipan T, Kummalue T, Bedavanjia A, et al. Aberrant antigenic expression in extranodal NK/T-cell lymphoma: a multi-parameter study from Thailand[J]. Diagn Pathol, 2011, 6: 79. |
| [5] | Olsen E, Vonderheid E, Pimpinelli N, et al. Revisions to the staging and classification of mycosis fungoides and Sezary syndrome: a proposal of the International Society for Cutaneous Lymphomas (ISCL) and the cutaneous lymphoma task force of the European Organization of Research and Treatment of Cancer (EORTC)[J]. Blood, 2007, 110(6): 1713-1722. |
| [6] | Cota C, Vale E, Viana I, et al. Cutaneous manifestations of blasticplasmacytoid dendritic cell neoplasm-morphologic and phenotypic variability in a series of 33 patients[J]. Am J Surg Pathol, 2010, 34(1): 75-87. |
| [7] | Lokare A, Nikolousis E, Phillips N, et al. Reduced intensity allogeneicstem cell transplant for treatment of blastic plasmacytoid dendritic cell neoplasm[J]. Hematol Rep, 2014, 6(1): 5119. |
| [8] | Sakashita K, Saito S, Yanagisawa R, et al. Usefulness of allogeneic hematopoietic stem cell transplantation in first complete remission for pediatric blastic plasmacytoid dendritic cell neoplasm with skin involvement: a case report and review of literature[J]. Pediater Blood Cancer, 2013, 60(11): 140-142. |
| [9] | Jegalian AG, Buxbaum NP, Facchetti F, et al. Blastic plasmacytoid dendritic cell neoplasm in children: diagnostic features and clinical implications[J]. Haematologica, 2010, 95(11): 1873-1879. |
| [10] | Julia F, Petrella T, Barry MB, et al. Blastic plasmacytoid dendritic cell neoplasm:clinical features in 90 patients[J]. Br J Dermatol, 2013, 169(3): 579-586. |
| [11] | Unteregger M, Valentin A, Cerwenka-Zinke W, et al. Unrelated SCT induces long-term remission in patients with blastic plasmacytoid dendritic cell neoplasm[J]. Bone Marrow Transplant, 2013, 48(6): 799-802. |
| [12] | Wang H1, Cao J, Hong X, et al. Blastic plasmacytoid dendritic cell neoplasm without cutaneous lesion at presentation: case report and literature review[J]. Acta Haematol, 2010, 127(2): 124-127. |
| [13] | Swerdlow SH, Campo E, Harris NL, et al. WHO classification of tumours of heamatopioetics and lymphoid tissues[M]. France: IARC Press, 2008: 145-147. |
| [14] | Julia F, Dalle S, Duru G, et al. Blastic plasmtoid dendritic cell neoplasms clinico-immunoistochemical correlations in a series of 91 patients[J]. Am J Surg Pathol, 2014, 38(5): 673-680. |
| [15] | Adachi M, Maeda K, Takekawa M, et al. High expression of CD56 (N-CAM) in a patient with cutaneous CD4-positive lymphoma[J]. Am J Hematol, 1994, 47(4): 278-282. |
| [16] | Wiesner T, Obenauf AC, Cota C, et al. Alterations of the cell-cycle inhibitors p27(KIP1) and p16(INK4a) are frequent in blastic plasmacytoid dendritic cell neoplasms[J]. Invest Dermatol, 2010, 130(4): 1152-1157. |
| [17] | Atalay F, Demircl GT, Bayrangurler D, et al. Blastic plasmacytoid dendritic cell neoplasm: skin and bone marrow infiltration of three cases and the review of the literature[J].Indian Hematol Blood, 2015, 31(2): 302-306. |
| [18] | Hwang K, Park CJ, Jang S, et al. Immunohistochemical analysis of CD123, CD56, and CD4 for the diagnosis of minimal bone marrow involvement by blasticplasmacytoid dendritic cellneoplasm[J]. Histopathology, 2013, 62(5): 764-770. |
| [19] | Dharmani PA, Mittal NM, Subramanian PG, et al. Blastic plasmacytoid dendritic cell meoplasm:Report of two pediatric cases[J]. Indian J Pathol Microbiol, 2015, 58(1): 72-76. |
| [20] | Clovic N, Vidovic A, Tomin D, et al. Acute myelomonocytic leukemia presenting as CD4+/CD56+ blastic plasmacytoid dendritic cell neoplasm[J]. Med Pract Rev, 2013, 4(2): 9-13. |
| [21] | Danielle MP, Kaaren K, Tracy I, et al. Immunophenotypic analysis of myeloperoxidase-negative leukemia cutis and blastic plasmacytoid dendritic cell neoplasm[J]. Am J Clin Pathol, 2012, 137(3): 367-376. |
| [22] | Hansford JR, Kotecha RS, Jevon G, et al. Efficacy of acute myeloid leukemia therapy without stem-cell transplantationin a child with blastic plasma cytoid dendritic cell neoplasm[J].Haematologica, 2013, 98(3): e30. |
| [23] | Boers JE, KluinPM, VerdonckLF, et al. Allogeneic stem-cell transplantation for blastic plasmacytoid dendritic cell neoplasm[J]. J Clin Oncol, 2012, 30(8): 102-103. |
| [24] | Pagano L, Valentini CG, PlusoniA, et al. Blastic plasmacytoid dendritic cell neoplasm with leukemic presentation: anltalian multicenter study[J]. Haematologica, 2013, 98(2): 239-245. |
| [25] | Dalle S, Beylot-Barry M, Bagot M, et al. Blastic plasmacytoid dendritic cell neoplasm: is transplantation the treatment of choice[J]. Br J Dermatol, 2010, 162(1): 74-79. |
 2015, Vol. 17
2015, Vol. 17


