动脉导管是胎儿时期降主动脉和肺动脉之间的正常通道,随着出生后胎盘的剥离及呼吸的建立,动脉导管迅速发生闭合。正常足月儿生后导管即迅速发生收缩,导致导管内膜缺氧、重建及永久闭合,此过程一般在72 h内完成。早产儿因为生后氧诱导动脉导管收缩机制不成熟且对血管活性物质的反应敏感性下降,因此早产儿PDA发生率较高,体重 < 1 750 g者为45%,体重 < 1 500 g者为30%,体重 < 1 000 g者为80%,尤其是生后早期[1]。如果出生后导管持续开放>72 h,则称为动脉导管未闭(patent ductus arteriosus,PDA)。绝大多数胎龄 < 29周的早产儿生后4 d导管才收缩[2],导管水平持续分流导致血流动力学异常的PDA(hemodynamic significant PDA,hsPDA),可诱发或促进支气管肺发育不良(bronchopulmonary dysplasia,BPD)或慢性肺疾病(chronic lung disease,CLD)、充血性心力衰竭、颅内出血(intracranial hemorrhage,ICH)、坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)、早产儿视网膜病(retiopathy of prematurity)等相关并发症的发生,最后导致体循环低灌注、心肺功能衰竭危及生命,是影响早产儿存活和并发症发生的常见原因之一。目前早产儿PDA的治疗主要是针对症状性PDA,通常釆用药物治疗,以达到降低hsPDA手术结扎率的目的。对药物治疗无效,适当抗心衰治疗后仍需依赖呼吸机者,外科手术是其主要治疗手段。有研究指出对有症状的PDA进行手术结扎有以下好处:缩短呼吸机通气治疗时间、改善血流动力学及改善肺顺应性。然而,考虑到手术的相关风险,药物治疗仍是治疗PDA的首选方式。最近较多观察性研究的数据证实导管关闭失败与早产儿死亡率升高有关。大多数随机对照试验将重点放在早期治疗的时机上[3, 4],这些研究及Meta分析可能会被误解为PDA治疗无任何益处,然而,即使是支持不干预PDA的人们也知道,对一些极低出生体重儿不能从导管关闭治疗中获益的假设是不正确的[5]。在缺乏明确数据的情况下,导管治疗的潜在副作用需要与导管最终可能发生的自然闭合进行权衡来决定治疗与否。因此,任何治疗方案需考虑到每个患儿情况以达到获益最大、治疗方案最优化、疗效最佳、副作用最少的目的。目前对PDA是否进行药物治疗或手术干预,以及何时进行药物和手术干预仍存在争议,但近年来在PDA治疗上最大的变化是减少对PDA的治疗[6, 7, 8, 9]。考虑到胎龄≥28周的患儿导管自然关闭率较高,因此需给予治疗的重点对象是胎龄 < 28周的患儿,因为这些患儿存在发生hsPDA的高危因素。本文重点总结胎龄 < 28周早产儿PDA的治疗策略。
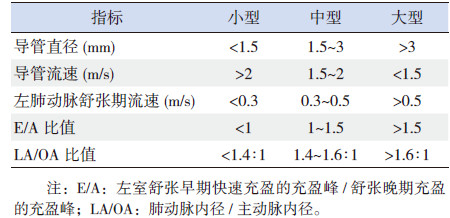
1 PDA的评估 1.1 心脏彩超PDA早期症状不明显,随着肺动脉压力的下降不断发生变化,因此生后3 d内单靠临床症状诊断PDA是不可靠的。目前超声心动图检查对诊断PDA最为敏感和准确。早期导管多普勒超声预测胎龄 < 29周症状性PDA患儿的标准为:在生后第1天(7~31 h)心脏超声检查示导管直径≥1.5 mm(敏感度83%,特异度90%)[10]。PDA的系统心脏超声评估包括能证实肺循环超负荷的分流大小、体循环低血压及导管特点(如直径及流速)。Sehgal 等[11]将PDA分为小型、中型、大型3种类型(表 1),对进行临床决策有重要的指导意义。
| 表 1 PDA分型 |
近年来对N-脑钠肽前体(NT-proBNP)的研究较多,显示生后6~24 h时NT-proBNP的浓度与心脏超声导管分流类型有很好的一致性,能有效地将存在hsPDA风险的PDA患儿区分出来,可作为早产儿PDA早期靶向治疗的预测工具[12, 13, 14, 15]。
2 早产儿PDA治疗指征及策略 2.1 干预指征目前早产儿PDA的治疗主要是针对症状性PDA及其预防,尤其是存在血流动力学不稳定的PDA(hsPDA),其定义为:生后48~96 h内,符合以下任意1项条件:导管直径 >1.5 mm,左心房内径/主动脉内径>1.5,舒张末期主动脉反流,或不仅有PDA的临床症状并且合并心功能不全表现[16, 17]。研究显示,hsPDA是影响早产儿预后的常见原因[18],因此早期对PDA/hsPDA进行干预,可减少新生儿需要辅助呼吸的时间,降低相关并发症的发生率。
2.2 治疗策略目前国际上对于早产儿PDA是否治疗及什么时候开始治疗仍存在争议,治疗策略也从积极治疗到相对保守治疗发生转变。目前公认的关闭导管治疗有:限液疗法、呼吸支持治疗、药物治疗(吲哚美辛及布洛芬)、手术结扎PDA及经导管介入治疗。近年来,人们开始对口服对乙酰氨基酚及布洛芬的疗效进行研究。支持疗法仅在可耐受的PDA患儿中应用,等待动脉导管自然闭合[6, 19]。
3 药物治疗药物治疗的策略包括预防治疗、无症状的治疗、早期症状的治疗(2~5 d)、晚期症状的治疗(10~14 d)及支持治疗和(或)晚期补救治疗。预防性治疗PDA方面,静脉吲哚美辛及布洛芬效果等同,但是只有吲哚美辛能降低脑室内出血的风险[20, 21]。近年来有研究指出布洛芬在关闭PDA方面与吲哚美辛同等有效,并能降低NEC、暂时性肾功能不全的发生率,但是这可能与胎龄、药物剂量及给药途径有关[21, 22]。患儿对药物的反应存在生物学差异,一些患儿可能需延长药物疗程,但是可以通过心脏超声对药物治疗的个体化疗效进行评估,以达到药物疗程最短化的目的[23, 24]。
3.1 吲哚美辛吲哚美辛是前列腺素合酶成抑制剂,20世纪70年代末起就用来治疗PDA,目前用于早期、晚期症状性治疗及预防治疗,首选注射剂型。首剂0.2 mg/kg,吲哚美辛注射时间需>30 min;随后每12~24 h予第2和第3剂,体重≤1 250 g者剂量为0.1 mg/kg,体重>1 250 g或日龄>7 d者剂量为0.2 mg/kg[25, 26]。生后24~48 h内给首剂者效果最佳,一般在用药后36 h内导管关闭,重新开放率较低。在一项关于超低出生体重儿的研究中(n=1 202),对这些患儿随访至18月龄后发现吲哚美辛的预防性应用尽管能减少PDA复发率及严重脑室旁及脑室内出血的发生率,但并不能改善不合并神经系统发育障碍患儿的生存率[27]。在一项Cochrane综述中,预防性应用吲哚美辛有许多短期优势,特别是显著减少症状性PDA的发生,减少手术需求率及减少严重脑室内出血的发生,但未发现吲哚美辛对包括神经系统发育在内的远期预后有好或坏的影响[22]。随着进一步的研究,发现吲哚美辛有效的血药浓度较窄,不良反应可能会较多,如一过性或永久性肾功能损害、NEC、胃肠道出血或穿孔、血小板功能改变及脑血流减少/脑血流流速降低等[19]。由于吲哚美辛对肠系膜上动脉血流速度有影响,吲哚美辛会减少肠道血流,抑制正常餐后充血反应,影响胃肠黏膜屏障功能[28]。因此,有人担心当应用这些药物时,如果继续肠内营养(可促进肠道细菌定植及增加肠道氧需求)可能对患儿造成危害。目前很少有文献深入研究在治疗PDA的过程中继续喂养是否安全。Clyman等[29]开展的一项随机对照试验的研究对象为胎龄23+1~30+6周、出生体重401~1 250 g、最大肠内营养量每日≤60 mL/kg,并且将接受吲哚美辛或布洛芬治疗的177名患儿,将这些患儿随机分为2组:肠内营养组及禁食组,通过两组比较得出结论:尽管肠内营养组较早达到终点值,但是两组在拔除中心静脉置管时间方面无明显差异;两组的感染率、NEC、自发肠穿孔或其他新生儿并发症发生率无明显差异。该研究提示如果在应用吲哚美辛及布洛芬治疗PDA时给予肠内营养,患儿可在更短的时间内达到肠内全量喂养。近年来研究发现布洛芬可能与吲哚美辛等效且不影响脑、肠系膜及肾脏的血流[23]。
3.2 布洛芬布洛芬是另一种环氧酶抑制剂,有口服及静脉制剂,推荐剂量为首剂10 mg/kg,24 h及48 h后分别应用第2、第3剂(5 mg/kg)。根据口服布洛芬相关研究[30, 31, 32, 33],尽管布洛芬对肠道血流不存在上述吲哚美辛的影响,但是口服布洛芬制剂渗透压高,需用水或奶以2 mL/kg进行稀释后再应用。适合各胎龄患儿的药物最佳治疗剂量目前仍在讨论中,有研究指出在治疗胎龄小的患儿中,较大剂量的布洛芬动脉导管关闭率更高,且无明显不良反应发生[34, 35]。由于布洛芬对血清总胆红素及间接胆红素水平有影响,大剂量应用布洛芬的安全性令人担忧。口服布洛芬可能会有益处,可能是由于该药物在胎龄及出生体重较小的患儿中半衰期也较长的缘故[16, 34]。对一些临床随机对照研究进行总结的一篇Meta分析中,对口服布洛芬及吲哚美辛比较,发现口服布洛芬治疗组NEC发生率较低[5]。但另有研究发现,自发性肠道穿孔与吲哚美辛及布洛芬均有关系,尤其是当生后1周内给药或合并低血压或同时应用糖皮质激素时更易发生[36]。
3.3 预防性用药近年来,预防治疗被广泛研究[37],主要是比较生后第1天即开始治疗与生后数天后直至患儿出现症状时再治疗两者的疗效情况。吲哚美辛预防性治疗胎龄较小的PDA患儿显著提高疗效,并降低症状性PDA发生、降低手术结扎率、降低脑室内出血、脑室周围白质软化及肺出血等并发症的发生率[23],并且无严重不良反应发生。这种方法尽管能降低脑室内出血的发生率,但是这并不能降低晚期并发症、死亡或神经系统发育障碍的发生率。考虑到为了避免使不需应用药物治疗的30%~40%患儿应用该药,预防性治疗不推荐。然而对于存在患有脑室内出血、肺出血或PDA结扎高危因素的患儿,尤其是无法行心脏超声检查的患儿,预防性治疗则应该另当别论。
3.4 对乙酰氨基酚对乙酰氨基酚虽然没有被广泛的研究,但是似乎与环氧酶抑制剂有同样的疗效并且不良反应较少[38, 39]。Oncel等[40]在一篇最新的随机对照试验中,选取胎龄≤30周,出生体重≤1 250 g,生后48~96 h内,心脏超声证实存在显著血流动力学的PDA,共90名早产儿纳入研究,随机分为2组:一组予口服对乙酰氨基酚(15 mg/kg每6 h服用一次,共用3 d),另一组则口服布洛芬(首剂10 mg/kg,24 h及48 h为5 mg/kg),第1个治疗周期结束后,对乙酰氨基酚与布洛芬关闭率相似(72.5% vs 77.5%)。虽然两组关闭率基本一致,但是可信区间的范围较大,因此尚不能得出两种药物同等有效的结论。对乙酰氨基酚关闭动脉导管的机制可能是通过抑制定位在环氧化酶上的POX位点介导的。我们需要更进一步的研究来确定对乙酰氨基酚的最佳剂量范围,虽然该药物作为PDA关闭治疗尚未得到批准,但是该药是一种很有前景的治疗药物,应当纳入以后的临床研究中。
4 手术治疗手术治疗只有当药物治疗失败或药物禁忌时才考虑,指征为:两个疗程药物治疗失败(布洛芬或吲哚美辛);使用血管活性药物的情况下平均动脉血压低于胎龄(周)、血流动力学不稳定、心衰症状(左心扩大、无尿/少尿、肺血增多、水肿、心脏收缩期持续机械样杂音);超声心动图检查提示左房-主动脉根部比值>1.5,左肺动脉平均流速>0.6 m/s,动脉导管直径>3 mm,有左向右分流。但是何时进行手术治疗仍存在争议。Fonseca等[41]一项回顾性调查中,对41名平均胎龄26周(23~31周)、平均出生体重为930 g(510~1 500 g)并行手术结扎的患儿进行研究,按手术日龄分成两组:早期手术结扎组(手术时日龄≤21 d)及晚期手术组(手术时日龄>21 d),这两组基线水平无差异(胎龄、出生体重),但日龄>21 d后手术的患儿接受了更多的药物治疗疗程。早期手术结扎治疗组插管时间短(平均23 d vs 43 d,P < 0.001);NICU住院时间缩短(平均44 d vs 76 d,P < 0.001);BPD、脑室内出血、急性肾衰竭发生率低;神经系统预后较好。然而尚需前瞻性随机对照研究来确定早期治疗PDA的最佳方案。Jhaveri 等[42]最近的一项临床试验中,研究对象为胎龄 < 28周的早产儿,并且遵循严格手术指征(拔管失败或持续依赖强心药物),通过比较早期手术结扎及适度延后的手术结扎,认为适度延后几天进行手术结扎(平均治疗日龄为23 d)或等呼吸系统症状及hsPDA症状变得更明显时进行结扎可明显降低手术结扎率(72% vs 100%,P < 0.05)及NEC的发生率。目前手术治疗方式包括开胸、胸腔镜手术结扎或夹闭。对于左心室已经超负荷的患儿,手术结扎一般耐受良好并能帮助这些患儿尽早拔管,改善肺顺应性,但是会引起暂时性的左心室功能障碍。Weisz等[43]的一项Meta分析指出:与药物治疗相比,PDA结扎术可降低早期死亡风险,但会增加神经系统并发症、慢性肺疾病及严重早产儿视网膜病的发生率。Kozlov 等[44]比较胸腔镜下及开胸PDA结扎两种术式在治疗低出生体重儿中的疗效,结果发现胸腔镜效果更佳,住院时间短,术后并发症更少,因此胸腔镜下PDA结扎术更值得推荐。
5 介入治疗介入关闭持续PDA目前被认为可作为一种较安全的选择[45],但在小婴儿中相关并发症并不少见,这些并发症有肢体动脉缺血及装置位置放错。尽管介入治疗对体重2 kg左右的患儿是可行的,但大多数介入治疗一般会延迟,等患儿年龄稍大点时再进行。
6 结语总之,生后数周内对胎龄 < 28周的PDA患儿进行导管关闭可能有短暂的益处,但目前尚没有研究评估其导管大小或未予治疗对其远期的影响。目前PDA治疗上最大的变化是减少对PDA的治疗,但是也尚无确凿证据支持这些观点,仍需大量临床试验比较现有的治疗策略与更加保守的治疗对PDA患儿的近期及远期影响,真正达到疗效最优化、不良反应最小化的目的。
| [1] | Ohlsson A, Shah SS. Ibuprofen for the prevention of patent ductus arteriosus in preterm and/or low birth weight infants[J]. Cochrane Database Syst Rev, 2011, 25(7): 42-53. |
| [2] | Popat H, Kapoor V, Travadi J. Patent ductus arteriosus in infants <29 weeks gestation-outcomes and factors affecting closure[J]. Indian Pediatr, 2012, 49(8): 615-620. |
| [3] | Fowlie PW, Davis PG, McGuire W. Prophylactic intravenous indomethacin for preventing mortality and morbidity in preterm infants[J]. Cochrane Database Syst Rev, 2010, 24(7): 1-174. |
| [4] | Sosenko IR, Fajardo MF, Claure N, et al. Timing of patent ductus arteriosus treatment and respiratory outcome in premature infants: a double-blind randomized controlled trial[J]. J Pediatr, 2012, 160(6): 929-935. |
| [5] | Noori S. Patent ductus arteriosus in the preterm infant: to treat or not to treat?[J]. J Perinatol, 2010, 30(2): 31-37. |
| [6] | Evans N. Preterm patent ductus arteriosus: should we treat it?[J]. J Paediatr Child Health, 2012, 48(9): 753-758. |
| [7] | Clyman RI, Couto J, Murphy GM. Patent ductus arteriosus: are current neonatal treatment options better or worse than no treatment at all?[J]. Semin Perinatol, 2012, 36(2): 123-129. |
| [8] | Ibrahim TK, Haium AA, Chandran S, et al. Current controversies in the management of patent ductus arteriosus in preterm infants[J]. Indian Pediatr, 2014, 51(4): 289-294. |
| [9] | Hammerman C, Bin-Nun A, Kaplan M. Managing the patent ductus arteriosus in the premature neonate: a new look at what we thought we knew[J]. Semin Perinatol, 2012, 36(2): 130-138. |
| [10] | Thankavel PP, Rosenfeld CR, Christie L, et al. Early echocardiographic prediction of ductal closure in neonates ≤ 30 weeks gestation[J]. J Perinatol, 2013, 33(1): 45-51. |
| [11] | Sehgal A, McNamara PJ. Does echocardiography facilitate determination of hemodynamic significance attributable to the ductus arteriosus?[J]. Eur J Pediatr, 2009, 168(8): 907-914. |
| [12] | Grass B, Baumann P, Arlettaz R, et al. Cardiovascular biomarkers pro-atrial natriuretic peptide and pro-endothelin-1 to monitor ductus arteriosus evolution in very preterm infants[J]. Early Hum Dev, 2014, 90(6): 293-298. |
| [13] | Kulkarni M, Gokulakrishnan G, Price J, et al. Diagnosing significant PDA using natriuretic peptides in preterm neonates: a systematic review[J]. Pediatrics, 2015, 135(2): 510-525. |
| [14] | Occhipinti F, De Carolis MP, De Rosa G, et al. Correlation analysis between echocardiographic flow pattern and N-terminal-pro-brain natriuretic peptide for early targeted treatment of patent ductus arteriosus[J]. J Matern Fetal Neonatal Med, 2014, 27(17): 1800-1804. |
| [15] | Czernik C, Metze B, Muller C, et al. Urinary NT-proBNP and ductal closure in preterm infants[J]. J Perinatol, 2013, 33(3): 212-217. |
| [16] | Erdeve O, Yurttutan S, Altug N, et al. Oral versus intravenous ibuprofen for patent ductus arteriosus closure: a randomised controlled trial in extremely low birthweight infants[J]. Arch Dis Child Fetal Neonatal Ed, 2012, 97(4): 279-283. |
| [17] | Gokmen T, Erdeve O, Altug N, et al. Efficacy and safety of oral versus intravenous ibuprofen in very low birth weight preterm infants with patent ductus arteriosus[J]. J Pediatr, 2011, 158(4): 549-554. |
| [18] | McNamara PJ. Towards rational management of the patent ductus arteriosus: the need for disease staging[J]. Arch Dis Child Fetal Neonatal Ed, 2007, 92(2): 424-427. |
| [19] | WE B. Patent ductus arteriosus: to treat or not to treat?[J]. Arch Dis Child Fetal Neonatal Ed, 2012, 97(2): 80-82. |
| [20] | Jones LJ, Craven PD, Attia J, et al. Network meta-analysis of indomethacin versus ibuprofen versus placebo for PDA in preterm infants[J]. Arch Dis Child Fetal Neonatal Ed, 2011, 96(1): 45-52. |
| [21] | Yadav S, Agarwal S, Maria A, et al. Comparison of oral ibuprofen with oral indomethacin for PDA closure in indian preterm neonates: a randomized controlled trial[J]. Pediatr Cardiol, 2014, 35(5): 824-830. |
| [22] | Ohlsson A, Walia R, Shah SS. Ibuprofen for the treatment of patent ductus arteriosus in preterm and/or low birth weight infants[J]. Cochrane Database Syst Rev, 2013, 27(4): 1-153. |
| [23] | Kluckow M, Jeffery M, Gill A, et al. A randomised placebo-controlled trial of early treatment of the patent ductus arteriosus[J]. Arch Dis Child Fetal Neonatal Ed, 2014, 99(2): F99-F104. |
| [24] | Carmo KB, Evans N, Paradisis M. Duration of indomethacin treatment of the preterm patent ductus arteriosus as directed by echocardiography[J]. J Pediatr, 2009, 155(6): 819-822. |
| [25] | Rosito G, Sum K, Chorne N. Comparison of two neonatal indomethacin protocols: efficacy and outcome for patent ductus arteriosus closure[J]. J Clin Pharm Ther, 2010, 35(5): 589-592. |
| [26] | Irmesi R, Marcialis MA, Van Den Anker J, et al. Non-steroidal anti-inflammatory drugs (NSAIDs) in the management of patent ductus arteriosus (PDA) in preterm infants and variations in attitude in clinical practice: a flight around the world[J]. Curr Med Chem, 2014, 21(27): 3132-3152. |
| [27] | Yoshimoto SS. Prohylactic indomethacin in extremely premature infants between 23 and 24 weeks gestation[J]. Pediatr Int, 2010, 52(2): 374-377. |
| [28] | Yanowitz TD, Reese J, Gillam-Krakauer M, et al. Superior mesenteric artery blood flow velocities following medical treatment of a patent ductus arteriosus[J]. J Pediatr, 2014, 164(3): 661-663. |
| [29] | Clyman R, Wickremasinghe A, Jhaveri N, et al. Enteral feeding during indomethacin and ibuprofen treatment of a patent ductus arteriosus[J]. J Pediatr, 2013, 163(2): 406-411. |
| [30] | Chan NM, Law CW, Kwan KF. Ibuprofen versus indomethacin treatment of patent ductus arteriosus: comparative effectiveness and complications[J]. Hong Kong Med J, 2014, 20(3): 205-212. |
| [31] | Kluckow M. Oral Ibuprofen and the patent ductus arteriosus: a new approach to an old problem[J]. J Pediatr (Rio J), 2013, 89(1): 4-5. |
| [32] | Neumann R, Schulzke SM, Buhrer C. Oral ibuprofen versus intravenous ibuprofen or intravenous indomethacin for the treatment of patent ductus arteriosus in preterm infants: a systematic review and meta-analysis[J]. Neonatology, 2012, 102(1): 9-15. |
| [33] | Fakhraee SH, Badiee Z, Mojtahedzadeh S, 等. 口服消炎痛和布洛芬治疗早产儿动脉导管未闭的比较[J]. 中国当代儿科杂志, 2007, 9(5): 399-403. |
| [34] | Dani C, Vangi V, Bertini G, et al. High-dose ibuprofen for patent ductus arteriosus in extremely preterm infants: a randomized controlled study[J]. Clin Pharmacol Ther, 2012, 91(4): 590-596. |
| [35] | Sajan SS, Mahajan V. High-dose Ibuprofen therapy for patent ductus arteriosus in extremely preterm neonates: do we have a final answer?[J]. Clin Pharmacol Ther, 2012, 92(5): 557-558. |
| [36] | Attridge JT. New insights into spontaneous intestinal perforation using a national data set: SIP is associated with early indomethacin exposure[J]. J Perinatol, 2006, 26(2): 93-99. |
| [37] | 林新祝, 陈涵强, 郑直, 等. 早期口服布洛芬治疗极低出生体重儿动脉导管未闭的临床研究[J]. 中国当代儿科杂志, 2012, 14(7): 502-505. |
| [38] | Kessel I, Waisman D, Lavie-Nevo K, et al. Paracetamol effectiveness, safety and blood level monitoring during patent ductus arteriosus closure: a case series[J]. J Matern Fetal Neonatal Med, 2014, 27(16): 1719-1721. |
| [39] | Ozdemir OM, Dogan M, Kucuktasci K, et al. Paracetamol therapy for patent ductus arteriosus in premature infants: a chance before surgical ligation[J]. Pediatr Cardiol, 2014, 35(2): 276-279. |
| [40] | Oncel MY, Yurttutan S, Erdeve O, et al. Oral paracetamol versus oral ibuprofen in the management of patent ductus arteriosus in preterm infants: a randomized controlled trial[J]. J Pediatr, 2014, 164(3): 510-514. |
| [41] | Fonseca E, Georgiev SG, Gorenflo M, et al. Patent ductus arteriosus in preterm infants: benefits of early surgical closure[J]. Asian Cardiovasc Thorac Ann, 2014, 22(4): 391-396. |
| [42] | Jhaveri N, Moon-Grady A, Clyman RI. Early surgical ligation versus a conservative approach for management of patent ductus arteriosus that fails to close after indomethacin treatment[J]. J Pediatr, 2010, 157(3): 381-387. |
| [43] | Weisz DE, More K, McNamara PJ, et al. PDA ligation and health outcomes: a meta-analysis[J]. Pediatrics, 2014, 133(4): e1024-e1046. |
| [44] | Kozlov I, Novozhilov VA, Ezhova IV, et al. Thoracotomy and thoracoscopy in the treatment of patent arterial duct in infants weighing less than 2 500 g[J]. Khirurgiia (Mosk), 2014, 95(1): 64-72. |
| [45] | Zahn EM, Nevin P, Simmons C, et al. A novel technique for transcatheter patent ductus arteriosus closure in extremely preterm infants using commercially available technology[J]. Catheter Cardiovasc Interv, 2014, 85(2): 240-248. |
 2015, Vol. 17
2015, Vol. 17