2. 绍兴市妇幼保健院, 浙江 绍兴 312000
儿童孤独症谱系障碍(autism spectrumdisorder,ASD)是一种童年早期起病的神经发育性障碍,主要特点为社会- 情感交互反应、非语言的交流行为和对人际关系的发展、维持和理解的障碍以及固定刻板的行为模式或兴趣。近20 年来ASD 的患病率明显增加,严重影响了儿童的身心健康和人口素质,从而引起社会和研究界的广泛关注和重视。由于ASD 病因的不确定性,目前尚缺乏针对ASD 核心症状的有效药物,主要的治疗措施是康复训练[1]。目前儿童ASD 的具体病因及发病机制仍不清楚[2],可能是易感基因、神经生化、免疫激活、围生期疾病和环境因素共同交互作用的结果。了解儿童ASD 发病的环境危险因素,对于该病的预防和早期的干预具有积极作用。本研究通过分析比较ASD 男童、全面发育迟缓(globaldevelopmental delay,GDD)男童与健康体检男童的一般背景情况、家庭基本情况、父母生活习惯及居住环境、母亲孕期健康情况、儿童出生时情况、生后养育及生活环境等资料,对与儿童ASD 发生发展相关的环境危险因素进行初步探讨,为儿童ASD 的早期预防及病因学研究提供依据。
1 资料与方法 1.1 研究对象研究对象来源于2013 年7 月至2013 年10 月在浙江大学医学院附属儿童医院、绍兴市妇幼保健院就诊的ASD、GDD 儿童和健康体检儿童,年龄为2~5 岁。本研究经浙江大学医学院附属儿童医院医学伦理委员会审核通过,调查前均与儿童监护人签署知情同意书。
ASD 纳入按照DSM-5 标准,由具有多年丰富ASD 儿童临床诊疗经验的儿童发育行为科或心理科副主任医师及以上职称的医师诊断。发育商(DQ)采用Gesell 儿童发育诊断量表评估,适应性行为应用婴儿- 初中生社会生活能力量表评估。GDD参照DSM-5 标准[3]:DQ ≤ 75,伴有适应性行为功能障碍,经过行为观察排除ASD。正常对照儿童为问卷调查中发育史正常,经发育筛查正常的儿童。所有研究对象通过病史、体检或结合实验室检查如串联质谱、染色体核型、片段分析等排除遗传、代谢类疾病,如脆性X 综合征、苯丙酮尿症、21- 三体综合征;心、肝、肾、内分泌、血液系统等严重躯体疾病;神经系统、听力障碍等器质性疾病。
因ASD 男女患病比例为4 : 1[4],而门诊采集到的ASD 儿童男女比例约为10 : 1,所以本研究只对男童资料进行统计分析。
1.2 研究工具入组儿童养育环境调查问卷由研究者自行设计,内容包括儿童的一般人口学资料,如性别、实际年龄、出生日期等;家庭社会经济情况及家族史,如父母亲年龄、职业、文化程度、性格、婚姻状况、家庭可支配年收入、家庭常住人口、家族(精神障碍疾病)史等;父母生活习惯及环境接触史,如父母吸烟饮酒情况、职业接触毒物史等;母亲孕期健康状况,如孕期患病史、孕期异常史、孕期用药史及情绪状况等;儿童出生时情况,如胎龄、产次、出生方式、出生地点、出生体重、并发症等;生后养育情况,如喂养方式、母乳喂养时间、添加辅食时间、生后疾病史等;儿童生活环境,如户外活动频率、与同龄儿童交流机会、亲戚朋友往来频率、主要抚养人及其性格等。
1.3 资料收集儿童入组后,与儿童家长进行访谈,收集详细信息。研究者通过问卷调查培训后,指导入组的儿童家长填写问卷。
1.4 统计学分析采用SPSS 16.0 统计软件进行统计学处理,计量资料用均数± 标准差(x±s)表示,计数资料以例数和百分率表示。多组间计量资料的比较采用单因素方差分析;计数资料的比较采用卡方检验,组间两两比较采用卡方分割法(检验水准α为0.0125)。采用非条件多因素logistic 回归模型分析ASD 发生的环境危险因素。P<0.05 为差异有统计学意义。
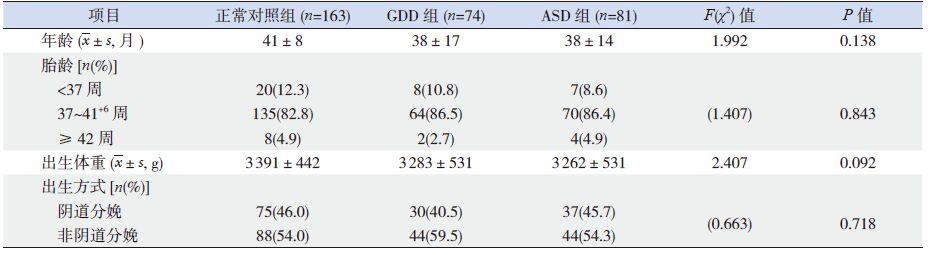
2 结果 2.1 ASD 组、GDD 组和正常对照组基本情况的比较共纳入ASD 男童81 例,GDD 男童74 例,正常对照男童163 例。3 组间儿童年龄、出生胎龄、出生方式及出生体重比较差异无统计学意义(表 1)。
|
|
表 1 ASD 组、GDD 组和正常对照组基本情况的比较 |
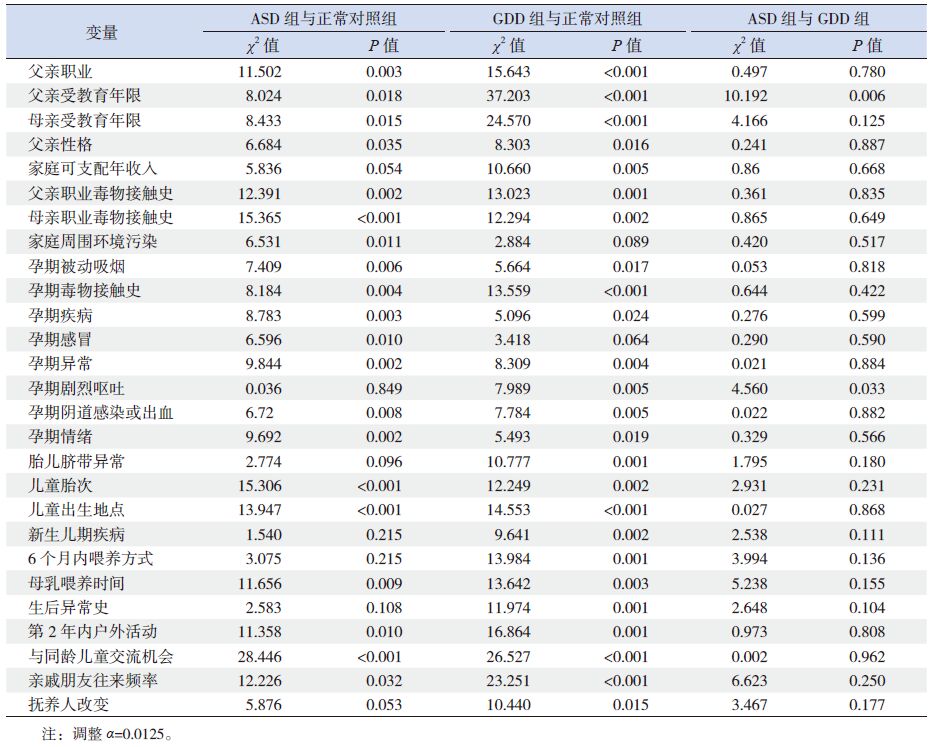
3组全部变量进行组间比较,结果提示父亲职业、父母亲受教育年限、父亲性格、家庭可支配年收入、父母亲职业毒物接触史、家庭周围环境污染、母亲孕期被动吸烟、孕期毒物接触史、孕期疾病和异常史、孕期感冒、孕期剧烈呕吐、阴道感染或出血、孕期情绪、胎儿脐带异常、儿童胎次、儿童出生地点、新生儿期疾病、6 个月内喂养方式、母乳喂养时间、生后异常史、生后第2 年户外活动频率、与同龄儿童交流机会、亲戚朋友往来频率及抚养人改变等变量差异有统计学意义(P<0.05)。
将上述差异有统计学意义的变量进行3 组间两两比较,结果见表 2。
|
|
表 2 3 组间各变量两两比较统计结果 |
与正常对照组比较,ASD 组及GDD 组父亲职业偏向体力劳动、母亲受教育年限低、父母亲职业毒物接触、母亲孕期毒物接触、孕期异常史、孕期阴道感染或出血的几率均较高,儿童出生地点级别低、儿童非第1 胎的几率较高、母乳喂养时间短、与同龄儿童交流机会少及第2 年内户外活动少(P<0.0125)。此外,与正常对照组比较,ASD 组儿童家庭周围环境污染率高、母亲孕期疾病(包括感冒)、孕期被动吸烟及情绪不佳发生率高(P<0.0125)。与GDD 组比较,ASD 组儿童父亲受教育年限较高(P<0.0125)。
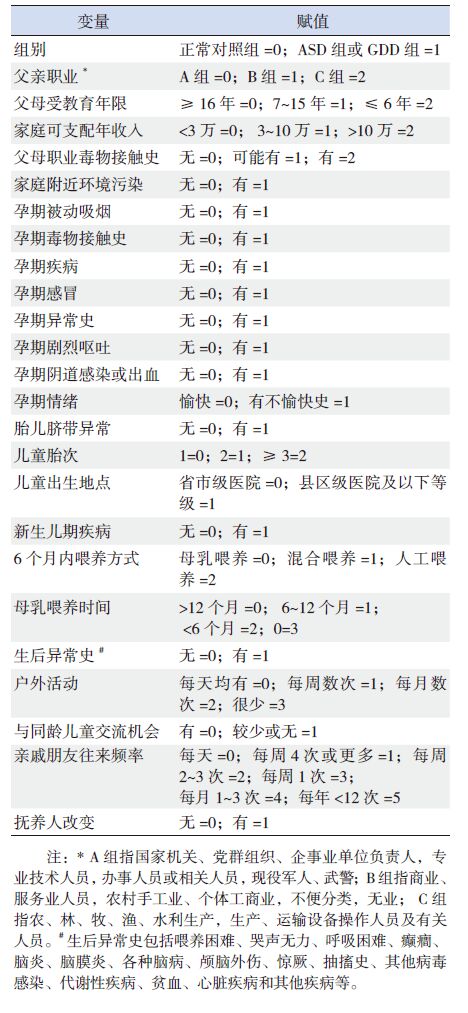
2.3 变量赋值将以上单因素分析显示的各项危险因素进行赋值,见表 3。
|
|
表 3 儿童ASD 相关环境因素各变量赋值 |
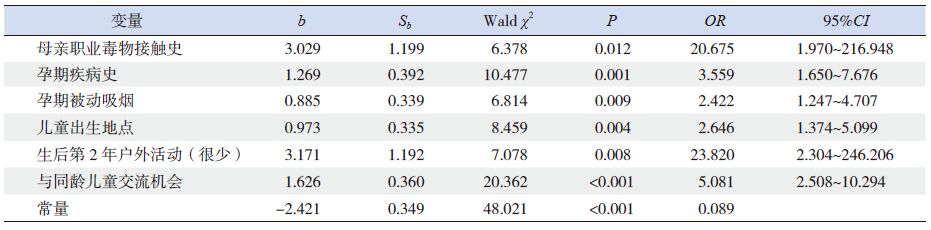
以正常对照组作为参照,多因素logistic 回归分析显示,母亲职业毒物接触、孕期疾病及被动吸烟史、儿童出生地点、出生后第2 年户外活动和与同龄儿童交流机会6 个变量进入回归方程,为ASD 发生的危险因素(表 4)。
|
|
表 4 ASD 组与正常对照组比较危险因素的多因素回归分析 |
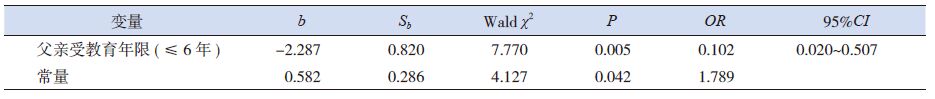
以GDD 组作为参照,多因素logistic 回归分析显示,父亲受教育年限进入回归方程(表 5)。
|
|
表 5 ASD 组与GDD 组比较危险因素的多因素回归分析 |
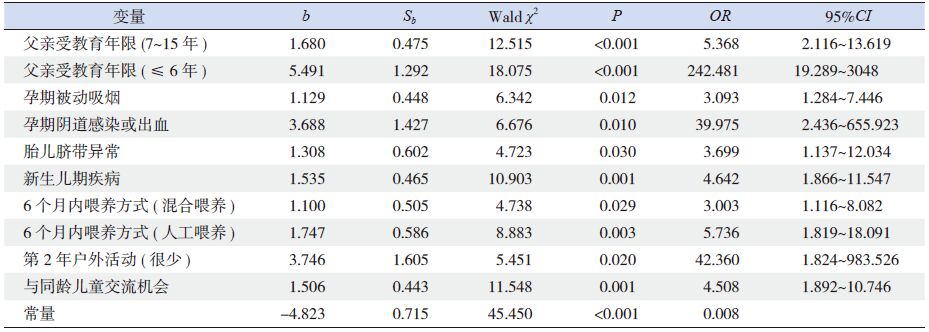
以正常对照组作为参照,多因素logistic 回归分析显示,父亲受教育年限、母亲孕期被动吸烟及阴道感染或出血、胎儿脐带异常、新生儿期疾病、儿童6 个月内喂养方式、第2 年户外活动及与同龄儿童交流机会8 个变量进入回归方程,为GDD发生的危险因素(表 6)。
|
|
表 6 GDD 组与正常对照组比较危险因素的多因素回归分析 |
ASD 被认为是一种由于多种生物因素和(或)心理因素,包括基因、环境及基因和环境交互作用所致的心理病理过程。近期许多的研究强调了基因与环境因素的相互作用在ASD 起源中的重要作用[5, 6, 7, 8],基因赋予个体遗传易感性,当发育期(胎儿期及出生后早期)暴露于各种生物、理化毒物和社会环境等不利因素,易发生变异而患病。本研究通过对ASD 儿童、GDD 儿童和健康体检(正常对照)儿童的回顾性调查,发现与正常对照儿童比较,ASD 儿童在孕期、围产期、出生后养育环境中有较多的不良环境因素暴露,除母亲职业毒物接触、孕期疾病史及儿童出生地点与ASD 独立关联外,孕期被动吸烟、与同龄儿童交流机会及第2 年内户外活动少也同时是GDD 的危险因素。提示生物及社会环境因素如母亲职业毒物暴露、孕期疾病史、孕期被动吸烟史、儿童出生地点、生后第2 年内户外活动频率低、与同龄儿童的交流机会少均可能与儿童ASD 发生发展有关,而母亲的职业毒物暴露、孕期疾病史及儿童出生地点级别低可能是与ASD 特异关联的危险因素。
研究发现,孕期暴露于化学毒物可影响胎儿的脑发育。脂溶性化学毒物作为内分泌干扰物可经过胎盘或乳汁进入儿童体内[9],孕期胎儿脂溶性毒物暴露可使儿童智力和运动发育减慢,增加儿童学龄前内向性行为[10]。胎儿4~5 周时,脑中尼古丁胆碱能受体已经形成,尼古丁一旦进入胎儿血流就会与它结合,影响其他神经递质的释放,从而影响到胎儿大脑的发育,可对早期神经发育产生广泛的毒性作用,使婴幼儿发生运动、感觉和认知缺陷[11]。这些研究结果均为孕期化学毒物和吸烟暴露影响胎儿发育期大脑提供了依据。本研究发现ASD 儿童母亲从事职业接触到毒物(如苯、甲苯、染料、农药等)及母亲孕期被动吸烟均为ASD 的危险因素,其中,母亲职业毒物暴露仅与ASD 发病关联,证实了这些环境危险因素对胎儿脑发育的负性影响,推测环境危险因素可能仅作为外因,其对大脑发育的负性影响可能因环境因素不同及个体基因对其易感性的不同而不同,即环境危险因素的暴露与基因交互影响可因环境因素不同及基因易感性对其反应的不同而产生不同的致病作用,如母亲职业毒物暴露仅与ASD 发病关联,而孕期被动吸烟既与GDD 有关,也与以社会交流障碍为主要表现的ASD 关联,由此提示,不同环境危险因素的暴露下,个体的基因背景可能对疾病的发生发展起了导向作用,母亲职业毒物暴露与ASD 的特异关联及其对ASD 起病的贡献作用值得进一步的研究。
本研究结果显示ASD 组儿童母亲孕期患病概率高于正常对照组,而GDD 组和正常对照组相比,母亲孕期疾病史均无统计学意义,提示ASD儿童母亲孕期患病史比GDD 儿童与相应的发育障碍存在更高的患病关联性,即母亲孕期患病这一危险因素可能对具有遗传易感性的孩子产生作用,影响ASD 的发病。进一步分析母亲孕期疾病谱,ASD 组母亲孕期患高血压、严重贫血、癫癎的报告高于正常对照组母亲,这与Lyall 等[12] 研究结果一致,他们发现妊娠合并症母亲的子代罹患ASD的风险明显高于无妊娠合并症的孕妇子代。本研究结果中ASD 组母亲孕期患病毒性感冒史明显高于正常对照组儿童,提示孕期病毒感染这种生物性因素可能通过影响易感基因而致子代患ASD 风险增高。近来丹麦医疗登记所对一万多例ASD 案例进行了研究,发现母亲孕早期的病毒感染与发病有显著性关联,孕中期的病毒感染与发病也有明显的关联性[13]。德马克一个队列研究显示母孕期患流感会使子代患ASD 几率增加2 倍[14]。孕期母亲在感染状态下胎盘作为间接途径改变胎儿脑部发育[15, 16],母孕期感染引起的母体免疫激活[17]可引起胎儿神经及外周免疫改变而影响胎儿中枢神经系统发育,可能通过导致大脑结构和功能的改变而与ASD 的发病有关。脑影像学研究也发现孤独症患者有大脑发育的异常[18],然而,母亲孕期疾病或感染如何与ASD 的发生关联,是否是与ASD 具有因果关系的独立环境危险因素,仍不能确定。针对基因与环境作用的机制,目前有两种学说,其中,“表观现象假说”认为基因的易感性既增加了个体孤独症发病的风险,同时也增加了孕期、围产期及出生后并发症发生的风险,因此,孤独症的发生与出生前后的合并症如母亲孕期疾病、新生儿期疾病只是并列的关系。这种假说得到了Glasson 等 [19] 的支持。第二种“非匀质性假说”提出基因和(或)环境因素对ASD 发病的贡献因个体病例不同而不同。孤独症在某些病例可能主要是基因的作用(如新生儿先天性畸形与ASD 发病风险明显相关[20]),但在另一些病例也可能主要是环境因素的作用,或可能伴有多种不同环境因素介导的累积作用和(或)与基因的交互作用。
近期研究发现父母居住地流动是ASD 的危险因素[21, 22, 23]。本研究发现儿童出生地与ASD发病关联,即出生于县区级医院(包括家中出生3 例)儿童ASD 发病风险高。本研究未调查父母亲是否为流动人口。浙江省调查数据显示[24],省、市三级医院的新生儿活产分娩率明显高于县区级以下医院,但新生儿重度窒息发生率及窒息后分娩现场死亡率县区级医院明显高于三级医院,同时,外来流动人口更多分娩于县区级以下医院(包括家中)。由此推测,儿童出生于县区级医院为ASD 发病的危险因素,可能与外来流动人口、新生儿出生重度窒息等并发症风险高有关。
在社会环境因素中,本研究调查结果发现与生后第2 年内户外活动频率及与同龄儿童交流机会少与ASD 发病风险关联。Tordjman 等[25] 认为ASD 可能与发育序列(developmental sequence)包括交互感知觉模式、躯体形象构建、躯体的自我意识、自我- 非自我的鉴认的受损有关,本研究发现生后第2 年内户外活动频率与ASD 发病高度关联(OR=23.82),提示生后第2 年户外活动机会的剥夺可能通过影响儿童的发育序列,进而影响儿童的社会交往能力并导致ASD。有研究调查提示与同龄儿童交流频率高的儿童人际交流能力较高[26],与儿童交流少是儿童语言发育迟缓的危险因素[27]。生后第2 年是儿童理解他人情绪、意愿、目标及对同伴感兴趣的快速发育期,随着正常的发育轨迹,幼儿逐步发展形成与同伴的复杂的社交形式,参与假扮和互动的游戏及共同问题解决[28, 29]。本研究发现生后第2 年内户外活动频率少、与同龄儿童交流机会少均为ASD、GDD 共同的危险因素,提示生后第2 年内户外活动频率少及缺乏与同龄儿童交流机会与ASD 儿童社交行为发育障碍的关联无特异性,它们与ASD 之间的因果关系有待进一步研究。
综上所述,本研究结果显示多种环境危险因素如母亲职业毒物接触、孕期疾病史及儿童出生地点均与ASD 特异关联,孕期被动吸烟、与同龄儿童的交流机会少及出生后第2 年户外活动少既是ASD 的危险因素,也与GDD 相关;与具有较多的生物性相关危险因素(如母孕期感染、新生儿期疾病等)的GDD 比较,ASD 与出生前后的环境因素关联更为密切,提示了ASD 发病机制可能与多种环境危险因素介导的累积作用和(或)与基因的交互作用有关,对可能与ASD 特异关联的环境危险因素(如母亲职业毒物接触、孕期疾病史、儿童出生地点级别低等)应采用基因- 环境交互作用的综合分析途径,进行深入的研究。
本研究的局限性在于本研究是一个回顾性问卷调查,可能存在回忆偏倚、混杂因素、文化差异等问题,都可能对本研究结果产生影响;另外,本研究采用的调查人群为医院门诊就诊病例和体检人群,并非是不同环境暴露的人群比较,样本量也有限。因此,与ASD 相关的危险环境因素仍需要进一步的验证和深入研究。但本研究为今后进一步开展大规模、多中心、纵向随访,深入探索与ASD 相关的环境危险因素提供了线索。
| [1] | 中华人民共和国卫生部. 儿童孤独症诊疗康复指南[J]. 中国儿童保健杂志, 2011, 19(3): 289-294. |
| [2] | 苏林雁. 儿童孤独症的病因及发病机制[J]. 实用儿科临床杂志, 2010, 25(23): 1765-1767. |
| [3] | 美国精神医学学会.精神障碍诊断与统计手册(张道龙主译)[M]. 第5版. 北京: 北京大学医学出版社, 2015: 15-19. |
| [4] | Autism and Developmental Disabilities Monitoring Network. Prevalence of autism spectrum disorders-Autism and Developmental Disabilities Monitoring Network, 14 Sites, United States, 2008[J]. MMWR Surveill Summ, 2012, 61(3): 1-19. |
| [5] | Kuboa T, Takae H, Miyake K. Epigenetic mechanisms and therapeutic perspectives for neurodevelopmental disorders[J]. Pharmaceuticals (Basel), 2012, 5(4): 369-383. |
| [6] | Sylvie T, Eszter S, Nathalie C. Gene×environment interactions in autism spectrum disorders: role of epigenetic mechanisms[J]. Front Psychiatry, 2014, 5(53): 1-17. |
| [7] | Kim YS, Leventhal BL. Genetic epidemiology and insights into interactive genetic and environmental effects in autism specrum disorders[J]. Biol Psychiatry, 2015, 77(1): 66-74. |
| [8] | State MW, Levitt P. The conundrums of understanding genetic risks for autism spectrum disorders[J]. Nat Neurosci, 2011, 14(12): 1499-506. |
| [9] | Hines EP, Calafat AM, Silva MJ, et al. Concentrations of phthalate metabolites in milk, urine, saliva, and serum of lactating North Carolina women[J]. Environ Health Perspect, 2009, 117(1): 86-92. |
| [10] | Whyatt RM, Liu X, Rauh VA, et al. Maternal prenatal urinary phthalate metabolite concentrations and child mental, psychomotor and behavioral development at age three years[J]. Environ Health Perspect, 2011, 120(2): 290-295. |
| [11] | Knopik VS. Maternal smoking during pregnancy and child outcomes: real or spurious effect?[J]. Dev Neuropsychol, 2009, 34(1): 1-36. |
| [12] | Lyall K, Pauls DL, Spieqelman D, et al. Pregnancy complications and obstetric suboptimality in association with autism spectrum disorders in children of the Nurses' Health Study II[J]. Autism Res, 2012, 5(1): 21-30. |
| [13] | Atladóttir HO, Thorsen P, Østergaard L, et al. Maternal infection requiring hospitalization during pregnancy and autism spectrum disorders[J]. J Autism Dev Disord, 2010, 40(12): 1423-1430. |
| [14] | Atladóttir HÓ, Henriksen TB, Schendel DE, et al. Autism after infection, febrile episodes, and antibiotic use during pregnancy: an exploratory study[J]. Pediatrics, 2012, 130(6): e1447-e1454. |
| [15] | Mandal M, Marzouk AC, Donnelly R, et al. Maternal immune stimulation during pregnancy affects adaptive immunity in offspring to promote development of TH17 cells[J]. Brain Behav Immun, 2011, 25(5): 863-871. |
| [16] | Hsiao E, Patterson PH. Activation of the maternal immune system induces endocrine changes in the placenta via IL-6[J]. Brain Behav Immun, 2011, 25(4): 604-615. |
| [17] | 王田甜, 杜琳, 单玲. 孤独症谱系障碍中免疫异常的研究进展[J]. 中国当代儿科杂志, 2014, 16(12): 1289-1293. |
| [18] | 章丽丽, 朱宗明, 张枫. 孤独症谱系障碍儿童的磁共振弥散张量成像研究[J]. 中国儿童保健杂志, 2014, 22(9): 902-905. |
| [19] | Glasson EJ, Bower C, Petterson B, et al. Perinatal factors and the development of autism: apopulationstudy[J]. Arch Gen Psychiatry, 2004, 61(6): 618-627. |
| [20] | Gardener H, Spiegelman D, Buka SL. Perinatal and neonatal risk factors for autism: a comprehensive meta-analysis[J]. Pediatrics, 2011, 128(2): 344-355. |
| [21] | Fountain C, Bearman P. Risk as social context: immigration policy and autism in California[J]. Sociol Forum (Randolph NJ), 2011, 26(2): 215-240. |
| [22] | Haglund NG, Källén KB. Risk factors for autism and Asperger syndrome. Perinatal factors and migration[J]. Autism, 2011, 15(2): 163-183. |
| [23] | Keen DV, Reid FD, Arnone D. Autism, ethnicity and maternal immigration[J]. Br J Psychiatry, 2012, 196(4): 274-281. |
| [24] | 李文豪, 竺智伟, 邵洁. 浙江省 49 家医院新生儿窒息复苏及培训现状调查[J]. 中国循证儿科杂志, 2014, 9(3): 196-200. |
| [25] | Tordjman S, Maillhes AS. Developmental disorder in body image occurring in early infancy: a common dimension shared by schizophrenia and autism?[J]. Neuropsychiatr Enfance Adolesc, 2009, 57(1): 6-13. |
| [26] | 杨柳, 刘丽, 郑冬梅, 等. 妊娠高血压疾病患者子代2-5岁神经心理发育现况调查[J]. 中国儿童保健杂志, 2011, 19(1): 18-20. |
| [27] | 刘晓, 金星明, 沈晓明. 语言迟缓儿童家庭语言环境的研究[J]. 上海交通大学学报(医学版), 2009, 29(7): 775-777. |
 2015, Vol. 17
2015, Vol. 17