2. 南方医科大学附属中山博爱医院儿科, 广东 中山 528403
动脉导管未闭(patent ductus arteriosus,PDA)是早产儿常见并发症之一,是影响早产儿死亡率及致残率的重要因素,其发生率与胎龄、出生体重呈负相关,胎龄及出生体重越低,PDA 发生率越高[1]。目前多主张对症状性PDA(sPDA)进行干预治疗,并以药物干预为首选。但由于早产儿生后肺循环压力适应性变化及肺部疾病的影响,早期识别sPDA 是困难的。随着生后时间的延长,sPDA 的识别变得容易,而遗憾的是,延迟识别、延迟处理可能导致早产儿暴露于危险因素的时间延长,心脏衰竭、脑室内出血、新生儿坏死性小肠结肠炎、慢性肺疾病、脑白质软化等并发症发生率增高[2],严重影响早产儿预后。因此,早期预测sPDA 的出现显得尤为重要。
超声心动图是诊断PDA 的金标准,但器材昂贵,基层医院不能普遍应用,且技术员的观察能力高低、测量误差可能影响结果的准确性,所以,心脏的生化标志可能为临床更便捷、准确地提供信息。国外研究显示,PDA 早产儿早期脑钠肽(brain natriuretic peptide,BNP)水平对预测sPDA及评估其后期是否需干预治疗有临床价值[3, 4],尤其是第3 日龄为最佳预测时间[5]。由于NT-proBNP与BNP 均隶属于利钠肽系统,当心脏容量负荷增大,心室壁受牵拉时,二者以1 : 1 的比例释放入血液,因此,NT-proBNP 具有BNP 相似特性,其血中水平反映心室功能障碍的程度,对新生儿心力衰竭具有诊断价值[6]。另外,NT-proBNP 半衰期比BNP 更长、体外稳定性更高[7, 8]。因此,本研究前瞻性分析sPDA 早产儿临床经过的同时,研究NT-proBNP 与超声心动图指标相关性,以及NTproBNP预测sPDA 的敏感度及特异度,探讨早期NT-proBNP 水平对预测sPDA 的临床价值。
1 资料与方法 1.1 研究对象2014 年6 月至2015 年4 月出生、于南方医科大学附属中山博爱医院住院的早产儿为研究对象。入组标准:(1) 生后24 h 内入院;(2) 胎龄≤ 32 周;(3)生后48 h 内超声心动图检查确定存在动脉导管。排除标准:(1)PDA 及卵圆孔未闭以外的先天性心脏病;(2) 败血症;(3) 新生儿持续肺动脉高压;(4)窒息;(5)肾功能衰竭;(6)与PDA 无关的死亡病例。
1.2 分组根据sPDA 诊断标准,将患儿分为sPDA 组及非症状性PDA(asPDA)。sPDA 诊断标准如下[5, 9]:
(1)临床及胸片指标:①呼吸状况恶化(气促和吸入氧浓度增加,或需要机械通气);②胸骨左缘上方可闻及连续性或收缩期杂音;③水冲脉或心前区搏动明显;④血压难以维持正常水平;⑤胸片影像学显示:肺血增多引起的肺充血或者心脏扩大(心胸比大于60%)。
(2)超声指标:①超声心动图发现舒张期动脉导管存在左向右分流;②导管大于1.5 mm 及左房内径与主动脉根部内径比值(left atria/aorta root,LA/AO)>1.3。
符合临床及胸片指标2 条或以上,并符合超声指标者诊断为sPDA。
1.3 sPDA 早期征象标准sPDA 患儿住院过程中出现的首个与sPDA 临床诊断标准相关的临床表现定义为sPDA 早期征象。
1.4 资料的收集(1)一般资料:收集胎龄、出生体重、性别、出生日期、入科时间、出生方式、Apgar 评分等资料;观察研究对象住院过程中是否出现新生儿呼吸窘迫综合征、新生儿坏死性小肠结肠炎、脑室内出血、肺炎,记录确诊sPDA 前液体入量,有否使用肺表面活性物质。(2)临床症状:呼吸状况恶化情况(气促和吸入氧浓度增加,或需要机械通气);心脏杂音;水冲脉或心前区搏动明显;血压。(3)胸片:根据临床需要完善胸部影像学检查,记录是否出现肺血增多征象及心胸比例。
1.5 超声心动图检查(1)对24 h 内入院、胎龄≤ 32 周的早产儿生后48 h 内查超声心动图(探头为3~5 MHz 的PHILIPS iE Elite 彩色多普勒超声诊断仪)明确是否存在动脉导管;(2)对入组者于生后3 d、5 d查超声心动图,检查指标包括:动脉导管管径、动脉导管血流分流方向、LA/AO 比值、左室舒张末期前后径(left ventricular end-diastolic diameter,LVEDD)、左室收缩末期前后径(left ventricularend-systolic diameter,LVESD)、左室射血分数(leftventricular ejection fraction,LVEF);(3) 早产儿出现sPDA 临床及胸片指标2 条或以上时再次查超声心动图,记录动脉导管管径、LA/AO 比值,以确诊sPDA。
1.6 血清NT-proBNP 含量的检测对入组者于生后3 d、5 d 查超声心动图的同时取静脉血1 mL,置于干燥管离心取血清,以miniVIDAS 分析仪( 检测范围为15~25 000 pg/mL) 检测NT-proBNP,当样品NTproBNP>25 000 pg/mL 时,使用试剂盒中提供的R1液稀释4 倍后,重新检测。检测试剂、定标品、质控品均购自法国梅里埃公司。
1.7 统计学分析采用SPSS 20.0 统计软件进行分析。正态分布的计量资料以均数± 标准差(x±s)描述,方差齐者组间比较采用成组t 检验,方差不齐者组间比较采用Wilcoxon 秩和检验;非正态分布计量资料以中位数及四分位数[M(P25,P75)] 描述,组间比较采用Wilcoxon 秩和检验;计数资料以例数和百分率(%)描述,组间比较采用卡方检验或Fisher 确切概率法;NT-proBNP 水平与超声指标关系采用双变量相关分析;采用ROC 曲线评价NTproBNP对sPDA 的预测价值,确定最佳界限值;P<0.05 为有统计学意义。
2 结果 2.1 一般资料共69 例早产儿纳入研究,其中sPDA 组13 例,男9 例,女4 例,胎龄30.0±1.7 周,出生体重1 367±249 g;asPDA 组56 例,男32 例,女24 例,胎龄30.8±1.4 周,出生体重1 454±265 g。sPDA组及asPDA 组两组间的胎龄、出生体重、性别、确诊sPDA 前平均每日液体入量、是否应用肺泡表面活性物质方面进行比较差异均无统计意义(表 1)。
|
|
表 1 sPDA 组及asPDA 组一般资料、支持治疗及并发症发生率的比较 |
sPDA 组中,13 例早产儿生后2~7 d(平均3.7 d)出现sPDA 早期征象(心前区杂音、心前区搏动明显、呼吸恶化、心率加快等症状之一),生后7~16 d(平均11 d)才被诊断为sPDA。11 例患儿应用布洛芬干预治疗后,临床症状均好转,其中7 例(64%)动脉导管关闭,另外4 例(36%)动脉导管管径缩小。
2.3 NT-proBNP 与超声指标的相关分析生后3 d 血清NT-proBNP 值与动脉导管管径高度正相关(r=0.856,P<0.001),NT-proBNP 值与LA/AO 比值中度正相关(r=0.713,P<0.001);但与LVEF、LVEDD、LVESD 无相关性( 分别r= -0.229、0.310、0.341,均P>0.05)。生后5 d血清NT-proBNP 值与动脉导管管径、LA/AO 比值均呈中度正相关( 分别r=0.528、0.721,均P<0.05),与LVEF、LVEDD、LVESD 无相关性(分别r=0.596、 -0.012、0.098,均P>0.05)。
2.4 sPDA 组与asPDA 组血清NT-proBNP 值的比较生后3 d 及5 d sPDA 组血清NT-proBNP 水平均高于asPDA 组,差异有统计学意义(P<0.001),见表 2。
|
|
表 2 sPDA 组及asPDA 组生后3 d 及5 d 血清NT-proBNP水平的比较 (x±s,pg/mL) |
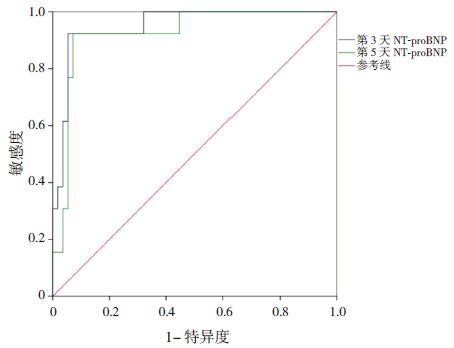
生后3 d 血清NT-proBNP 诊断sPDA 的ROC曲线下面积为0.949(95%CI:0.892~1.000,P<0.001),临界值为27 035 pg/mL,敏感度为92.3%,特异度为94.6%;生后5 d 血清NT-proBNP诊断sPDA 的ROC 曲线下面积为0.924(95%CI:0.848~1.000,P<0.001),临界值为6 411 pg/mL,敏感度为92.3%,特异度为92.9%(图 1)。
|
图 1 NT-proBNP 诊断sPDA 的ROC 曲线 |
动脉导管是胎儿期连接肺动脉及主动脉的正常通道,生后随血氧分压增高、前列腺素浓度减少、导管壁肌肉收缩,管径逐渐缩小,最后关闭。但早产儿动脉导管管壁因平滑肌发育不良、氧诱导管壁收缩机制不成熟及动脉导管对血管舒张因子敏感性增高,使管壁不能形成缺血缺氧区,导致动脉导管持续开放[10],形成分流。动脉导管左向右分流会使体循环血流减少,肺血流增加,左心室容量负荷加重,超过机体代偿极限时,肺顺应性逐渐下降,心肌做功增加,最终导致呼吸状况恶化及心力衰竭[11]。
目前对于早产儿sPDA 尚无统一的诊断指标,相关临床研究中多以心脏杂音、呼吸状况恶化、水冲脉或心前区搏动明显、血压难以维持、心脏增大中的2 项或以上作为必要条件[5, 9, 12]。在本研究观察中,以上述必备条件的2 项或以上及动脉导管管径大于1.5 mm、LA/AO 比值大于1.3、舒张期动脉导管存在左向右分流作为sPDA 诊断标准,共13 例被诊断为sPDA。分析13 例患儿临床经过发现,其生后平均3.7 d 才出现sPDA 的早期征象,其中心脏杂音10 例,心前区搏动3 例,但直到平均生后11 d 才被诊断为sPDA,提示仅以临床表现识别sPDA,存在延迟诊断的风险,可能会加重肺淤血、肺炎等肺部疾病,延长呼吸机使用时间,增加慢性肺支气管发育不良发生的风险。因此,单纯以临床表现诊断sPDA 可能会使诊断的敏感性下降,并且临床症状不能及时反映心脏负荷变化,不能早期为sPDA 治疗提供依据。
国外相关研究表明动脉管径、LA/AO 比值是评估PDA 新生儿血流动力学改变、动脉导管分流量的重要指标[13, 14]。本研究显示血清NT-proBNP水平与动脉导管管径、LA/AO 比值呈正相关,与Martinovici 等[15] 及Buddhe 等[16] 的研究一致,但生后3 d 血清NT-proBNP 水平与动脉导管管径相关性比LA/AO 比值强,这可能与PDA 的早产儿大部分合并卵圆孔未闭,存在心房水平的左向右分流,减轻了对左房容量负荷的影响有关;生后5 d 血清NT-proBNP 水平与动脉导管管径相关性下降,可能与NT-proBNP 水平生理性下降较明显有关。以上结果提示血清NT-proBNP 水平不仅比临床表现更能敏感地反映心脏容量负荷变化,亦可能是动脉导管分流量的量化指标,反映PDA 新生儿血流动力学改变。
新生儿由胎儿循环向生后循环的转换过程中,左心室容量和压力负荷增加,导致NT-proBNP 分泌增多,同时新生儿存在肾脏清除功能不成熟,NT-proBNP 清除减少,导致新生儿存在早期生理性NT-proBNP 升高现象。随着血管阻力下降、肺循环压力减少及肾脏清除功能成熟,NT-proBNP 水平逐渐下降并渐趋稳定水平。所以正常新生儿生后血液NT-proBNP 逐渐上升,生后1 d 达到最高水平,之后开始逐渐下降并渐趋稳定水平[17, 18]。但sPDA早产儿由于存在左向右分流,左心容量负荷增大,血清NT-proBNP 会异常增高。在本研究中,无论在生后3 d 或5 d,sPDA 组早产儿血清NT-proBNP值均比asPDA 组高;利用ROC 曲线分析显示,生后3 d 及5 d 血清NT-proBNP 水平对sPDA 的预测价值均较高,预测的敏感度和特异度均在92%以上,提示生后3 d 及5 d 血清NT-proBNP 水平均有助于早期预测sPDA,结果与Ramakrishnan 等[19]的研究结果相似。然而,尽管本研究显示血清NTproBNP水平对早产儿sPDA 有较高的预测价值,但仍有一定比例的漏诊率及误诊率,提示需加大样本量进一步研究以确定NT-proBNP 早期预测sPDA 的最佳诊断值。
| [1] | 陈涵强, 杨文庆, 杨长仪. 早产儿动脉导管未闭危险因素临床分析[J]. 中国新生儿科杂志, 2010, 25(1): 24-27. |
| [2] | Sellmer A, Bjerre JV, Schmidt MR, et al. Morbidity and mortality in preterm neonates with patent ductus arteriosus on day 3[J]. Arch Dis Child Fetal Neonatal Ed, 2013, 98(6): F505-F510. |
| [3] | Kim JS, Shim EJ. B-type natriuretic peptide assay for the diagnosis and prognosis of patent ductus arteriosus in preterm infants[J]. Korean Circ J, 2012, 42(3): 192-196. |
| [4] | Mine K, Ohashi A, Tsuji S, et al. B-type natriuretic peptide for assessment of haemodynamically significant patent ductus arteriosus in premature infants[J]. Acta Paediatr, 2013, 102(8): e347-e352. |
| [5] | Choi BM, Lee KH, Eun BL, et al. Utility of rapid B-type natriuretic peptide assay for diagnosis of symptomatic patent ductus arteriosus in preterm infants[J]. Pediatrics, 2005, 115(3): e255-e261. |
| [6] | 张茜, 罗成汉, 王健. N端脑钠肽前体对新生儿心力衰竭的早期诊断价值[J]. 实用儿科临床杂志, 2010, 25(6): 419-420. |
| [7] | NT-proBNP临床应用中国专家共识小组. NT-proBNP临床应用中国专家共识[J]. 中国心血管研究, 2011, 9(6): 401-408. |
| [8] | 王野峰, 黄希勇. 脑钠肽和氨基末端脑钠尿肽原在儿童心血管疾病诊治中的进展[J]. 中国当代儿科杂志, 2012, 14(6): 470-474. |
| [9] | Malviya MN, Ohlsson A, Shah SS. Surgical versus medical treatment with cyclooxygenase inhibitors for symptomatic patent ductus arteriosus in preterm infants[J]. Cochrane Database Syst Rev, 2013, 3: CD003951. |
| [10] | Hamrick SE, Hansmann G. Patent ductus arteriosus of the preterm infant[J]. Pediatrics, 2010, 125(5): 1020-1030. |
| [11] | Schneider DJ, Moore JW. Patent ductus arteriosus[J]. Circulation, 2006, 114(17): 1873-1882. |
| [12] | Suzumura H, Nitta A, Tanaka G, et al. Diastolic flow velocity of the left pulmonary artery of patent ductus arteriosus in preterm infants[J]. Pediatr Int, 2001, 43(2): 146-151. |
| [13] | Engur D, Deveci M, Turkmen MK. Early signs that predict later haemodynamically significant patent ductus arteriosus[J]. Cardiol Young, 2015 [Epub ahead of print]. |
| [14] | Harling S, Hansen-Pupp I, Baigi A, et al. Echocardiographic prediction of patent ductus arteriosus in need of therapeutic intervention[J]. Acta Paediatr, 2011, 100(2): 231-235. |
| [15] | Martinovici D, Vanden ES, Unger P, et al. Early NT-proBNP is able to predict spontaneous closure of patent ductus arteriosus in preterm neonates, but not the need of its treatment[J]. Pediatr Cardiol, 2011, 32(7): 953-957. |
| [16] | Buddhe S, Dhuper S, Kim R, et al. NT-proBNP levels improve the ability of predicting a hemodynamically significant patent ductus arteriosus in very low-birth-weight infants[J]. J Clin Neonatol, 2012, 1(2): 82-86. |
| [17] | 时赞扬,张茜. B型利钠肽及氨基末端脑钠肽前体水平与早产儿疾病相关性研究进展[J]. 中华临床医师杂志(电子版), 2013, 7(8): 3490-3493. |
| [18] | Mir TS, Laux R, Hellwege HH, et al. Plasma concentrations of aminoterminal pro-atrial natriuretic peptide and aminoterminal pro-brain natriuretic peptide in healthy neonates: marked and rapid increase after birth[J]. Pediatrics, 2003, 112(4): 896-899. |
| [19] | Ramakrishnan S, Heung YM, Round J, et al. Early N-terminal pro-brain natriuretic peptide measurements predict clinically significant ductus arteriosus in preterm infants[J]. Acta Paediatr, 2009, 98(8): 1254-1259. |
 2015, Vol. 17
2015, Vol. 17