2. 湖南省人民医院, 湖南 长沙 410005
由于脓毒症在儿童重症监护病房(PICU)发生率高、病死率高、治疗费用高,对患儿病情进行有效评估,早期进行全面综合及个体化的治疗,有利于改善患儿的预后。脓毒症的诊断前提是存在感染,传统的感染标志物白细胞(WBC)、C-反应蛋白(CRP)可能受年龄、机体免疫状况、院外激素治疗等因素影响,其临床价值有一定的局限性,较理想的感染标志物降钙素原(procalcitonin,PCT)也受到了一些研究者质疑[1],寻找理想的脓毒症生物标志物仍是全球研究热点。胰石蛋白(pancreatic stone protein /regenerating protein,PSP/reg)是再生基因(regenerating gene,reg 基因)编码,主要由胰腺腺泡细胞合成和分泌,胃、肠、肝脏、肾脏、肾上腺、脑中也存在regI 受体mRNA,证明reg 信号系统存在于多种细胞[2]。 近年来,PSP/reg 在脓毒症中的应用前景受到很多国外研究者的重视[3, 4],但PSP/reg 对脓毒症患儿的危险分层及早期预后评估价值尚不完全明确。本研究采用前瞻性研究探讨不同程度脓毒症、不同预后患儿PSP/reg 水平变化,并与其他感染标志物比较,为临床脓毒症患儿病情评估提供新线索。
1 资料与方法 1.1 研究对象前瞻性收集2013 年9 月至2014 年9 月入住湖南省儿童医院PICU、符合本研究入选标准的159 例脓毒症患儿及同期20 例非脓毒症患儿的临床资料。脓毒症患儿纳入标准:符合美国危重医学会和美国儿科学会制定的PICU 入院、出院初步指南标准,符合2005 年脓毒症定义大会制定的儿童脓毒症诊断标准[5],分为脓毒症组(106 例)、严重脓毒症组(53 例,其中脓毒性休克12 例)。同期随机选取PICU 住院的非脓毒症患儿20 例作为对照组,包括长QT 综合征、急性喉梗阻、阵发性心动过速等。排除标准:排除患有慢性肺部疾病、先天性心脏疾病、慢性肾脏疾病、重度营养不良等基础疾病的患儿;排除急慢性胰腺炎、糖尿病、其他胰酶增高(血淀粉酶或脂肪酶)或胰腺影像学检查异常的患儿。
1.2 临床资料收集采用前瞻性研究,根据本研究目的,设计临床资料登记表格,由专人负责对表格逐一详细记录,包括年龄、性别、基础疾病、有创机械通气情况、器官衰竭情况、住院时间、出院情况,记录入住PICU 后儿童危重病例评分(pediatriccritical illness score,PCIS)、PCT、WBC、CRP 检测结果等。
1.3 血标本收集及检测前瞻性收集患儿入住PICU 后1 h 内(本研究记为第1 天)、第3、7 天清晨未输注含糖液空腹外周静脉血1 mL,离心取血浆,置于-70℃冰箱冰冻保存,统一分批待测血浆PSP/reg 浓度。血浆PSP/reg 浓度检测:试剂盒由卡迈舒生物科技有限公司提供,采用酶联免疫吸附法,由专人严格按说明书进行操作。
1.4 统计学分析采用SPSS 18.0 专业统计学软件进行数据处理。计数资料用频数(百分比)表示,组间比较采用卡方检验。血浆PSP/reg 水平经正态性检验和Levene 方差齐性检验发现不符合正态性、方差齐性,采用中位数及四分位数M(P25,P75)表示,两独立样本间比较采用非参数Mann-Whitney U 检验,多组独立样本采用非参数Kruskal-Wallis H 检验。指标间的相关性采用Spearman 秩相关分析。采用受试者工作特征曲线(ROC 曲线)下面积(AUC)评估各指标判断脓毒症患儿病情严重程度及预后的价值。P<0.05 认为差异有统计学意义。
2 结果 2.1 一般资料159例脓毒症患儿中,男109 例(68.6%),女50 例(31.4%);<1 岁100 例(62.9%),1~3 岁30 例(18.9%),3 岁以上29 例(18.2%);需有创机械通气55 例(35.6%);3 个以上器官衰竭18 例(11.3%); 死亡27 例(17.0%)。20 例对照组患儿中,男10 例(50.0%),女10 例(50.0%);<1 岁12 例(60.0%),1~3 岁4 例(20.0%),3 岁以上4 例(20.0%)。脓毒症组与对照组性别构成、年龄段比较差异无统计学意义(P>0.05)。
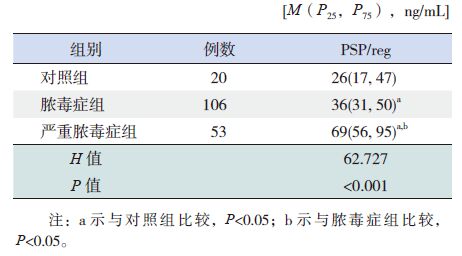
2.2 不同程度脓毒症患儿血浆PSP/reg 水平及动态变化趋势对照组、脓毒症组、严重脓毒症组3 组患儿第1 天血浆PSP/reg 水平比较差异有统计学意义(H=62.727,P<0.001),其中脓毒症组、严重脓毒症组血浆PSP/reg 水平显著高于对照组( 分别Z=-2.176,P=0.030;Z=-4.651,P<0.001); 严重脓毒症组血浆PSP/reg 水平显著高于脓毒症组(Z=-7.627,P<0.001),见表 1。
|
|
表 1 3 组患儿第1 天血浆PSP/reg 水平比较 |
12例脓毒症性休克患儿第1 天血浆PSP/reg水平为87(66,151)ng/mL,与其他严重脓毒症患儿比较,脓毒症性休克患儿第1 天PSP/reg 水平显著升高(Z=-2.619,P=0.009)。
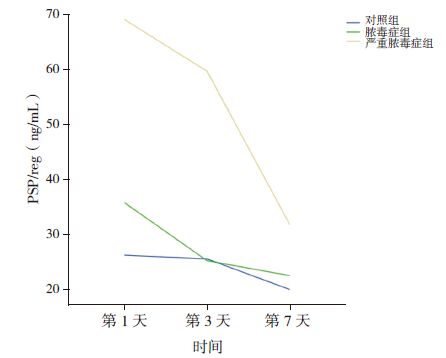
对照组、脓毒症组、严重脓毒症组患儿第3、7 天血浆PSP/reg 水平均逐渐下降,其中严重脓毒症组第3~7 天PSP/reg 水平下降更为明显(图 1)。
|
图 1 3 组患儿血浆PSP/reg 的动态变化 |
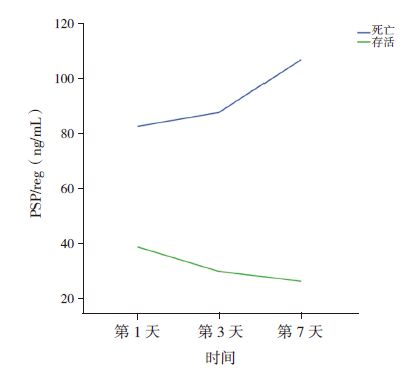
存活(132 例)、死亡患儿(27 例)第1 天血浆PSP/reg 水平分别为39(30,55)、83(61,125)ng/mL,死亡患儿高于存活患儿,差异有统计学意义(Z=-5.637,P<0.001)。死亡患儿在第3、7 天血浆PSP/reg 水平逐渐增高,而存活患儿在第3、7 天逐渐下降(图 2)。
|
图 2 不同预后患儿血浆PSP/reg 的动态变化 |
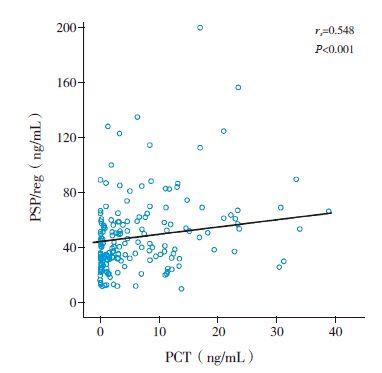
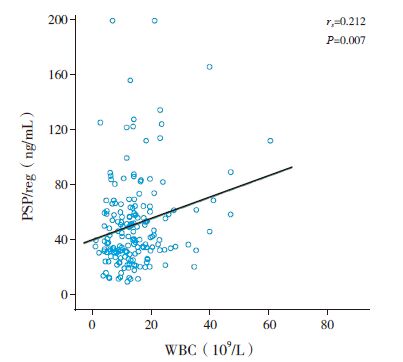
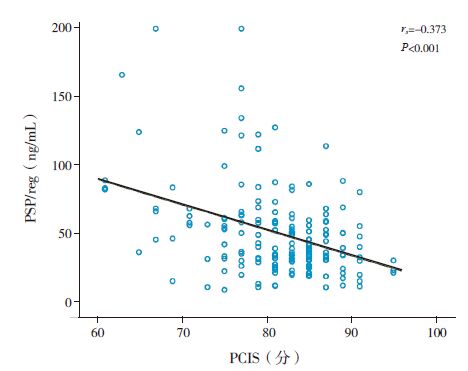
Spearman 相关分析显示,脓毒症患儿第1 天血浆PSP/reg 水平与血清PCT 水平和WBC 计数呈正相关(rs 分别为0.548、0.212,P 值分别为 <0.001、0.007),与CRP 无明显相关性(rs=0.131,P=0.101); 第1 天血浆PSP/reg 水平与PCIS 评分呈显著负相关(rs=-0.373,P<0.001)( 图 3~ 5)。
|
图 3 血浆PSP/reg 与血清PCT 的相关性 |
|
图 4 血浆PSP/reg 与WBC 的相关性 |
|
图 5 血浆PSP/reg 与PCIS 的相关性 |
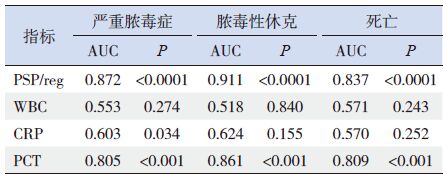
采用ROC 曲线下面积(AUC)评估第1 天血浆PSP/reg 水平、WBC 计数、血清CRP、PCT 水平判断脓毒症患儿是否为严重脓毒症、脓毒性休克及结局为死亡的价值,其中血浆PSP/reg 和血清PCT 水平均能单独用于判断是否为严重脓毒症、脓毒性休克或死亡(AUC>0.7,P<0.05),而CRP、WBC 对脓毒症患儿病情评估价值较小(AUC<0.7),见表 2。
|
|
表 2 PSP/reg 及其他感染指标对脓毒症患儿病情评估价值的比较 |
脓毒症是感染所导致的全身炎症反应综合征,早期识别感染有利于临床指导抗生素应用。PCT是目前已知对感染相关疾病最有价值的标志物之一,主要由神经内分泌细胞生成,由116 个氨基酸组成的糖蛋白,分子量为14.5 kDa,是血清降钙素的前体物质。国际脓毒症定义把PCT 作为判断脓毒症的感染指标[6],与小儿危重病例评分密切相关,脓毒症患者及死亡患者血清PCT 水平高于非脓毒症患者及存活患者,能早期评估病情严重程度及预后[7, 8, 9],但PCT 在无感染的应激状态下可明显升高,易受抗生素的影响,且PCT 检测费用高,PCT 对脓毒症患儿病情判断有一定局限性。Palmiere 等[10] 对脓毒症及非脓毒症死亡患者研究发现,PSP/reg 与PCT 呈正相关,相关系数为0.6(P<0.05),脓毒症者PSP/reg 水平高于非脓毒症者。本研究发现,脓毒症患儿入住PICU 后第1 天血浆PSP/reg 水平与WBC 计数及血清PCT 水平呈正相关,其中与PCT 相关系数较大,PCT 水平越高,则PSP/reg 水平越高,提示PSP/reg 也与感染密切相关,是具有广泛应用前景的脓毒症标志物。
PSP/reg 属于C 型凝集素家族,在胰蛋白酶水解下,分解成11 和133 个氨基酸两个小片段,N-末端抑制晶体生长,C- 末端与Ca2+ 依赖的外源凝集素结构相关,对细菌有凝集作用[11]。以往很多研究发现,PSP/reg 在急慢性胰腺炎、糖尿病、炎症性肠病、消化道肿瘤患者中升高[12, 13, 14],有促有丝分裂、调节细胞粘附、促进细菌聚集、抗凋亡、抗炎、抗肿瘤等作用。PSP/reg 主要由胰腺腺泡细胞合成和分泌,是一种急性反应蛋白,胰腺损伤对其产生及分泌有一定影响,但对无胰腺损伤的多发性外伤患者研究发现,住院期间发生脓毒症、局部感染、无感染患者PSP/reg 水平高峰分别为146.4、111.4、22.8 ng/mL;通过细胞流式仪检测发现PSP/reg 与中性粒细胞上CD11b、CD62L 表达密切相关,表明PSP/reg 结合并激活中性粒细胞[15],提示无胰腺损伤的感染患者血浆PSP/reg 水平升高。
越来越多的国外研究证实,PSP/reg 在脓毒症诊断及病情评估方面优于其他感染标志物,使临床医生对患者的病情有可预见性,有利于治疗及医患沟通。早在1993 年Tatemichi 等[16] 研究发现,重症监护病房患者血浆PSP/reg 水平明显高于正常人,PSP/reg 可用于判断危重患者病情。一项前瞻性多中心研究表明,PSP/reg、PCT、CRP 鉴别婴儿早期感染与非感染的AUC 分别为0.69、0.77、0.66,PSP/reg 与性别、胎龄、出生体重、产后年龄无明显相关,而与CRP、PCT 正相关;PSP/reg与早期脓毒症的比值比(OR)为26.4,而PCT 为7.9,PSP/reg 在局部感染、脓毒症中应用价值可能优于PCT[17]。Scherr 等[18] 发现,慢性阻塞性肺疾病急性加重期较稳定期患者血浆PSP/reg 水平升高,痰培养阳性较阴性患者血浆PSP/reg 水平高,PSP/reg 是痰细菌学阳性的独立预测因素。感染面积增大、病情程度加重、器官衰竭个数增多患者的血浆PSP/reg 水平越高,与急性生理与慢性健康评分(acute physiology and chronic health evaluation,APACHE)、序贯器官衰竭估计(sequential organfailure assessment,SOFA)相关性大,是预测患者是否需要肾替代治疗的指标,是反映病情的严重程度较好的指标,有助于预测ICU 患者死亡风险[19, 20]。本研究中,对照组、脓毒症组、严重脓毒症组患儿第1 天血浆PSP/reg 依次升高,且脓毒性休克患儿较其他严重脓毒症患儿水平高,死亡患儿较存活患儿水平高;第1 天血浆PSP/reg 水平判断脓毒症患儿是否为严重脓毒症、脓毒性休克、死亡的AUC 分别为0.872、0.911、0.837,与PCT诊断价值相近,而明显优于WBC、CRP;第1 天血浆PSP/reg 与PCIS 评分的Spearman 相关系数为-0.373,PCIS 评分越低则PSP/reg 水平越高。这些研究结果表明,血浆PSP/reg 可用于脓毒症患儿危险分层及早期评估患儿预后。
本研究还对血浆PSP/reg 水平动态监测发现,对照组、脓毒症组、严重脓毒症组的血浆PSP/reg水平在入住PICU 后第3、7 天逐渐下降,其中严重脓毒症组第3 天至第7 天PSP/reg 下降趋势最大,提示严重脓毒症患儿病情好转后血浆PSP/reg 水平下降更为明显;存活组患儿血浆PSP/reg 水平在第3、7 天逐渐下降,而死亡组患儿逐渐增高,血浆PSP/reg 水平持续升高预示患儿有死亡风险。也有国外研究者对脓毒症患儿血浆PSP/reg 动态监测发现,在儿童器官功能障碍评分(paediatric logisticorgan dysfunction,PELOD)大于12 分、多器官功能障碍、死亡患儿PSP/reg 水平明显升高;非多器官功能衰竭综合征(multiple organ disfunctionsyndrome,MODS)患儿入院后连续5 d PSP/reg 水平相差不大,而MODS 患儿有增高趋势;存活患儿入院后连续5 d PSP/reg 水平变化小,死亡患儿入院后前2 d PSP/reg 明显升高,而第3 天开始逐渐下降[21]。对呼吸机相关肺炎(VAP)患者的血浆PSP/reg 连续7 d 动态检测也发现,死亡者高于幸存者近3 倍,入院后第7 天PSP/reg 水平仍高的患者死亡风险明显增高,PSP/reg 预测VAP 患者死亡具有较高的特异性[22]。总之,本研究显示血浆PSP/reg 水平及动态监测有利于判断脓毒症患儿病情及评估脓毒症患儿死亡风险。
| [1] | Chakravarthy M, Kavaraganahalli D, Pargaonkar S, et al. Elevated postoperative serum procalcitonin is not indicative of bacterial infection in cardiac surgical patients[J]. Ann Card Anaesth, 2015, 18(2): 210-214. |
| [2] | Kobayashi S, Akiyama T, Nata K, et al. Identification of a receptor for reg (regenerating gene) protein, a pancreatic beta-cell regeneration factor[J]. J Biol Chem, 2000, 275(15): 10723-10726. |
| [3] | Busani S, Girardis M. PSP/reg: a new stone in sepsis biomarkers?[J]. Crit Care, 2012, 16(4): 143. |
| [4] | Fisher OM, Oberkofler CE, Raptis DA, et al. Pancreatic stone protein (PSP) and pancreatitis-associated protein (PAP): a protocol of a cohort study on the diagnostic efficacy and prognostic value of PSP and PAP as postoperative markers of septic complications in patients undergoing abdominal surgery (PSP study)[J]. BMJ Open, 2014, 4(3): e4914. |
| [5] | Goldstein B, Giroir B, Randolph A. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics[J]. Pediatr Crit Care Med, 2005, 6(1): 2-8. |
| [6] | Levy MM, Fink MP, Marshall JC, et al. 2001 SCCM/ESICM/ACCP/ATS/SIS International Sepsis Definitions Conference[J]. Crit Care Med, 2003, 31(4): 1250-1256. |
| [7] | Barati M, Alinejad F, Bahar MA, et al. Comparison of WBC, ESR, CRP and PCT serum levels in septic and non-septic burn cases[J]. Burns, 2008, 34(6): 770-774. |
| [8] | 彭红艳, 祝益民, 张新萍. 降钙素原联合心脏相关标志物评估脓毒症患儿病情意义[J]. 临床儿科杂志, 2015, 33(1): 23-27. |
| [9] | 齐英征. 降钙素原与小儿危重病例评分对脓毒症患儿预后的影响[J]. 中国当代儿科杂志, 2014, 16(2): 190-193. |
| [10] | Palmiere C, Augsburger M. Pancreatic stone protein as a postmortem biochemical marker for the diagnosis of sepsis[J]. Leg Med (Tokyo), 2015, 17(1): 9-13. |
| [11] | Iovanna J, Frigerio JM, Dusetti N, et al. Lithostathine, an inhibitor of CaCO3 crystal growth in pancreatic juice, induces bacterial aggregation[J]. Pancreas, 1993, 8(5): 597-601. |
| [12] | Peterson KM, Guo X, Elkahloun AG, et al. The expression of REG 1A and REG 1B is increased during acute amebic colitis[J]. Parasitol Int, 2011, 60(3): 296-300. |
| [13] | Imaoka H, Ishihara S, Kazumori H, et al. Exacerbation of indomethacin-induced small intestinal injuries in Reg I-knockout mice[J]. Am J Physiol Gastrointest Liver Physiol, 2010, 299(2): G311-G319. |
| [14] | Sekikawa A, Fukui H, Zhang X, et al. REG Ialpha is a biomarker for predicting response to chemotherapy with S-1 plus cisplatin in patients with unresectable stage IV gastric cancer[J]. Br J Cancer, 2013, 108(2): 395-401. |
| [15] | Keel M, Harter L, Reding T, et al. Pancreatic stone protein is highly increased during posttraumatic sepsis and activates neutrophil granulocytes[J]. Crit Care Med, 2009, 37(5): 1642-1648. |
| [16] | Tatemichi N, Takahashi C, Hayakawa S, et al. Enzyme immunoassay and characterization of pancreatic stone proteins in human urine[J]. J Clin Lab Anal, 1993, 7(6): 365-370. |
| [17] | Schlapbach LJ, Graf R, Woerner A, et al. Pancreatic stone protein as a novel marker for neonatal sepsis[J]. Intensive Care Med, 2013, 39(4): 754-763. |
| [18] | Scherr A, Graf R, Bain M, et al. Pancreatic stone protein predicts positive sputum bacteriology in exacerbations of COPD[J]. Chest, 2013, 143(2): 379-387. |
| [19] | Gukasjan R, Raptis DA, Schulz HU, et al. Pancreatic stone protein predicts outcome in patients with peritonitis in the ICU[J]. Crit Care Med, 2013, 41(4): 1027-1036. |
| [20] | Llewelyn MJ, Berger M, Gregory M, et al. Sepsis biomarkers in unselected patients on admission to intensive or high-dependency care[J]. Crit Care, 2013, 17(2): R60. |
| [21] | Jiri Z, Kyr M, Vavrina M, et al. Pancreatic stone protein - a possible biomarker of multiorgan failure and mortality in children sepsis[J]. Cytokine, 2014, 66(2): 106-111. |
| [22] | Boeck L, Graf R, Eggimann P, et al. Pancreatic stone protein: a marker of organ failure and outcome in ventilator-associated pneumonia[J]. Chest, 2011, 140(4): 925-932. |
 2015, Vol. 17
2015, Vol. 17