毛细支气管炎(以下简称毛支炎)是以小气道急性炎性反应、水肿、上皮细胞坏死、黏液分泌增多及支气管痉挛为特征的一种疾病。多发生于2岁以下尤其6个月以下小婴儿,主要由呼吸道合胞病毒引起。临床表现为吸气性三凹征、气促、喘憋等特点。长期随访观察发现部分毛支炎患儿可发展为支气管哮喘[1],且比例明显高于正常儿童[2],严重危害患儿身心健康,但发病机制仍不明确。研究表明毛支炎与支气管哮喘具有相同或相似的发病机制[3]。黏附分子在支气管哮喘的发病机制中起重要作用,在支气管哮喘中不仅参与炎症形成过程、作为病毒受体介导病毒感染,还广泛参与机体免疫应答和免疫调节过程[4]。黏附分子CD62P在自身免疫性疾病[5]、肿瘤[6]、动脉粥样硬化[7]、哮喘[8] 等多种疾病的发病过程中起重要的作用,CD44 在多种疾病中存在过度表达,但二者在毛支炎患儿中经国内外文献检索未见相关报道。本文通过检测毛支炎、支气管肺炎及对照组患儿外周血中黏附分子CD62P、CD44 的表达,以探讨两者在毛支炎中的表达及意义。
1 资料与方法 1.1 研究对象选取2014 年11 月至2015 年5 月于我院儿内科住院的毛支炎患儿52 例为研究对象,其中处于发病期患儿33 例(毛支炎发病期组),男19 例,女14 例,年龄2~17 个月,平均年龄9.0±4.0 个月;处于恢复期患儿19 例(毛支炎恢复期组),男9 例,女10 例,年龄3~21 个月,平均年龄9.3±5.0 个月。选取同期住院的支气管肺炎患儿30 例作为支气管肺炎组,男17 例,女13 例,年龄3~24 个月,平均9.5±5.5 个月。三组患儿均符合《诸福棠实用儿科学》诊断标准[9],且均排除支气管肺发育不良,肝、心、肾疾病及寄生虫感染史。另选取同期在外科住院的睾丸鞘膜积液、腹股沟斜疝、脐疝、并指畸形等非感染患儿26 例为对照组,男15 例,女11 例,年龄3~12 个月,平均8.3±2.3 个月。纳入本研究的所有儿童采血前2 个月内均未接受过糖皮质激素或免疫抑制剂、抗凝药物治疗;4 组儿童年龄、性别比较差异无统计学意义(P>0.05),具有可比性。该研究已通过我院医学伦理委员会同意和批准,并获得患儿家长知情同意。
1.2 主要试剂及仪器CD61-FIFC 为异硫氰荧光标记的抗活化GPma 的单抗( 美国BeetonDicklon 公司);CD62P-PE 为藻红素标记的抗P- 选择素单抗(美国BeetonDicklon 公司);同型对照鼠抗人IgG1-FITC、IgG1-PE 单克隆抗体购自美国BD 公司;CD44 检测试剂盒(美国R&D 公司);流式细胞仪(FACSClibur,美国BD 公司)。
1.3 全血中CD62P 水平的检测入院第2 天清晨空腹采集毛支炎发病期组、支气管肺炎组、对照组患儿外周静脉血4 mL,入院后第5~7 天清晨空腹采集毛支炎恢复期组患儿外周静脉血4 mL,其中2 mL 新鲜全血注入1 : 9的枸椽酸纳抗凝的真空采血管中,用于检测外周血中活化血小板的表达。取试管加入20 μmol/LADP(SIGMA 公司)50 μL、450 μL 全血,37 ℃水浴5 min 立即染色。取流式专用管4 支,在各管中分别加入5 μL 抗凝混匀全血;在各管中顺序加入IgG1-FITC 20 μL+IgG1-PE 20 μL,CD61-FITC20 μL+IgG1-PE 20 μL,CD62P-PE 20 μL+IgG1-FITC20 μL 和CD61-FITC 20 μL+CD62P-PE 20 μL。室温下避光孵育15~25 min 后加1 mL PBS(含1% 多聚甲醛)混匀,置于4~8℃冰箱,2 h 内上机检测并对结果进行分析。以CD61-FITC 和侧散射光散点图设血小板门,同型对照设定阴性群体,进一步再用CD62P-PE 单克隆抗体技术测定CD62P 表达百分率,结果以C62+CD61+/CD61+×100% 表示。
1.4 血清CD44 水平的检测另2 mL 静脉血以3 000 转/min 离心15 min,分离上层血清,-80℃冻存。血清黏附分子CD44浓度的检测采用ELISA 法,具体操作步骤按照试剂盒说明书进行。
1.5 统计学分析采用SPSS 17.0 统计软件对数据进行统计学分析。计量资料以均数± 标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验。相关性分析采用Pearson 相关分析,P<0.05 为差异有统计学意义。
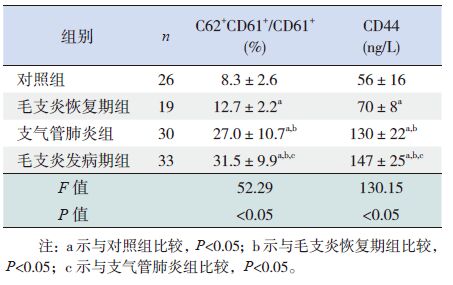
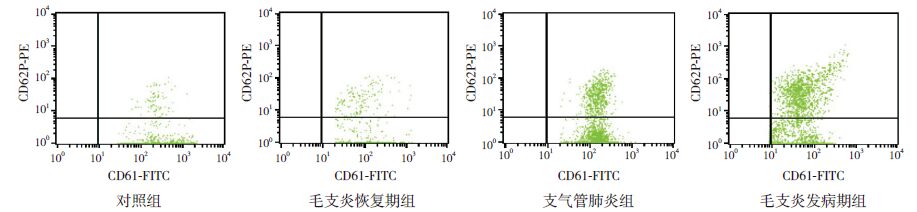
2 结果 2.1 各组外周血中的CD62P 和CD44 水平测定结果毛支炎发病期组CD62P 和CD44 水平显著高于毛支炎恢复期组、支气管肺炎组及对照组(P<0.05);毛支炎恢复期组CD62P 和CD44 的水平仍高于对照组(P<0.05)。见图 1、表 1。
|
图 1 流式细胞术检测各组患儿外周血CD62+CD61+ 细胞占CD61+ 细胞的百分比 图中右上象限所指部分代表CD62+CD61+ 细胞。 |
|
|
表 1 4 组患儿外周血活化血小板CD62P 阳性表达率及血清CD44 水平的比较 (x±s) |
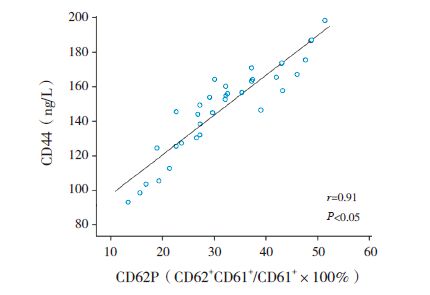
毛支炎发病期患儿外周血中黏附分子CD62P百分比与血清CD44 的水平呈正相关(r=0.91,P<0.05),见图 2。
|
图 2 毛支炎发病期患儿CD62P 与CD44 的相关性分析 |
毛支炎是一种婴幼儿时期首次以喘息发作为临床表现的疾病。其发病机制仍未完全清楚,有研究提示毛支炎患儿存在免疫功能失调[10, 11, 12]。细胞黏附分子[12] 是一大类位于细胞膜表面的糖蛋白分子,在机体免疫调节、免疫病理反应、炎性反应过程中发挥重要作用。
CD62P是细胞黏附分子选择素家族成员之一,是介导血小板与内皮细胞及白细胞相互作用的关键黏附分子[13]。CD44 是一种细胞表面跨膜糖蛋白分子,是细胞黏附分子中的重要成员。CD62P 是目前所知的反映血小板活化与释放反应最特异性的标志物,其水平可代表血小板活化程度,同时它也是重要的炎症指标[14]。血小板活化后可产生、释放如5-HT、PAF、TXA2、VCAM-1、ICAM-1、IL-8 等多种炎性介质,它们都不同程度地参与气道炎症反应和引起支气管平滑肌收缩,参与支气管哮喘的发病过程。以血小板活化因子PAF 的作用显著,它可诱发哮喘,具有较强的致支气管痉挛作用,其导致气道收缩的作用较组织胺等炎症介质的作用更为强大,能够引起支气管的持续痉挛。Johansson 等[15] 和Benton 等[16] 的研究均证实在支气管哮喘中存在CD62P 过度表达,它可介导活化血小板与嗜酸性粒细胞于肺组织聚集加剧炎症反应。CD44 可促进炎性细胞向炎症部位聚集,通过介导细胞与细胞、细胞与基质之间的特异性粘连,刺激多种细胞增生和基质合成,增高气道反应性,促进炎症细胞,尤其在促使嗜酸粒细胞和淋巴细胞聚集于肺部,活化并释放如IL-4、IL-5和IL-13 等Th2 型细胞因子,从而参与哮喘的发病[17]。CD44 作为哮喘发生的前炎症因子透明质酸及基质金属蛋白酶-9 的受体,在免疫反应中具有重要作用。李羚等[18] 研究证实哮喘大鼠肺组织CD44 存在过度表达,与炎性细胞向哮喘气道炎症组织趋化浸润密切相关。黏附分子CD62P、CD44可引起嗜酸粒细胞和淋巴细胞于病灶中聚集,释放不同炎症介质产生非特异性炎症反应,以不同的黏附机制参与哮喘发病过程。本研究发现毛支炎患儿CD62P、CD44 水平较对照组显著增高,与支气管哮喘患儿相似。提示黏附分子CD62P 及CD44 可能以与支气管哮喘相同或相似的作用机制介导大量炎性细胞在毛支炎患儿肺部炎症病灶中聚集,产生非特异性炎症反应参,作为炎症分子基础参与或介入毛支炎的发生和发展。根据本结果进一步推断,非特异性炎症在毛支炎的发生、发展中发挥较大作用。本研究还发现在毛支炎和支气管肺炎患儿CD62P 水平显著增高,CD62P 增高提示血小板活化增多,机体处于高凝状态,可视为血栓前状态。毛支炎发病期患儿黏附分子CD62P、CD44 显著高于恢复期患儿,进一步提示二者可作为检测其炎症反应程度的一种指标,其水平高低可反映毛支炎炎症反应严重程度。有研究表明CD62P[19] 及CD44[20] 与过敏性疾病有关,本研究发现毛支炎发病期患儿CD62P 及CD44 表达高于肺炎组,这可能与毛支炎患儿中部分具有特应性体质有关,有待进一步研究证实。研究CD62P 和CD44 与毛支炎的关系,理论上认为两者是气道变应性炎症疾病的一个潜在治疗靶点、应用CD62P、CD44 的黏附阻断剂治疗毛支炎对减轻临床症状或阻止其向哮喘进一步发展具有重要意义,为毛支炎及哮喘的治疗提供新靶点。
| [1] | 刘晓梅, 崔振泽. 毛细支气管炎与哮喘相关性的研究进[J]. 医学综述, 2011, 17(5): 738-741. |
| [2] | 刘传合, 陈育智. 儿童哮喘流行病学及防治现状分析[J]. 中国实用儿科杂志, 2013, 28(11): 809-811. |
| [3] | 吴福玲, 冯学斌, 李营营. 毛细支气管炎与哮喘豚鼠淋巴液和血浆Th1/Th2的改变及其意义[J]. 现代免疫学, 2010, 5(30): 424-427. |
| [4] | Johansson MW. Activation states of blood eosinophils in asthma[J]. Clin Exp Allergy, 2014, 44(4): 482-498. |
| [5] | Tamagawa-Mineoka R. Important roles of platelets as immune cells in the skin[J]. J Dermatol Sci, 2015, 77(2): 93-101. |
| [6] | Nasti TH, Bullard DC, Yusuf N. P-selectin enhances growth and metastasis of mouse mammary tumors by promoting regulatory T cell infiltration into the tumors[J]. Life Sci, 2015, 131(10): 11-18. |
| [7] | Bielinski SJ, Berardi C, Decker PA, et al. P-selectin and subclinical and clinical atherosclerosis: the Multi-Ethnic Study of Atherosclerosis (MESA)[J]. Atherosclerosis, 2015, 240(1): 3-9. |
| [8] | Johansson MW, Han ST, Gunderson KA, et al. Platelet activation, P-selectin, and eosinophil β1-integrin activation in asthma[J]. Am J Respir Crit Care Med, 2012, 185(5): 498-507. |
| [9] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7 版. 北京: 人民卫生出版社, 2002: 1175-1201. |
| [10] | Sommer W, Knöfel AK, Madrahimov N, et al. Allogeneic CD4+CD25high T cells regulate obliterative bronchiolitis of heterotopic bronchus allografts in both porcinized and humanized mouse models[J]. Transplantation, 2015, 99(3): 482-491. |
| [11] | Brand HK, Ferwerda G, Preijers F, et al. CD4+T-cell counts and interleukin-8 and CCL-5 plasma concentrations discriminate disease severity in children with RSV infection[J]. Pediatr Res, 2013, 73(2): 187-193. |
| [12] | Pardo J, Panizo A, Sola I, et al. Prognostic value of clinical, morphologic, and immunohistochemical factors in patients with bronchiolitis obliterans-organizing pneumonia[J]. Hum pathol, 2013, 44(5): 718-724. |
| [13] | Ezzelarab MB, Liu YW, Lin CC, et al. Role of P-selectin and P-selectin glycoprotein ligand-1 interaction in the induction of tissue factor expression on human platelets after incubation with porcine aortic endothelial cells[J]. Xenotransplantation, 2014, 21(1): 16-24. |
| [14] | Rosencher J, Zuily S, Varenne O, et al. Acute myocardial infarction secondary to platelet apheresis in a 57-year healthy donor[J]. Int J Cardiol, 2011, 150(3): 119-120. |
| [15] | Johansson MW, Han ST, Gunderson KA, et al. Platelet activation, P-selectin, and eosinophil β1-integrin activation in asthma[J]. Am J Respir Crit Care Med, 2012, 185(1): 498-507. |
| [16] | Benton AS, Kumar N, Lerner J, et al. Airway platelet activation is associated with airway eosinophilic inflammation in asthma[J]. J Investig Med, 2010, 58(8): 987-990. |
| [17] | Yang C, Liang H, Zhao H, et al. CD44 variant isoforms are specifically expressed on peripheral blood lymphocytes from asthmatic patients[J]. Exp Ther Med, 2012, 4(1): 79-83. |
| [18] | 李羚, 杨莉, 唐珩, 等. 黏附分子CD44在哮喘气道炎症反应中的作用[J]. 中国当代儿科杂志, 2009, 11(2): 142-145. |
| [19] | Pitchford SC. Defining a role for platelets in allergic inflammation[J]. Biochem Soc Trans, 2007, 35(Pt 5): 1104-1108. |
| [20] | Bartemes KR, Iijima K, Kobayashi T, et al. IL-33-responsive lineage- CD25+ CD44(hi) lymphoid cells mediate innate type 2 immunity and allergic inflammation in the lungs[J]. J Immunol, 2012, 188(3): 1503-1513. |
 2015, Vol. 17
2015, Vol. 17