近年来,随着婴幼儿先天性心脏病(简称先心病)手术数量的逐渐增加,先心病术后并发症也显著增多,严重影响患儿的康复过程[1]。其中,呼吸机相关性肺炎(ventilator-associated pneumonia,VAP)是其常见的术后并发症之一。VAP 是指机械通气时间超过48 h 或脱离呼吸机时间不足48 h新发的肺部感染[2]。先心病患儿术后大多需使用呼吸机辅助通气直至恢复自主呼吸,但由于基础疾病较重、营养不良、自身抵抗力下降、多合并肺部感染等原因,另外术中插管、建立体外循环及抗生素使用不当等,使得先心病患儿在机械通气过程中更容易发生VAP,导致上机时间延长,严重者甚至危及生命[3]。因此,本研究通过对我院2012 年1 月至2014 年12 月由胸心外科行先心病手术且术后机械通气时间超过48 h 的312 例患儿的临床资料进行回顾性分析,探讨先心病术后VAP 的病原菌分布、耐药性特点及危险因素,以期为先心病术后VAP 的防治提供临床依据。
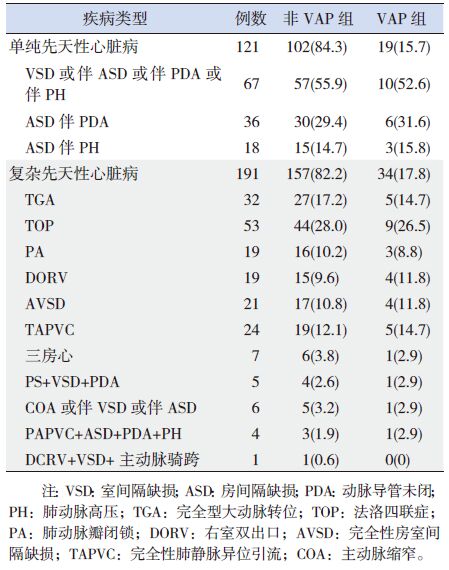
1 资料与方法 1.1 临床资料选取2012 年1 月1 日至2014 年12 月30 日,于本院胸心外科行小儿先心病外科手术,术后转入儿童重症监护病房(PICU)给予呼吸机通气治疗,且机械通气时间>48 h 的312 例患儿作为研究对象。根据患儿术后是否发生VAP 将其分为VAP组与非VAP 组,其中,VAP 组53 例,男29 例,女24 例,入院年龄0.2~10.0 岁,平均年龄2.2±2.0 岁,体重5~33 kg,平均体重16±4 kg;非VAP组259 例,男153 例,女106 例,年龄0.3~11.2 岁,平均年龄2.4±1.9 岁,体重5~36 kg,平均体重17±5 kg。小儿先心病类型主要包括单纯性及复杂性先心病(表 1)。两组患儿在年龄、体重及先心病类型等方面比较差异均无统计学意义(P>0.05)。
|
|
表 1 VAP 及非VAP 组患儿先心病类型组成 [ 例(%)] |
VAP 的诊断标准依据中华医学会2013 年制定的《医院获得性肺炎诊断、预防和治疗指南》[4]:(1)使用呼吸机辅助呼吸≥ 48 h 或脱机≤ 48 h;(2)胸片检查提示肺部出现新发或进行性扩大的肺部浸润阴影;(3)肺部听诊可闻及湿罗音;(4)体温升高(>38℃),呼吸道出现脓性分泌物;(5)外周血象指标,白细胞>10.0×109/L 或 <4.0×109/L;(6)微生物学检测,呼吸道分泌物培养出新的病原菌。
1.3 病原菌检查机械通气时间>48 h 后,采用一次性吸痰管在无菌条件下通过气管导管吸取下呼吸道分泌物,放置于无菌管中,30 min 内送检行病原菌培养及相关药物敏感试验。
1.4 观察指标采取回顾性分析的方法,收集VAP 与非VAP组患儿流行病学及住院期间临床观察指标,包括性别、白蛋白水平、术前抗生素应用情况、机械通气时间、插管次数、镇痛时间、先心病类型、体外循环时间、主动脉阻断时间及是否使用H2 受体抑制剂等,并比较两组间的差异。
1.5 疗效评判标准患者的临床症状及体征、实验室及病原学检查均恢复正常,则评定为痊愈;患者的临床症状和体征均得到显著改善,咳嗽和咯痰显著减少,痰量在每天10 mL 以下,具有较清晰的呼吸音,有少量干湿罗音存在于肺部,则评定为好转[5]。
1.6 统计学分析使用SSPS 17.0 统计软件对数据进行统计学分析,计量资料采用均数± 标准差(x±s)表示,两组间比较采用t 检验;计数资料采用百分率或构成比(%)表示,两组间比较采用χ2 检验;采用多因素logistic 回归,分析先心病术后VAP 发生的危险因素。P<0.05 为差异有统计学意义。
2 结果 2.1 VAP 的发生率按照VAP 的诊断标准,312 例机械通气时间超过48 h 的患儿中,53 例发生VAP,VAP 的发病率为17.0%。
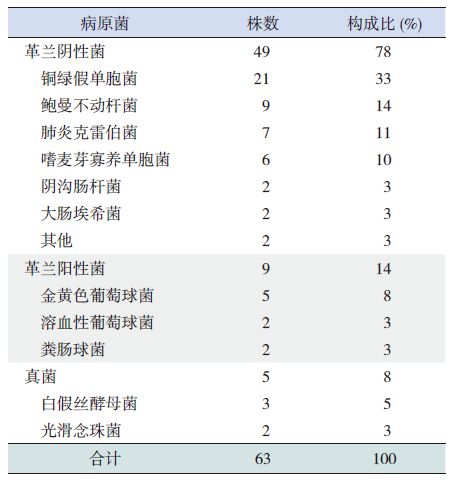
2.2 VAP 患儿病原菌分布53例VAP 患儿的痰培养阳性者51 例,阳性率为96%。其中共培养出阳性菌株63 株,有7 例患儿的标本中同时培养出2 种细菌,2 例患儿的标本中同时培养出3 种细菌,1 例患儿的标本中同时分别培养出1 种细菌和真菌。患儿多重菌感染率为20%。主要致病菌为革兰阴性菌(49 株,78%),其中铜绿假单胞菌的检出率为33%(21/63)、鲍曼不动杆菌为14%(9/63)、肺炎克雷伯杆菌为11%(7/63)、嗜麦芽寡养单胞菌为10%(6/63),另检出阴沟肠杆菌和大肠埃希菌各2 株,其他2 株。检出革兰阳性菌9 株(14%),以金黄色葡萄球菌为主(5 株),另检出溶血性葡萄球菌及粪肠球菌各2 株。检出真菌5 株,其中白色假丝酵母菌3 株,光滑念珠菌2 株。见表 2。
|
|
表 2 53 例VAP 患儿63 株病原菌分布构成比 |
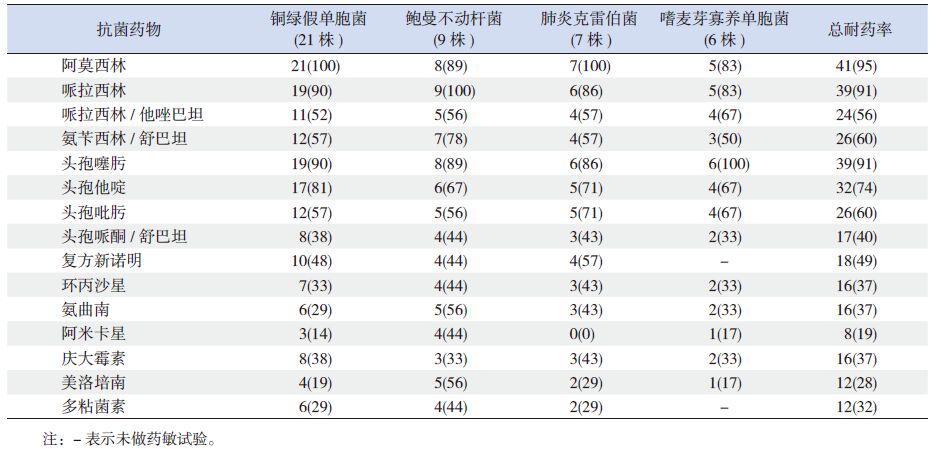
本研究中,先心病术后VAP 致病菌主要以革兰阴性菌为主,其中,铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌及嗜麦芽寡养单胞菌为最常见的4 种VAP 革兰阴性菌病原菌。所检出的4 种主要革兰阴性菌对β- 内酰胺类抗生素包括阿莫西林、哌拉西林、头孢噻肟及头孢他啶等耐药率较高(总耐药率均>74%);对阿米卡星、多粘菌素及美洛培南较敏感(总耐药率为19%~32%)(表 3)。本研究中,9 株革兰阳性菌株主要以金黄色葡萄球菌为主,其对青霉素、复方磺胺、阿莫西林/ 克拉维酸钾及红霉素耐药性较高;对万古霉素均敏感。本研究中,共分离出5 株真菌,主要包括白假丝酵母菌和光滑念珠菌,其对5- 氟胞嘧啶、两性霉素B、伊曲康唑、氟康唑等常用抗真菌药物均敏感。
|
|
表 3 主要革兰阴性菌的耐药性分析 [ 株(%)] |
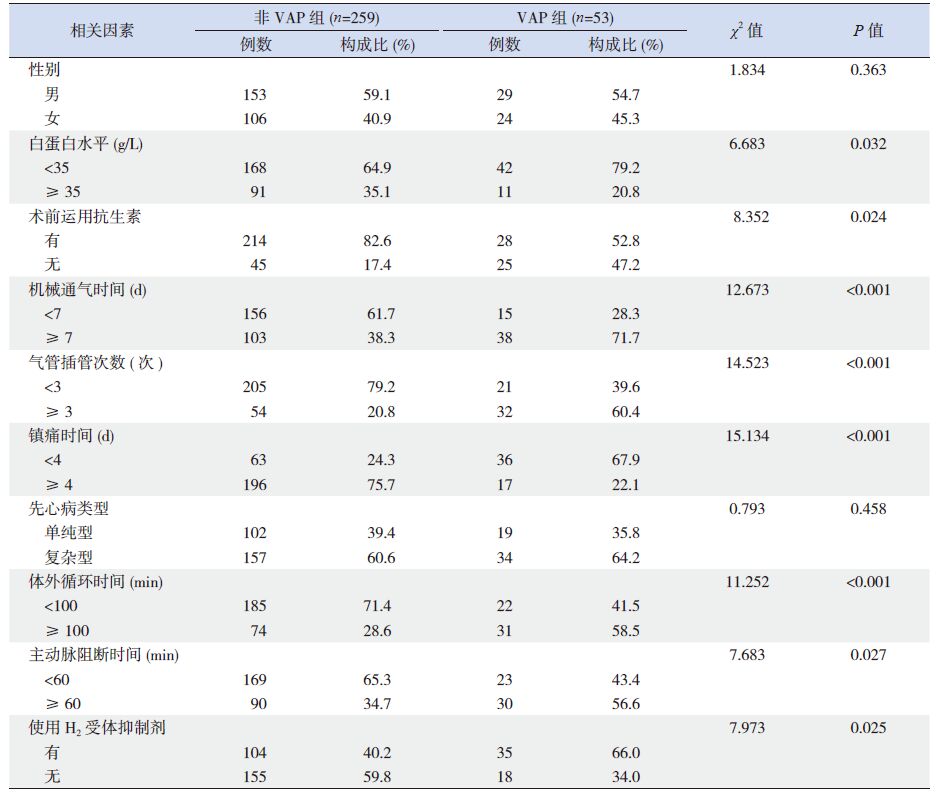
对非VAP 组与VAP 组进行单因素χ2 检验分析,结果提示先心病术后VAP 的发生与白蛋白水平、术前抗生素使用情况、机械通气时间、插管次数、镇痛时间、体外循环时间、主动脉阻断时间及是否使用H2 受体抑制剂有关,两组间比较差异有统计学意义(P<0.05);而VAP 组患儿性别、先心病类型与非VAP 组患儿相比差异无统计学意义(P>0.05)。见表 4。
|
|
表 4 VAP 发生危险因素单因素分析 [ 例(%)] |
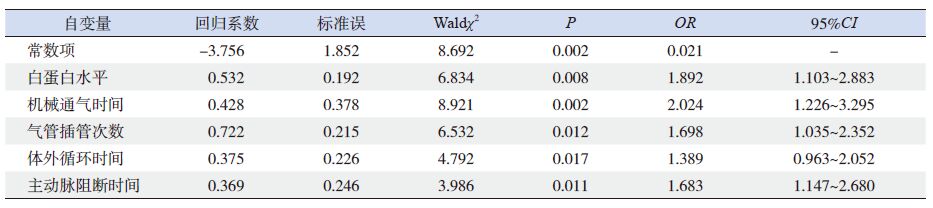
以VAP 为因变量,上述8 个差异具有统计学意义的相关危险因素为自变量,通过多因素logistic 回归分析,结果显示白蛋白水平 <35 g/L、机械通气时间≥ 7 d、插管次数≥ 3 次、体外循环时间≥ 100 min 及主动脉阻断时间≥ 60 min 为先心病患儿术后VAP 发生的独立危险因素(P<0.05),而患儿有无术前抗生素使用情况、镇痛时间及是否使用H2 受体抑制剂不是VAP 发生的独立危险因素,见表 5。
|
|
表 5 PICU 患儿发生VAP 危险因素的logistic 回归分析 |
先心病术后VAP 组PICU 住院时间(16.8±4.8 d)显著长于非VAP 组(7.3±2.4 d)(t=8.46,P<0.05)。53 例VAP 患儿治愈40 例,好转6 例,死亡7 例,病死率为13.2%。259 例非VAP 患儿治愈231 例,好转22 例,死亡6 例,病死率为2.3%。VAP 组病死率显著高于非VAP 组,差异有统计学意义(χ2=8.72,P=0.026)。
3 讨论先心病是常见的导致婴幼儿死亡的重要原因之一。近年来,随着先心病诊疗水平的不断提升及机械通气的广泛应用,早期手术治疗先心病成为了临床工作的必然趋势,极大的提高了先心病患儿的存活机率[6]。然而先心病患儿异常的血流动力学常影响其呼吸功能,极易合并肺部感染;加之营养不良及免疫力低下等自身不利因素,以及气管插管、建立体外循环、使用广谱抗生素等,使得先心病患儿术后VAP 的发生显著升高[7]。
目前,VAP 已成为机械通气过程中最常见的并发症之一,同时也逐渐成为先心病术后患儿发生医院内感染的主要因素[8]。由于先心病患儿一般状况、手术体外循环时间及机械通气时间等相关因素的不同,患儿先心病术后VAP 致病菌也存在显著差异[9]。在本研究中,主要致病菌为革兰阴性菌,其中铜绿假单胞菌、鲍曼不动杆菌、肺炎克雷伯菌及嗜麦芽寡养单胞菌比例较高。相关研究显示,VAP 病原菌对抗生素的耐药性逐年升高,其中对广谱青霉素及头孢类抗生素耐药率在75%以上[10]。本研究中VAP 耐药率最高的抗菌药物主要是阿莫西林、哌拉西林、头孢噻肟及头孢他啶。其中,氨曲南、环丙沙星药物敏感性也明显降低,其原因可能与近年来临床上的广泛运用,导致耐药性升高有关。
本研究选取性别、白蛋白水平、术前抗生素应用、机械通气时间、插管次数、镇痛时间、先心病类型、体外循环时间、主动脉阻断时间及使用H2 受体抑制剂等作为先心病术后发生VAP 的可能危险因素进行单因素分析,结果提示VAP 的发生与白蛋白水平、术前抗生素使用情况、机械通气时间、插管次数、镇痛时间、体外循环时间、主动脉阻断时间及使用H2 受体抑制剂具有明显的相关性。logistic 回归分析结果提示白蛋白水平、机械通气时间、插管次数、体外循环时间及主动脉阻断时间是先心病术后VAP 的独立危险因素。有研究显示,营养不良患儿,白蛋白水平低下,其机体免疫及防御能力功能不足,常是导致VAP发生的重要危险因素之一[11]。气管插管属于侵入性操作,容易损伤咽喉部,破坏气道的生理防御屏障,使上呼吸道自然防御能力破坏,失去滤过功能,从而使寄植于口咽部的细菌通过气道进入肺内繁殖,促进了VAP 的发生。特别是机械通气时间越长,插管次数越多,越容易引起VAP 的发生[12]。先心病术后的患儿一般要常用吗啡等镇痛药及肌松药,这也造成气道分泌物排出困难,增加了VAP 发生的风险。有研究证实,体外循环及主动脉阻断时间越长,会延长术后机械通气时间,从而间接增加了VAP 发生的风险[13]。先心病术后常预防性的给予H2 受体抑制剂防治应激性溃疡,但同时也使胃酸分泌减少,可造成胃内大量细菌定植,通过呼吸道引起VAP 的发生率增加[14]。因此,对于先心病VAP 患儿需加强全身营养支持治疗,术前预防性给予抗生素,密切监测患儿感染指标,加强呼吸道管理,避免反复插管,尽早结束机械通气,恢复自主呼吸,同时手术过程应该尽量缩短体外循环及主动脉阻断时间,减少VAP 的发生风险。
综上所述,先心病患儿术后VAP 的发生受多种因素的影响,同时其致病菌主要以革兰阴性菌为主,耐药性普遍较高,临床上,应根据药敏试验结果合理选用抗生素,同时针对危险因素采用综合的防治措施,从而有效的降低先心病患儿术后VAP 的发生率。
| [1] | Su F, El-Komy MH, Hammer GB, et al. Population pharmacokinetics of etomidate in neonates and infants with congenital heart disease[J]. Biopharm Drug Dispos, 2015, 36(2): 104-114. |
| [2] | Willson DF. Outcomes and risk factors in pediatric ventilator-associated pneumonia: guilt by association[J]. Pediatr Crit Care Med, 2015, 16(3): 299-301. |
| [3] | Holloway AJ, Spaeder MC, Basu S, et al. Association of timing of tracheostomy on clinical outcomes in PICU patients[J]. Pediatr Crit Care Med, 2015, 16(3): e52-e58. |
| [4] | 管向东, 刘紫锰. 2013《呼吸机相关性肺炎诊断、预防和治疗指南》——目标性治疗的解读[J]. 中华医学杂志, 2014, 94(5): 333-334. |
| [5] | Guillamet CV, Kollef MH. Update on ventilator-associated pneumonia[J]. Curr Opin Crit Care, 2015, 21(5):430-438. |
| [6] | 马超, 沈定荣, 张青, 等. 自体冷血停搏液对紫绀型先心病婴儿心脏的保护作用[J]. 中国当代儿科杂志, 2013, 15(6): 453-457. |
| [7] | 杨轶男, 董湘玉, 常欲晓, 等. 左向右分流型先天性心脏病患儿肺功能相关研究[J]. 临床儿科杂志, 2012, 30(8): 724-726. |
| [8] | Matsuno AK, Carlotti AP. Role of soluble triggering receptor expressed on myeloid cells-1 for diagnosing ventilator-associated pneumonia after cardiac surgery: an observational study[J]. BMC Cardiovasc Disord, 2013, 13: 107. |
| [9] | Tang CW, Liu PY, Huang YF, et al. Ventilator-associated pneumonia after pediatric cardiac surgery in southern Taiwan[J]. J Microbiol Immunol Infect, 2009, 42(5): 413-419. |
| [10] | 陈晓飒, 张晨美, 宁铂涛. PICU呼吸机相关性肺炎深部痰液病原菌分布与耐药性分析[J]. 中国小儿急救医学, 2014, 21(8): 504-507. |
| [11] | Seligman R, Seligman BG, Teixeira PJ. Comparing the accuracy of predictors of mortality in ventilator-associated pneumonia[J]. J Bras Pneumol, 2011, 37(4): 495-503. |
| [12] | Carron M, Rossi S, Carollo C, et al. Comparison of invasive and noninvasive positive pressure ventilation delivered by means of a helmet for weaning of patients from mechanical ventilation[J]. J Crit Care, 2014, 29(4): 580-585. |
| [13] | 张德双, 陈超, 周伟, 等. 新生儿呼吸机相关性肺炎病原菌及危险因素分析 [J]. 中国当代儿科杂志, 2013, 15(1): 14-18. |
| [14] | Hashemzadeh K, Hashemzadeh S. Predictors and outcome of gastrointestinal complications after cardiac surgery[J]. Minerva Chir, 2012, 67(4): 327-335. |
 2015, Vol. 17
2015, Vol. 17