支气管哮喘(bronchial asthma)是儿童常见的气道慢性炎症性疾病之一,常表现为易反复、难控制和慢性持续的临床特点[1]。据全国第三次城市儿童哮喘流行病学调查结果显示,主要城市城区儿童哮喘总患病率为3.02%,2 年现患率为2.32%,儿童哮喘患病率整体呈现逐年上升的趋势,以北京为例,1990~2010 年的20 年间,北京0~14 岁儿童哮喘累积患病率从0.88% 上升至3.68%[2, 3, 4]。全球哮喘防治创议(GINA)中对于儿童哮喘的治疗已经明确强调要进行“药物治疗、过敏原规避、特异性免疫治疗、患者疾病教育”四维一体的综合治疗方案,其中特异性免疫治疗(specificimmunotherapy,SIT)被认为是唯一能改变过敏性哮喘自然进程的疗法,即通过注射逐渐递增剂量的过敏原疫苗,使哮喘患者再次接触过敏原不再出现过敏症状同时不产生新的致敏原的目的[5]。
目前临床常用的SIT 途径多为皮下注射(皮下特异性免疫治疗,SCIT),但由于SCIT 操作为注射式,必须在医院内进行,且易引发全身性不良反应,对患者依从性要求较高,大大限制了其临床应用的开展。而作为一种安全性更高、耐受性更好的非注射式的舌下免疫治疗途径(SLIT),可达到与SCIT 相似的治疗效果,而被逐渐应用在儿科学领域[6]。对于SLIT 的临床免疫学机制的研究发现,与SCIT 相似,SLIT 也可通过建立以调节性T 细胞(regulatory T cell,Treg 细胞)为中心事件的免疫耐受机制,但是由于SLIT 接种所处位置以及黏膜局部免疫特点,决定着其在诱导抑制性Treg 细胞功能的实现机制上可能会与SCIT 方式有所差异[7]。因此,本研究不仅对不同免疫治疗途径对哮喘患儿体内Treg 细胞水平这一细胞免疫应答反应差异进行了比较,另一方面也对不同免疫治疗途径引发的哮喘患儿体液免疫应答差异进行了初步比较,希望能够对于儿童SIT 的免疫耐受机制产生更深入的理解。
1 资料与方法 1.1 研究对象研究对象为自2012 年2 月至2013 年10 月在北京儿童医院过敏反应科诊断为尘螨致敏的轻、中度支气管哮喘患儿共计86 例(男性63 例,女性23 例)。入组标准:(1)符合儿童哮喘诊断标准[8, 9];(2)年龄4~14 岁;(3)户尘螨或粉尘螨致敏阳性:经过敏原皮肤点刺试验结果为户尘螨致敏(2+)~(4+)和(或)血清尘螨特异性IgE(sIgE) 在0.35 KUA/L 以上;(4) 根据2008年儿童支气管哮喘诊断与防治指南[8, 9],将哮喘病情严重度分为轻、中度,将当前控制类药物治疗级别分为1 级、2 级或3 级;(5)结合体查及病史情况,患儿家长知情同意的基础上,自愿选择SCIT、SLIT 或常规药物治疗方案。
入组研究对象分为4 组:(1)SCIT 组:经皮下免疫治疗满1 年的哮喘患儿13 例(男8 例,女5 例,平均年龄8.1±2.8 岁);(2)SLIT 组:经舌下免疫治疗满1 年的哮喘患儿29 例(男22 例,女7 例,平均年龄9.0±2.0 岁);(3)结束SCIT 组:结束SCIT 足疗程3 年后停止治疗1 年以上的患儿14 例(男14 例,女0 例,平均年龄7.6±1.9 岁);(4)对照组:采用常规药物治疗方案治疗的哮喘患儿30 例(男19 例,女11 例,平均年龄7.5±2.7岁)。
本研究经首都医科大学附属北京儿童医院伦理委员会审核通过,研究前向患儿家长讲述本研究的目的和实施方案,征得患儿家长同意,并签署知情同意书。
1.2 尘螨特异性SCIT应用标准化户尘螨变应原提取液,皮下注射部位为上臂远端1/3 的外侧,治疗进程中左右上臂轮流注射。注射剂量以20 U 起始,起始治疗阶段按照以下治疗方案进行每周递增剂量:第1~3 周使用1 号瓶(剂量分别为20、40、80 U),第4~6周使用2 号瓶(剂量分别为200、400、800 U),第7~9 周使用3 号瓶(剂量分别为2 000、4 000、8 000 U),第10~15 周使用4 号瓶( 剂量分别为10 000、20 000、40 000、60 000、80 000、100 000 U),共计15 周(15 次注射)达到最高维持注射剂量即100 000 U,随后使用4 号瓶维持剂量阶段进行治疗注射,按每隔2、4 周各注射100 000 U 1 次,此后维持每6 周注射1 次维持剂量。治疗过程中,患儿每次的实际注射量应根据前次用量后是否发生速发及迟发反应进行调整。每次注射前根据患儿的近期症状、前次注射后发生的反应,评估当日是否适宜接受注射,注射后需留观30 min 并记录注射后的不良反应[10]。所有SCIT免疫治疗患儿的同时给予药物对症治疗,治疗方案依照2008 年儿童支气管哮喘诊断与防治指南制定[8, 9]。
1.3 尘螨特异性SLITSLIT 组舌下含服粉尘螨滴剂(浙江我武生物科技有限公司提供,商品名为畅迪)1~4 号且联合吸入糖皮质激素治疗。用药方法:将滴剂滴于舌下,含服1~3 min 后再吞咽,每日用药1 次,固定时间用药。第1、2、3 周分别使用滴剂1 号、2 号、3 号,其总蛋白浓度分别为1、10、100 μg/mL,剂量递增,每周第1~7 天依次服用1、2、3、4、6、8、10 滴;从第4 周开始使用滴剂4 号(总蛋白浓度333 μg/mL),每日服用3 滴[11]。SLIT 免疫治疗患儿同时给予药物对症治疗,治疗方案依照2008 年儿童支气管哮喘诊断与防治指南制定[8, 9]。
1.4 常规药物治疗方案根据2008 年儿童支气管哮喘诊断与防治指南[8, 9] 对患儿进行哮喘严重度分级和哮喘控制水平分级,制定哮喘长期治疗方案。
1.5 外周血Treg 水平测定从肝素钠抗凝静脉血中分离得到外周血单个核细胞(peripheral blood mononuclear cells,PBMC),用完全RPMI-1640 培养液将细胞配成适当浓度,约2×106/mL。将细胞分为3 组,分别加入不同浓度的屋尘螨蛋白浸液(Der p1:0 μg/mL、2.5 μg/mL、5 μg/mL)刺激,于37℃、5% CO2 培养箱继续培养48 h 后按照CD4+CD25+Foxp3+Treg 细胞流式分析试剂盒操作说明书加样处理细胞,并应用四色流式细胞分析仪完成测定(Treg 细胞流式分析系列试剂为eBioscience 公司产品,应用BD公司的BD FACSCanto Ⅱ流式细胞仪)。
1.6 尘螨sIgE 和IgG4 测定在治疗前、治疗后6 个月和治疗后12 个月3个时点,采用Unicap100 过敏原定量检测系统的荧光酶联免疫法(瑞典法玛西亚公司)测定SCIT 组和SLIT 组患儿血清中尘螨sIgE 和IgG4 水平。
1.7 临床指标评估在免疫治疗开始前,专人指导患儿及父母填写日记卡。分别在免疫治疗后6 个月、治疗后12 个月对SCIT 组和SLIT 组的哮喘及鼻炎症状计分、药物评分、哮喘控制测试(asthma control test,ACT)、肺功能检测以及VAS 评分,并与免疫治疗前进行比较。评分计算标准参考世界变态反应组织工作组文件中关于特异性免疫治疗的临床推荐意义以及中华耳鼻咽喉头颈外科学分会鼻科学组指定的免疫治疗评分标准[12, 13, 14]。
1.8 统计学分析应用SPSS 17.0 统计软件进行数据处理和分析。正态分布的计量资料用均数± 标准差(x±s)表示,多组间比较应用单因素方差分析;非正态分布的计量资料用中位数(范围)表示。对接受免疫治疗的每例研究对象同一评价指标(sIgE、sIgG4 以及临床指标)进行不同时间点(治疗前、治疗后6 个月、治疗后12 个月)的3 次重复测量,采用组间变化定量数据重复测量的方差分析,分析时间因素(免疫治疗后不同时点重复测量)、分组因素(患儿接受不同免疫治疗途径)及其交互作用的效应。P<0.05 表示差异有统计学意义。
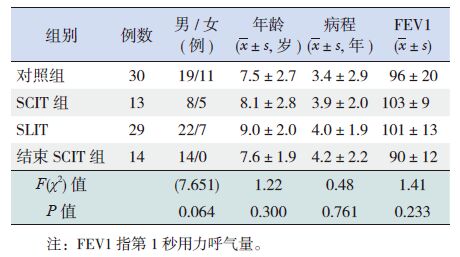
2 结果 2.1 各组患儿基本病史资料比较4组患儿基本病史资料进行比较,结果显示在性别、年龄、哮喘病程方面各组患儿间差异均无统计学意义(P>0.05);各组患儿采用最大呼气流量- 容积曲线测定患儿肺功能,结果显示差异无统计学意义(P>0.05)(表 1)。
|
|
表 1 4 组患儿的基本信息比较 |
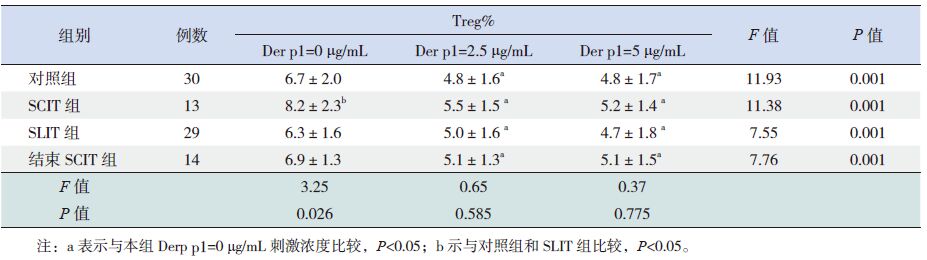
体外水平将各组患儿外周血中PBMC 分离后给予不同浓度Der p1 刺激,采用流式细胞术检测其中CD4+CD25+Foxp3+ Treg 细胞比例(Treg%)变化,结果显示:在未加入Der p1(0 μg/mL)基础状态下,SCIT 组Treg% 显著高于对照组和SLIT 组(P<0.05);未刺激基础状态下的SCIT 组Treg%与结束SCIT 组相比差异无统计学意义(P>0.05)。体外给予Der p1 刺激后,各组患儿的Treg% 均显著低于其未刺激基础状态Treg% 水平(P<0.05);Der p1 浓度由2.5 μg/mL 增加到5 μg/mL,各组内Treg% 水平差异均无统计学意义(P>0.05)(表 2)。
|
|
表 2 各组患儿PBMC 经不同Der p1 浓度刺激后CD4+T 细胞中Treg% 的比较 (x±s) |
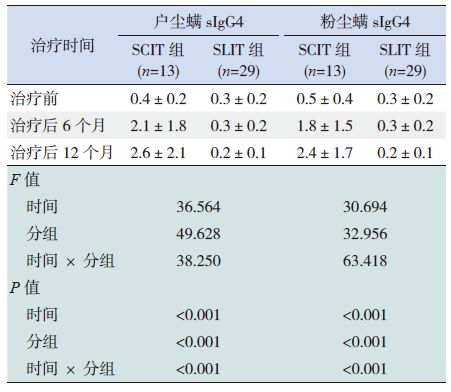
首先对SCIT 组、SLIT 组两组患儿接受免疫治疗后不同时间点(治疗前、治疗后6 个月、治疗后12 个月)的体液免疫学指标(sIgE、sIgG4)进行单因素(时间效应)重复测量的方差分析,评价两组体液免疫学指标随时间的变化情况,然后进行多因素重复测量的方差分析,评价分组效应及分组与时间的交互效应。单因素重复测量分析结果显示:接受免疫治疗前后的不同时间点,患儿的户尘螨sIgE、粉尘螨sIgE 水平随时间变化存在差异性(P<0.001);接受不同免疫治疗途径治疗的两组患儿的户尘螨sIgE 和粉尘螨sIgE 的水平差异亦有统计学意义(P<0.001)。进一步行多因素重复测量方差分析结果显示:患儿户尘螨sIgE 和粉尘螨sIgE 水平变化在SCIT 组和SLIT 组均存在时间因素与分组因素的交互作用(P<0.001)(表 3)。
|
|
表 3 SCIT 组和SLIT 组患儿尘螨sIgE 水平的比较(x±s,KUA/L ) |
对于sIgG4 指标而言,单因素重复测量分析结果显示:接受免疫治疗前后患儿的户尘螨sIgG4、粉尘螨sIgG4 水平随时间变化存在差异性(P<0.001),但是仅在SCIT 组患儿中户尘螨sIgG4 和粉尘螨sIgG4 水平随时间变化升高,差异有统计学意义(分别F=53.624、61.241,均P<0.05),而在SLIT 组中,户尘螨sIgG4 和粉尘螨sIgG4 水平未见随时间变化而变化(分别F=1.2384、2.314,均 P>0.05);接受不同免疫治疗途径治疗的两组患儿的户尘螨sIgG4 和粉尘螨sIgG4 水平差异亦有统计学意义(P<0.001)。进一步行多因素重复测量方差分析结果显示:患儿sIgG4 水平变化在SCIT 组和SLIT 组均存在时间因素与分组因素的交互作用(P<0.001)(表 4)。
|
|
表 4 SLIT 组和SCIT 组患儿尘螨sIgG4 水平的比较(x±s,KUA/L ) |
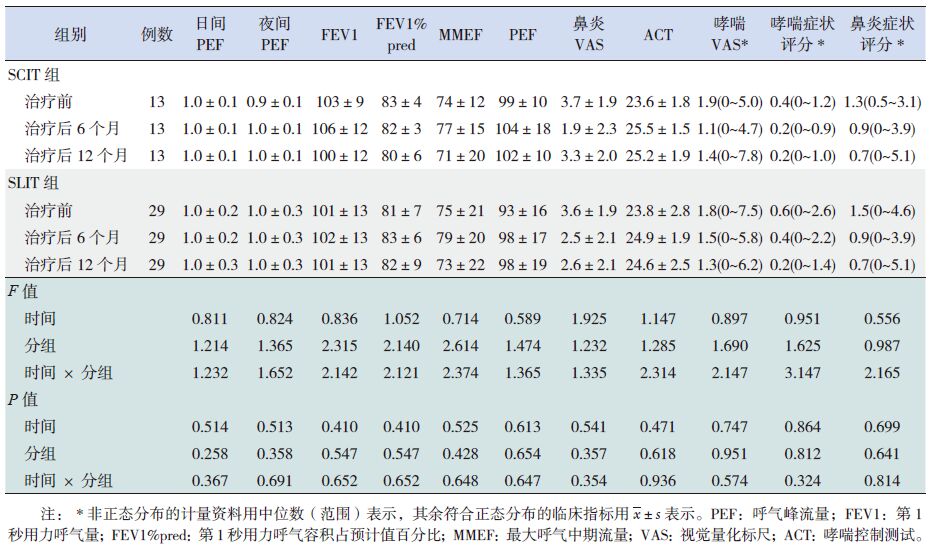
对不同免疫治疗途径患儿的临床疗效指标变化进行重复测量的方差分析结果显示:与治疗前相比,未发现临床指标的差异随时间变化具有统计学意义,且各临床指标在SCIT 组和SLIT 组间差异无统计学意义;进一步行多因素重复测量方差分析结果显示:测定时点与分组因素间不存在交互作用(表 5)。
|
|
表 5 SCIT 组和SLIT 组患儿在各随访时点临床指标的比较 |
SIT 可追溯到19 世纪末期,最初由Noon 和Freeman 用梯牧草花粉变应原浸液治疗花粉症获得成功,SIT 通过皮下注射剂量逐渐增加的过敏原,调整机体的免疫系统功能状态,最终使患者建立起过敏原特异性免疫耐受的目的[15, 16]。SLIT 是将一定剂量的过敏原滴在舌下利用口腔黏膜免疫系统进行过敏原的吸收递呈过程,与SCIT 相比,由于口腔黏膜含有较少数量的炎性细胞存在,在SLIT 过程中接受同等剂量的过敏原刺激后,释放的炎症介质相对较少,免疫治疗安全性更高[17, 18]。
对于SCIT 和SLIT 两种治疗途径在改善哮喘患者临床症状的疗效性已被多项研究证实[19, 20, 21, 22, 23]。尽管如此,对于SCIT 和SLIT 二者所引发的内在免疫学变化目前尚不完全清楚。因此本研究比较了SCIT 满1 年治疗、SLIT 满1 年治疗、结束SCIT足疗程3 年后停止治疗1 年以上以及常规药物治疗组哮喘患儿免疫学变化差异,发现在未给予抗原刺激的基础情况下,SCIT 治疗满1 年患儿外周血PBMC 中Treg% 显著高于对照组,但是同样经过相同治疗时长1 年期的SLIT 组患儿体内Treg%较对照组相比未见增高。进一步应用重复测量的方差分析不同免疫治疗途径组患儿体液免疫学指标变化发现:接受免疫治疗后不同时点,SCIT 组患儿其血清sIgE 和sIgG4 水平与治疗前相比差异均有统计学意义,而SLIT 组患儿仅sIgE 水平在免疫治疗后较治疗前相比差异有统计学意义,sIgG4水平未见随时间变化而变化。但SLIT 组和SCIT组患儿两组在接受治疗后,其临床指标并未发生明显变化,两组间比较也无明显不同。相似的现象在Autúnez 等[24] 开展的一项研究中也被发现,该项研究共入组户尘螨致敏的气道过敏性疾病儿童23 例,按照盲法、随机分配原则将其分为SCIT治疗组、SLIT 治疗组,连续随访至免疫治疗后2年期,比较不同免疫治疗时点、不同免疫治疗途径对于患儿体内免疫功能状态的影响,发现虽然不同免疫治疗途径在改善临床症状方面没有显著性差异,但是二者在引发患儿机体内免疫功能状态方面却存在明显差异:早在SCIT 开始后3 个月就可以观察到患者外周血中螨sIgG4 抗体水平升高,但是对于SLIT 组治疗近2 年时都未观察到此现象发生;进一步对细胞免疫应答反应分析发现,随着SCIT 免疫疗程的延续,SCIT 组患儿外周血中CD4+CD25+T 细胞亚群比例逐渐增加,而在SLIT中未发现此现象发生,研究人员推测这部分增加的CD4+CD25+T 细胞亚群,可能就是诱导出的Treg亚群。 本研究及Autúnez 等[24] 的研究结果提示:患者在接受经不同给药途径的免疫治疗后,其机体内出现的体液免疫应答和细胞免疫应答反应上可能存在较为明显的时间差异性,其中SCIT 免疫治疗途径可能在启动免疫治疗成功的关键性事件,如过敏原特异性的封闭抗体表达(sIgG4)或抑制性T 细胞亚群优势建立出现时间更早。本研究进一步将SCIT 组患儿体内Treg% 与结束满3 年足疗程SCIT 后停止治疗1 年以上患儿相比,虽然结束治疗组患儿体内Treg% 水平有所下降,但是两组间Treg% 差异无统计学意义,此现象提示:在结束SCIT 足疗程治疗后一段时间,Treg 细胞仍可保持在一定水平,继续发挥其外周免疫耐受的作用。这可能也在一定程度上解释了之所以在结束SCIT治疗后一段时间仍可发挥其改善患者临床症状的原因,这一点在气道过敏性疾病患者中更常见[25, 26]。
综上所述,本研究通过对不同免疫治疗途径(SCIT 和SLIT)引发哮喘患儿内在免疫学应答差异进行横向比较,结果发现:两种治疗途径在引发患儿机体内在免疫学变化方面上存在明显的时间差异性,其中SCIT 免疫治疗可能在诱发免疫耐受中心事件出现时间更早,提示在未来免疫治疗方案的设计优化工作中,应发挥SCIT 和SLIT 不同治疗途径在调节机体免疫功能上的各自优势,适当将SCIT 和SLIT 结合应用在免疫治疗的不同阶段,以期到达治疗效果与安全性兼顾的最终目的。与此同时,还需要注意的是本研究设计是针对不同个体进行不同免疫治疗途径治疗后的免疫功能变化的横断面比较研究,尚缺少对于治疗个体的连续动态监测,入组研究对象例数相对较少,因此在今后有必要设计并开展前瞻性“头对头”比较性临床研究,尽量排除其他非实验控制因素的干扰,为更加全面了解哮喘儿童免疫治疗的内在机制提供理论依据。
| [1] | Lambrecht BN, Hammad H. The immunology of asthma[J]. Nat Immunol, 2015, 16(1): 123-127. |
| [2] | 全国儿童哮喘防治协作组. 中国城区儿童哮喘患病率调查[J]. 中华儿科杂志, 2003, 41(2): 47-51. |
| [3] | 全国儿科哮喘协作组. 2000年与1990年儿童支气管哮喘患病率的调查比较[J]. 中华结核和呼吸杂志, 2004, 27(2): 112-116. |
| [4] | 全国儿科哮喘协作组. 中国疾病预防控制中心环境与健康相关产品安全所. 第三次中国城市儿童哮喘流行病学调查[J]. 中华儿科杂志, 2013, 51(10): 729-735. |
| [5] | Bousquet J, Lockey R, Malling HJ, et al. Allergen immunotherapy: therapeutic vaccines for allergic diseases. World Health Organization American academy of allergy, asthma and immunology[J]. Ann Allergy Asthma Immunol, 1998, 81(5 pt 1): 401-405. |
| [6] | Linkov G, Toskala E. Sublingual immunotherapy: what we can learn from the European experience[J]. Curr Opin Otolaryngol Head Neck Surg, 2014, 22(3): 208-210. |
| [7] | Steinke JW, Lawrence MG. T-cell biology in immunotherapy[J]. Ann Allergy Asthma Immunol, 2014, 112(3): 195-199. |
| [8] | 中华医学会儿科学会呼吸学组, 编辑委员会中华儿科杂志. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志, 2008,46(10): 745-753. |
| [9] | Brozek JL, Bousquet J, Baena-Caqnani CE, et al. Allergic Rhinitis and its Impact on Asthma (ARIA) guidelines: 2010 revision[J]. J Allergy Clin Immunol, 2010, 126(3): 466-476. |
| [10] | Blumberga G, Groes L, Dahl R. SQ-standardized house dust mite immunotherapy as an immunomodulatory treatment in patients with asthma[J]. Allergy, 2011, 66(2): 178-185. |
| [11] | 陈伯亚, 龙自铭, 黄燕君, 等. 舌下含服粉尘螨滴剂治疗单一和多重过敏变应性鼻炎患者的临床疗效评估[J]. 中华耳鼻咽喉头颈外科杂志, 2013, 48(7): 549-554. |
| [12] | Canoniea GW, Baena-Cagnani CE, Bousquet J, et al. Recommendations for standardization of clinical trials with allergen specific immunothempy for respiratory allergy. A statement of a World Allergy Organization (WAO) task force[J]. Allergy, 2007, 62(3): 317-324. |
| [13] | Casale TB, Canoniea GW, Bousquet J, et al. Recommendations for appropriate sublingual immunotherapy clinical trials[J]. J Allergy Clin Immunol, 2009, 124(4): 665-670. |
| [14] | 中华耳鼻咽喉头颈外科杂志编委会鼻科组,中华医学会耳鼻咽喉头颈外科学分会鼻科学组.变应性鼻炎特异性免疫治疗专家共识[J].中华耳鼻咽喉头颈外科杂志, 2011,46(12): 976-980. |
| [15] | Jutel M, Akdis M, Blaser K, et al. Mechanisms of allergen specific immunotherapy--T-cell tolerance and more[J]. Allergy, 2006, 61(7): 796-807. |
| [16] | Akdis CA, Blaser K, Akdis M. Mechanisms of allergen-specific immunotherapy[J]. Chem Immunol Allergy, 2006, 91: 195-203. |
| [17] | Jay DC, Nadeau KC. Immune mechanisms of sublingual immunotherapy[J]. Curr Allergy Asthma Rep, 2014, 14(11): 473. |
| [18] | Cavkaytar O, Akdis CA, Akdis M. Modulation of immune responses by immunotherapy in allergic diseases[J]. Curr Opin Pharmacol, 2014, 17: 30-37. |
| [19] | Abramson MJ, Puy RM, Weiner JM. Is allergen immunotherapy effective in asthma? A meta-analysis of randomized controlled trials [J]. Am J Respir Crit Care Med, 1995, 151(4): 969-974. |
| [20] | Abramson M, Puy R, Weiner J. Immunotherapy in asthma: an updated systematic review [J]. Allergy, 1999, 54(10): 1022-1041. |
| [21] | Abramson MJ, Puy RM, Weiner JM. Allergen immunotherapy for asthma[J]. Cochrane Database Syst Rev, 2000, (2): CD001186. |
| [22] | Abramson MJ, Puy RM, Weiner JM. Allergen immunotherapy for asthma[J]. Cochrane Database Syst Rev, 2003, (4): CD001186. |
| [23] | Calamita Z, Saconato H, Pelá AB, et al. Efficacy of sublingual immunotherapy in asthma: systematic review of randomized-clinical trials using the Cochrane Collaboration method [J]. Allergy, 2006, 61(10): 1162-1172. |
| [24] | Antúnez C, Mayorga C, Corzo JL, et al. Two year follow-up of immunological response in mite-allergic children treated with sublingual immunotherapy. Comparison with subcutaneous administration[J]. Pediatr Allergy Immunol, 2008, 19(3): 210-218. |
| [25] | Durham SR, Walker SM, Varga EM, et al. Long term clinical efficacy of grass-pollen immunotherapy[J]. N Engl J Med, 1999, 341(7): 468-475. |
| [26] | Bousquet J, Lockey RF, Malling HJ. Allergen immunotherapy: therapeutic vaccines for allergic diseases. A WHO position paper[J]. J Allergy Clin Immunol, 1998, 102(4 Pt 1): 558-562. |
 2015, Vol. 17
2015, Vol. 17