糖原累积病Ⅱ 型(glycogen storage diseasetype Ⅱ ,GSD Ⅱ ,MIM 232300)由荷兰病理学家Pompe 在1932 年首次报道,是一种少见的常染色体隐性遗传病,是由于酸性α- 葡萄糖苷酶(acid-α-D-glucosidase,GAA,MIM 606800)基因缺陷所致。GAA 是溶酶体中糖原降解所必需的酶,能够使低聚糖和糖原分解成葡萄糖。该酶缺乏或者缺陷时,糖原不能被分解,引起溶酶体的破坏,从而引起骨骼肌、心肌、肝脏等多种组织的损伤。临床可表现为肌肉无力、心肌肥大、心功能不全等症状,严重者可因呼吸循环衰竭而死亡[1]。其临床确诊需要进行酶活性测定、肌肉活检或基因检测[2]。
本研究中,我们对一对疑诊GSD Ⅱ的双胞胎姐妹的外周血GAA 活性进行了检测,采取聚合酶链式反应(polymerase chain reaction,PCR)扩增和直接测序的方法,对此两个患儿及其父母进行了GAA 基因的检测。两个患儿均携带有G1942A 的致病突变和G2214A 的疑似致病突变。本研究结果显示干血片法(dried blood spots,DBS)检测GAA活性可以作为GSD Ⅱ的筛查方法,继之进行GAA基因测序可以明确GSD Ⅱ患儿的基因诊断。
1 资料与方法 1.1 研究对象病例1,女,10 个月,因口周发青1.5 个月,反复咳嗽、流涕17 d,加重3 d 于2008 年11 月28 日入院。患儿为第2 胎第2 产,为双胎之大,足月正常产,出生时状况良好,10 个月仍不能独坐,不能翻身,抬头困难。其姐姐在14 个月时因“肺炎、脑瘫、先天性心脏病” 死亡。入院体查:体温36.5℃,心率170 次/min,呼吸 70 次/min。一般状态差,眼睑轻度水肿,面色晦暗,鼻腔内见黄白色分泌物,口周发绀,舌体肥大。心音低钝,节律规整,未及杂音。双肺可闻及散在喘鸣音、痰鸣音及湿罗音。肝肋下3 cm,质韧。双下肢肌力三级,肌张力低,腱反射未引出。辅助检查:血常规示白细胞(WBC)14.1×109/L(参考值 3.5~9.5×109/L)、淋巴细胞比例(LYN)37%(参考值 20%~50%)、中性粒细胞比例(GR)57.3%(参考值 40%~75%);血液生化示谷丙转氨酶(ALT)122 U/L(参考值 9~50 U/L)、谷草转氨酶(AST)82 U/L( 参考值 15~40 U/L)、肌酸激酶(CK)204 U/L(参考值 25~400 U/L);胸片示双肺纹理增多、紊乱,心影向两侧扩大(图 1);心脏超声示室间隔及左心室后壁呈向心性肥厚,心功能下降(射血分数38%);腹部超声示肝上界第5 肋间、肋下平脐,剑突下脐上1 cm。入院后临床初步诊断为支气管肺炎、心力衰竭,给予积极抗感染、强心、对症治疗。治疗24 h 后,患儿一般状态好转,心率降至124 次/min,呼吸40 次/min,排尿1 次,进乳2 次,面色红润,口周发绀缓解,心衰纠正。住院治疗1 周后,患儿肺部罗音减少,肝脏肋下未触及,心影无明显减小,补充临床诊断:糖原累积症Ⅱ型?,家属拒绝继续住院治疗,签字离院,出院随访。患儿12 个月时吞咽困难加重,14 个月时四肢不能动,15 个月时在家中死亡。

|
图 1 病例1 胸部正位片 示双肺纹理增多、紊乱,心影向两侧扩大。 |
病例2,女,10 个月,因咳嗽、流涕伴发热17 d 于2008 年11 月28 日入院。患儿为双胎之小,足月正常产,出生时状况良好,2 个月会抬头,3个月会翻身,但随后生长发育逐渐落后,10 个月不会坐,不会翻身,不能抬头。入院体查:体温36.8℃,心率100 次/min,呼吸26 次/min。舌肥大,可闻及散在干罗音及痰鸣音,以右肺为主。肝脏右肋下2 cm。双下肢肌力三级,肌张力低,腱反射未引出。辅助检查:血常规示WBC 9.5×109/L;血液生化示AST 134 U/L,ALT 91 U/L,CK 456 U/L;胸片示双肺纹理增强,以双下肺为主;心脏超声示双心室向心性肥厚,左心增大,心功能下降(射血分数44%);心电图示PR 间期缩短,QRS 波电压增高。临床诊断支气管肺炎,给予抗感染、对症、支持治疗。治疗1 周后,患儿肺部罗音基本消失,疑诊糖原累积症Ⅱ型,经家属要求,准予出院。患儿12 个月时,吞咽困难加重,14 个月时四肢少动,17 个月时在家中死亡。
1.2 外周血GAA 活性检测DBS 法收集患儿的外周血标本。GAA 活性测定参考文献[3]。打孔器取直径3 mm 的血片,置于深孔板内,加入360 μL 超纯水,震板仪上震荡1 h,充分洗脱,取50 μL,加入10 μL 80 μmol/L的阿卡波糖(pH 3.8,用40 mmol/L 醋酸钠缓冲液配制)及40 μL 70 mmol/L 的4- 甲基伞型酮-α-D-吡喃葡萄糖苷液(4-MUG),37℃下作用20 h,加入200 μL EDTA 缓冲液(pH 11.3,0.15 mol/L)。于免疫荧光检测仪下扫描荧光强度,每组均设空白对照。
1.3 GAA 基因检测取两个患儿及其父母的静脉EDTA 抗凝血标本,酚- 氯仿法提取基因组DNA,PCR 扩增患儿及其父母GAA 基因的外显子2~20,所用引物见相关文献[4]。PCR 体系构成如下:LA Taq0.5 μL、2×GC buffer I 8.0 μL、dNTP Mixture 2.0 μL(2.5 mmol/L)、正反向引物分别为2.0 μL 和10.5 μL、模板DNA(100 ng/μL)1 μL。PCR 循环反应条件:94 ℃ 预变性1 min;94 ℃ 变性30 s,58~62 ℃ 退火30 s;72 ℃ 延伸30~60 s,共30~35个循环;72℃延伸5~8 min。用2% 琼脂糖凝胶电泳分离PCR 产物,在紫外灯下切出特异性目的条带,使用TaKaRa Agarose Gel DNA Purification Kit进行PCR 产物的回收。纯化后的PCR 产物送北京诺赛基因公司用ABI3730XL 进行测序,SquencingAnalysis TM 软件分析测序结果。
2 结果 2.1 外周血GAA 酶活性检测结果两个患儿的GAA 活性检测结果每小时均 <0.63 nM/punch,正常人GAA 活性每小时>7.92 nM/punch,两个患儿的GAA 活性均明显低于正常。
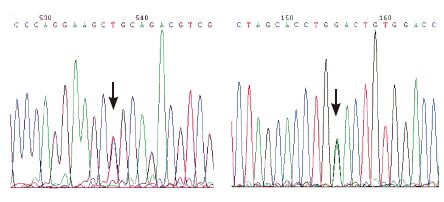
2.2 GAA 基因检测结果经过对患儿及其父母GAA 基因的编码区进行测序,发现两个患儿均为复合杂合突变。两个患儿GAA 基因第14 外显子上的第1 942 位碱基存在颠换(G1942A)(图 2 左),因腺嘌呤(A)取代鸟嘌呤(G),导致GAA 蛋白第648 位甘氨酸(Gly)被丝氨酸(Ser)取代(G648S);经检测,该突变来自患儿母亲的杂合突变,患儿父亲该位点无突变。在两个患儿第16 外显子上同时存在一单核苷酸杂合无义突变(G2214A)(图 2 右),因腺嘌呤(A)取代鸟嘌呤(G),导致GAA 蛋白第738 位的色氨酸(Trp)变成了终止密码(W738X);此突变来源于患儿父亲,也为杂合突变,患儿母亲该位点无突变。
|
图 2 GAA 基因检测结果 左图:GAA 基因第14 外显子上G1942A 突变(箭头所示),导致GAA 蛋白第648 位甘氨酸(Gly)被丝氨酸(Ser)取代(G648S);右图:GAA 基因第16 外显子上G2214A 突变(箭头所示),导致GAA 蛋白第738 位的色氨酸(Trp)变成了终止密码(W738X)。 |
GSD Ⅱ是由于先天性GAA 缺陷所导致的代谢性疾病,根据发病年龄、受累器官和疾病进展速度可分为婴儿型和晚发型[2],病情的严重程度取决于患儿体内残留的GAA 活性。婴儿型患者体内的GAA 活性严重或者完全丧失,典型者于新生儿期到生后3 个月内起病,四肢松软、运动发育迟缓、喂养及吞咽困难。体格检查可见巨舌、肌张力低下、心脏扩大、肝脏肿大,心脏超声显示心肌肥厚和心功能不全,病情进展迅速,多于1 岁内死于左心衰或者肺部感染后的心肺功能衰竭。晚发型患者起病晚,病程进展慢,部分可仅表现为进展缓慢的全身性疾病,无器官肿大[2, 5]。本文所报道2 例患儿在10 个月大时症状明显,心脏增大,外周血GAA 活性明显降低,分别在15 个月、17 个月大时先后死亡,属于婴儿型。
皮肤成纤维细胞的GAA 酶活性测定至今仍被认为是GSD Ⅱ诊断的金标准[2],但此种方法需取皮肤活检的成纤维细胞进行培养,需要4~6 周,明显延迟了诊断。肌肉病理和免疫组化检查可直接快速地检测肌肉组织中GAA 活性和糖原含量,但取材部位对检测结果影响很大,且为有创性检测,不易为患者接受,同时麻醉具有较大的风险性[6]。因此探索新的无创性快速诊断方法非常重要。GAA 在外周血白细胞中也有表达,DBS 留取血液标本,以糖元或4-MU 作为底物测定GAA 活性,具有无创、便于运输、敏感、准确、快速、高通量等优点,具有广泛应用前景[3, 7, 8]。本研究采用上述方法,检测发现患儿的白细胞GAA 活性明显下降后,经过基因检测明确诊断,进一步证实了该方法的可行性和准确性[9]。
GAA 基因位于17q25.2-q25.3,全长约28 kb,至今,已经发现了GAA 基因的近300 种致病突变(www.pompecenter.nl/),主要集中在基因的3 个临界区域:含有起始密码子的2 号外显子;含酶催化部位的10 号和11 号外显子以及与蛋白高度保守区域相对应的14 号外显子。GAA 基因突变存在明显的种族特异性,在中国台湾地区人群中14号外显子的C1935A 突变是最常见的类型[10, 11]。本研究的两个患儿均为复合杂合突变,第1 个位于GAA 突变热点区,14 号外显子的G1942A,导致G648S,已经被证明具有致病性[12];另一个突变是G2214A,导致W738X。经过检索,W738X 是第2次被报道,Zeng 等[13] 在1 例婴儿型GSD Ⅱ患儿基因上检测到E888X/W738X,该患儿生后2 个月即出现喂养困难和全身肌无力,4 个月发现心脏增大,6 个月时死于心肺功能衰竭,患儿白细胞GAA 活性仅为正常对照的17.3%。因W738X 可导致GAA蛋白翻译提前终止,推测应为严重突变。
美国食品药品监督管理局于2006 年4 月批准上市了第一个重组GAA 酶用于GSD Ⅱ的治疗,早期诊断及早期酶替代治疗有希望改善婴儿型GSDⅡ的预后[14, 15]。我国台湾地区及部分欧美国家已经开展GSD Ⅱ的新生儿筛查[16, 17],而实践证明,应用新生儿筛查结合酶置换治疗,能够明显改善GSD Ⅱ的预后[18]。本文使用的DBS 留取外周血检测GAA 活性,对阳性者进行基因检测证实了在我国进行新生儿GSD Ⅱ筛查的可行性。
| [1] | Kishnani PS, Howell RR. Pompe disease in infants and children[J]. J Pediatr, 2004, 144(5 Suppl): S35-S43. |
| [2] | Kishnani PS, Steiner RD, Ball D, et al. Pompe disease diagnosis and management guideline[J]. Genet Med, 2006, 8(5): 267-288. |
| [3] | 邱文娟, 王霞, 王瑜, 等. 干血滤纸片法和白细胞酸性α-葡萄糖苷酶活性测定平台的建立及临床应用[J]. 中华儿科杂志, 2010, 48(1): 55-59. |
| [4] | Ko TM, Hwu WL, Lin YW, et al. Molecular genetic study of Pompe disease in Chinese patients in Taiwan[J]. Hum Mutat, 1999, 13(5): 380-384. |
| [5] | Manganelli F, Ruggiero L. Clinical features of Pompe disease[J]. Acta Myol, 2013, 32(2): 82-84. |
| [6] | Ing RJ, Cook DR, Bengur RA, et al. Anaesthetic management of infants with glycogen storage disease typeⅡ: a physiological approach[J]. Paediatr Anaesth, 2004, 14(6): 514-519. |
| [7] | Umapathysivam K, Hopwood JJ, Meikle PJ, et al. Determination of acid-glucosidase activity in blood spots as a diagnostic test for Pompe disease[J]. Clin Chem, 2001, 47(8): 378-383. |
| [8] | Goldstein JL, Dickerson G, Kishnani PS, et al. Blood-based diagnostic testing for Pompe disease: consistency between GAA enzyme activity in dried blood spots and GAA gene sequencing results[J]. Muscle Nerve, 2014, 49(5): 775-776. |
| [9] | Kishnani PS, Amartino HM, Lindberg C, et al. Methods of diagnosis of patients with Pompe disease: Data from the Pompe Registry[J]. Mol Genet Metab, 2014, 113(1-2): 84-91. |
| [10] | Er TK, Chen CC, Chien YH, et al. Development of a feasible assay for the detection of GAA mutations in patients with Pompe disease[J]. Clin Chim Acta, 2014, 429: 18-25. |
| [11] | Ko TM, Hwu WL, Lin YW, et al. Molecular genetic study of Pompe disease in Chinese patients in Taiwan[J]. Hum Mutat, 1999, 13(5): 380-384. |
| [12] | Huie ML, Tsujino S, Sklower Brooks S, et al. Glycogen storage disease type II: identification of four novel missense mutations (D645N, G648S, R672W, R672Q) and two insertions/deletions in the acid alpha-glucosidase locus of patients of differing phenotype[J]. Biochem Biophys Res Commun, 1998, 244(3): 921-927. |
| [13] | Zeng M, Qiu W, Gu X, et al. A novel nonsense mutation p.W738X of GAA gene indentified in a Chinese patient with infantile glycogen storage disease type II[J]. J Clin Peidatr, 2011, 29(5): 401-406. |
| [14] | Chien YH, Hwu WL, Lee NC. Pompe disease: early diagnosis and early treatment make a difference[J]. Pediatr Neonatol, 2013, 54(4): 219-227. |
| [15] | Angelini C, Semplicini C. Enzyme replacement therapy for Pompe disease[J]. Curr Neurol Neurosci Rep, 2012, 12(1): 70-75. |
| [16] | Matern D, Gavrilov D, Oglesbee D, et al. Newborn screening for lysosomal storage disorders[J]. Semin Perinatol, 2015, 39(3): 206-216. |
| [17] | Wittmann J, Karg E, Turi S, et al. Newborn screening for lysosomal storage disorders in Hungary[J]. JIMD Rep, 2012, 6: 117-125. |
| [18] | Andersson HC. Newborn screening + enzyme replacement therapy = improved lysosomal storage disorder: outcomes in infantile-onset Pompe disease[J]. J Pediatr, 2015, 166(4): 800-801. |
 2015, Vol. 17
2015, Vol. 17


