2. 中国医科大学附属盛京医院儿科, 辽宁 沈阳 110004
气道重塑是诱发气道高反应性和哮喘慢性化的主要原因,传统观点认为,气道平滑肌细胞(airway smooth muscle cell,ASMC)是一种被动的细胞,在炎症介质的刺激下发挥调控气道舒缩的功能。新近研究证据表明,ASMC 还能发生表型转化,具有增殖、迁移、合成和分泌活性介质的能力,参与哮喘气道炎症发生、发展的全过程,可加重气道重塑进程[1, 2, 3]。
感觉神经肽P 物质(substance P,SP)是非肾上腺素能非胆碱能(NANC)神经系统重要的神经递质,通过相应的神经激肽-1 受体(neurokinin 1receptor,NK-1R)发挥作用[4]。本课题组前期研究结果表明,SP 可促进哮喘大鼠ASMC 的迁移,另外哮喘气道重塑时气道NK-1R 的mRNA、蛋白也表达增加,因此推测哮喘气道重塑时感觉神经肽SP 的作用可能是通过与受体NK-1R 结合影响平滑肌迁移实现的[5, 6],但NK-1R 在体外ASMC 的表达及对ASMC 迁移的作用尚未见报道。
本研究拟通过原代培养Sprague-Dawley(SD)大鼠ASMC,并给予NK-1R 拮抗剂WIN62577 干预,探讨NK-1R 在哮喘气道重塑大鼠ASMC 迁移中的作用。
1 材料与方法 1.1 实验材料羟脯氨酸碱水解法试剂盒购自南京建成生物工程研究所第一分所;DMEM/ FBS 培养基购自美国Hyclone 公司;胎牛血清购自美国Hyclone 公司;Ⅳ型胶原酶、4,6- 乙酰基-2- 苯基吲哚(DAPI)、WIN62577 购自美国Sigma 公司;兔抗大鼠α-SMA抗体、NK-1R 抗体购自Santa Cruz 公司;PCR 引物由Invitrogen 英骏生物技术有限公司合成,TRIzol 总RNA 提取液购自上海生工生物工程有限公司,Real time quantitive PCR(SYBRRPremix ExTaqTM)试剂盒购自TaKaRa 大连宝生物工程有限公司。transwell 小室购自美国Corning 公司。
1.2 哮喘气道重塑大鼠模型制作SPF 级雌性SD 大鼠,体重60~80 g,购于中国医科大学实验动物中心。随机分为:哮喘气道重塑组和正常对照组,每组8 只大鼠。参考文献[7, 8, 9, 10]分别于第1 天、第8 天腹腔注射抗原致敏液1 mL(含卵蛋白100 mg、氢氧化铝100 mg、灭活的百日咳杆菌5×109 个)。对照组注射等体积生理盐水。从第15 天开始,将大鼠置于一自制密闭容器(20 cm×20 cm×20 cm) 中,以1% 卵蛋白超声雾化吸入,每次30 min,每周3 次,激发8 周后处死。正常对照组用生理盐水代替卵蛋白。
1.3 大鼠支气管的病理图像分析采用图像采集系统(MetaMorph/BX41,日本)采集图像,测定支气管基底膜周径(Pbm)、总管壁面积(Wat)及平滑肌面积(Wam),分别以Wat/ Pbm 及Wam/ Pbm 代表相应管壁层的厚度。
1.4 大鼠支气管羟脯氨酸测定应用碱水解法按试剂盒说明书(购自南京建成生物工程研究所第一分所)测定羟脯氨酸含量。
1.5 大鼠ASMC 原代培养及纯化常规消毒麻醉后,左心室取血处死大鼠。无菌分离大鼠气管,剥离外膜,去除内膜。将气管平滑肌剪下,将组织剪碎,加0.1% 胰酶于37℃水浴振荡10 min,1 000 rpm/min 离心5 min,去上清。再加0.1% IV 型胶原酶,37℃水浴振荡30 min,1 000 rpm/min 离心5 min,去上清。加入10% 胎牛血清(FBS)的DMEM 终止反应,轻轻吹打,100 目细胞筛过滤,接种至50 mL 培养瓶,37℃孵箱培养,利用成纤维细胞贴壁较快的特点纯化ASMC。待细胞铺满瓶底后按1 : 2 传代,收集第3代细胞用于实验。
1.6 免疫荧光染色检测ASMC 中NK-1R 的表达取对数生长期的细胞,消化制备单细胞悬液,适当调整密度后接种于六孔板中的盖玻片上。37℃ CO2 孵箱内培养过夜,待细胞贴壁伸展后,取出用4% 多聚甲醛固定。3M H2O2 室温下处理10 min,3 g/L Triton100 在37 ℃ 作用10 min,用3%羊血清室温下封闭15 min。加兔抗大鼠NK-1R 抗体(1 : 100),置湿盒内4℃过夜。加入FITC 标记的山羊抗兔IgG 于37℃作用30 min。加DAPI 5 μg/mL,室温5 min。50% 甘油封片。每步之间用PBS 洗片。实验中以PBS 代替一抗设立阴性对照。
1.7 实时定量PCR 检测ASMC 中NK-1R 的mRNA 表达用SYBR Green I 荧光染料嵌合法,分别制作目的基因(NK-1R)和管家基因(GAPDH)的标准曲线。利用标准曲线对样品中的目的基因和管家基因分别进行定量。待测基因mRNA 的相对表达量=待测基因基因拷贝数/GAPDH 基因拷贝数。NK-1R引物序列:上游5'-ACCAACACCTCTGAGTCTAA-3';下游5'-TGGTCACTGTCCTCATTCT-3'。GAPDH 引物序列:上游5'-GCACCGTCAAGGCTGAGAAC-3';下游5'-ATGGTGGTGAAGACGCCAGT-3'。引物由Invitrogen 英骏生物技术有限公司合成。
1.8 Transwell 小室检测ASMC 迁移分别取哮喘气道重塑组及正常对照组第3~5代ASMC 生长至80% 融合时,0.25% 的胰酶消化细胞,计数,用10% FBS 的DMEM 调整细胞密度至1×105/mL,transwell 上室加入各组细胞悬液100 μL,下室加入10% FBS 的DMEM 600 μL。其中哮喘气道重塑组按随机化分配原则分别分为下列5 个亚组:(1)空白组:不加任何干预剂;(2)WIN62577 10-11 mol/L 组;(3)WIN6257710-10 mol/L 组;(4)WIN62577 10-9 mol/L 组;(5)WIN62577 10-8 mol/L 组。每小组5 个复孔。进行迁移实验前,上室细胞预先用不同浓度的WIN62577 预处理细胞30 min。将各组小室置37℃孵箱,24 h 后取出小室,小心取出滤膜,棉签轻轻擦去微孔膜朝上一面未穿膜的细胞。膜下面的ASMC4% 多聚甲醛固定20 min,苏木素染色10 min,二甲苯透明1 min,中性树胶封片,倒置显微镜(×400)下随机计数5 个视野的细胞数,取均值。重复3 次。
1.9 统计学分析应用SPSS 13.0 统计软件对数据进行统计学分析,正态分布计量资料以均数± 标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t 检验。P<0.05 为差异有统计学意义。
2 结果 2.1 各组大鼠支气管的病理图像分析及羟脯氨酸测定结果支气管的病理图像分析及羟脯氨酸测定结果显示,哮喘气道重塑组Wat/Pbm、Wam/Pbm、羟脯氨酸含量均较对照组增加(P<0.01),表明哮喘气道重塑模型制作成功。见表 1。
|
|
表 1 各组大鼠气道壁厚度、平滑肌厚度和羟脯氨酸含量 的比较 (x±s) |
倒置相差显微镜下观察细胞形态,未贴壁前细胞呈圆形或椭圆形,胞质密度高,不透明,培养1 d 后,大部分细胞已贴壁,开始伸展,培养3 d,贴壁细胞完全伸展,呈梭形或多边形,内有1~2 个细胞核,细胞核位于细胞中央,有一至数个足突,部分区域细胞束状排列,呈“峰谷”状态学特征。培养7~9 d,细胞铺满瓶底。培养细胞达铺满状态所需时间与细胞活力和细胞接种密度有关,细胞活力愈大,接种密度愈大,达到铺满状态所需时间愈短。见图 1。

|
图 1 ASMC 形态观察(×100) 培养3 d,倒置相差 显微镜下观察细胞形态,贴壁细胞完全伸展,呈梭形或多边形, 内有1~2 个细胞核,细胞核位于细胞中央,有一至数个足突,部 分区域细胞束状排列,呈“峰谷”状态学特征。 |
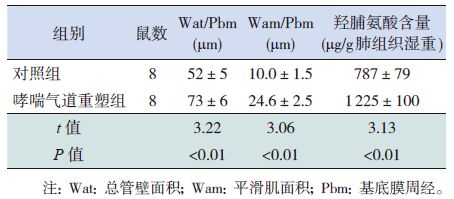
对平滑肌细胞特异的α-SMA 进行免疫荧光染色,在荧光显微镜下观察并成相,在488 nm 波长激光下,标记α-SMA 的FITC 发绿光,主要均匀分布在胞质。DAPI 标记胞核,其在356 nm 波长激光下发出蓝色荧光。见图 2。
|
图 2 α-SMA 免疫荧光染色细胞鉴定ASMC(×400)标记α-SMA 的FITC 发绿光,主要均匀分布在细胞质;DAPI 标记的是细胞核,发蓝色光。 |
荧光显微镜下观察NK-1R 主要分布在细胞质和细胞膜。哮喘气道重塑组灰度值明显高于对照组(P<0.01)。哮喘气道重塑组ASMC 中NK-1R的mRNA 相对表达量较正常对照组明显增高(P<0.01)。见表 2,图 3。
|
|
表 2 两组大鼠 ASMC 中NK-1R 灰度值及mRNA 比较(x±s) |

|
图 3 ASMC 中NK-1R 的免疫荧光染色(×400) NK-1R 主要分布在细胞质和细胞膜,发绿色荧光;A:对照组,NK-1R 光灰度值较低;B:哮喘气道重塑组,NK-1R 光灰度值较高。 |
对照组ASMC 迁移数量较少,与对照组相比,哮喘气道重塑组细胞迁移数量明显增多(P<0.01)。各浓度NK-1R 拮抗剂组细胞迁移数目较对照组增多,但较哮喘气道重塑组明显减少,而且随着WIN62577 浓度增高,ASMC 迁移数量逐渐减少(P<0.05)。见表 3,图 4。
|
|
表 3 各组大鼠 ASMC 迁移数量比较(x±s) |
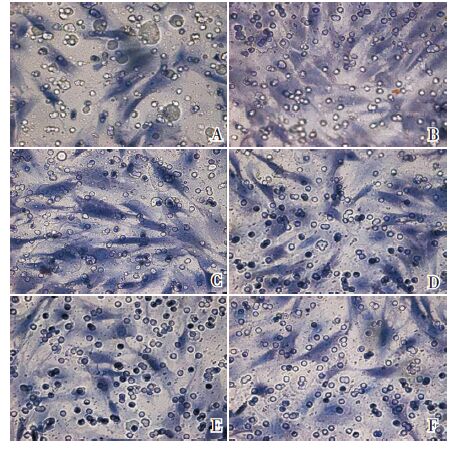
|
图 4 Transwell 小室检测大鼠ASMC 的迁移(苏木
素染色,×100) A:正常对照组,ASMC 的迁移数量最少;B: 哮喘气道重塑组,ASMC 的迁移数量最多;C:WIN62577 10-11 mol/L 组,ASMC 的迁移数量较哮喘气道重塑组少; D:WIN62577 10-10 mol/L 组,ASMC 的迁移数量较WIN62577 10-11 mol/L 组少;E:WIN62577 10-9 mol/L 组,ASMC 的迁移数量较WIN62577 10-10 mol/L 组少;F:WIN62577 10-8 mol/L 组,ASMC 的迁移数量较WIN62577 10-9 mol/L 组少。 |
在持续哮喘的病例中,ASMC 会出现向气道内膜定向移动并出现分泌功能,这一现象称为气道平滑肌的迁移性生长[9]。Gizycki 等[10] 发现在哮喘急性发作后24 h,气道网状部内的肌成纤维细胞数量显著增加,同时肌成纤维细胞呈现出不规则的细胞轮廓,细胞内有大量的高浓度肌丝样结构,并且有些细胞紧贴平滑肌细胞层,提示这种肌成纤维细胞很有可能是来源于平滑肌细胞,这一迁移过程可能和哮喘气道病理变化有着密切的联系,因为有证据显示,肌成纤维细胞能够分泌大量的胶原物质,使网状部增厚,并且参与调控内皮细胞与间叶细胞的相互作用、影响内皮细胞的调亡、诱导平滑肌细胞增生及气道壁的重塑[11]。
本研究结果显示,哮喘气道重塑组ASMC 迁移数量明显增多,也提示ASMC 迁移可能是哮喘气道重构的重要促成因素。感觉神经肽SP 广泛分布于中枢和周围神经系统,在受到伤害性刺激时,SP 可逆向释放入损伤局部组织中,参与对修复细胞增殖、迁移、分化的调控[12, 13, 14]。以往未见有关NK-1R 在ASMC 中的表达的报道,本研究发现,NK-1R 在大鼠ASMC 的细胞膜及细胞质中均有表达,并且哮喘气道重塑大鼠ASMC 中NK-1R的mRNA 和蛋白的表达均较对照组明显增多,这是SP 作用于ASMC 的基础和前提。
研究发现,运用NK-1R 激动剂可以显著刺激T 淋巴细胞、单核细胞的化学趋向性,当用NK-1R 的选择性的拮抗剂LY303870 时,两种细胞的化学趋向作用被显著抑制[15, 16]。国内研究发现,WIN62577 可通过降低细胞内钙离子浓度改善哮喘气道高反应性[17],但是NK-1R 对气道重塑的影响未见报道。本研究显示,给予WIN62577 阻断NK-1R 后可以抑制ASMC 的迁移,表明NK-1R 在ASMC 迁移中起着重要作用,推断感觉神经肽SP通过与其受体(NK-1R)结合,加速ASMC 的迁移,从而促进气道重塑的发生、发展,从新的角度探讨了气道重塑的发生机制,应用NK-1R 拮抗剂从而抑制ASMC 的迁移可能是防治哮喘气道重塑的新途径,值得进一步深入研究。
| [1] | Wu Y, Fu H, Yang H, et al. Smooth muscle progenitor cells involved in the development of airway remodeling in a murine model of asthma[J]. Asian Pac J Allergy Immunol, 2014, 32(3): 203-210. |
| [2] | Wright DB, Trian T, Siddiqui S, et al. Phenotype modulation of airway smooth muscle in asthma[J]. Pulm Pharmacol Ther, 2013, 26(1): 42-49. |
| [3] | Gerthoffer WT, Schaafsma D, Sharma P, et al. Motility, survival, and proliferation[J]. Compr Physiol, 2012, 2(1): 255-281. |
| [4] | Joos GF. The role of neuroeffector mechanisms in the pathogenesis of asthma[J]. Curr Allergy Asthma Rep, 2001, 1(2): 134-143. |
| [5] | Li M, Shang YX, Wei B, et al. The effect of substance P on asthmatic rat airway smooth muscle cell proliferation, migration, and cytoplasmic calcium concentration in vitro[J]. J Inflamm (Lond), 2011, 8(1): 18-27. |
| [6] | 魏兵,尚云晓,李淼,等. 孟鲁司特对幼年哮喘气道重塑大鼠感觉神经肽受体NK1R表达的影响[J].中国当代儿科杂志, 2013, 15(4): 298-301. |
| [7] | 梁亚峰,张维溪,李昌崇,等.哮喘大鼠气道重塑中尾加压素2Ⅱ的表达变化[J]. 中国当代儿科杂志, 2010, 12(4): 287-289. |
| [8] | 栾斌,冯晓霞,杨玉霞,等.FIZZ1及NOTCH1在哮喘中的作用[J]. 中国当代儿科杂志, 2011, 13(3): 219-222. |
| [9] | Parameswaran K, Redford K, Zuo J, et al. Extracellular matrix regulates human airway smooth muscle cell migration[J]. Eur Respir J, 2004, 24(4): 545-551. |
| [10] | Gizycki MJ, Adelroth E, Rogers AV, et al. Myofibroblast involvement in the allergen-induced late response in mild atopic asthma[J]. Am J Respir Cell Mol Biol, 1997, 6(6): 664-673. |
| [11] | Hastie, Kraft WK, Nyce KB, et al. Asthmatic epithelial cell proliferation and stimulation of collagen production[J]. Am J Respir Crit Care Med, 2002, 165(2): 266-272. |
| [12] | Muñoz M, Coveñas R. Involvement of substance P and the NK-1 receptor in human pathology[J]. Amino Acids, 2014, 46(7): 1727-1750. |
| [13] | Amadesi S, Reni C, Katare R, et al. Role for substance p-based nociceptive signaling in progenitor cell activation and angiogenesis during ischemia in mice and in human subjects[J]. Circulation, 2012, 125(14): 1774-1786. |
| [14] | Evans AR, Junger H, Southall MD, et al. Isoprostanes, novel eicosanoids that produce nociception and sensitize rat sensory neurons[J]. J Pharmacol Exp Ther, 2000, 293(3): 912-920. |
| [15] | Hood VC, Cruwys SC, Urban L, et al. Differential role of neurokinin receptors in human lymphocyte and monocyte chemotaxis[J]. Regul Pept, 2000, 96(1-2): 17-21. |
| [16] | Amoruso A, Bardelli C, Gunella G, et al. A novel activity for substance P: stimulation of peroxisome proliferator-activated receptor-gamma protein expression in human monocytes and macrophages[J]. Br J Pharmacol, 2008, 154(1): 144-152. |
| [17] | 李淼, 尚云晓. 神经肽-1受体拮抗剂对哮喘大鼠气道平滑肌细胞内钙离子浓度的影响[J]. 中国现代医学杂志, 2011, 21(7): 783-785. |
 2015, Vol. 17
2015, Vol. 17