2. 南方医科大学附属深圳市妇幼保健院出生缺陷预防控制重点实验室, 广东深圳 518000
Williams-Beuren综合征(OMIM:194050)是一种由染色体7q11.23区域微缺失导致的累及多系统缺陷的罕见病,缺失大小一般介于1.5~1.8 Mb之间,累及26~28个基因,发病率约为1/10 000[1, 2],在微缺失综合征中比较常见。Williams-Beuren综合征主要临床表现有:特殊面容,包括鼻梁低平、鼻孔前倾、眶周丰满、小下颌等;先天性心血管畸形,最常见为主动脉瓣上狭窄(SVAS);内分泌系统异常,如高血钙、高血糖、甲状腺功能异常;智力低下;发育迟缓;认知行为异常等[1, 3]。
早期诊断Williams-Beuren综合征有助于对患儿进行及时治疗和干预。同时,对该综合征进行产前诊断能够避免夫妇再次生育相同疾病患儿,减少出生缺陷发生率。因此,寻找快速准确的方法早期诊断Williams-Beuren综合征能够为患者及其家庭提供重要帮助。本次研究以4例Williams-Beuren综合征家系为研究对象,借助细胞遗传学及分子遗传学技术进行遗传学诊断及产前诊断。同时结合以往文献报道,以期发现该综合征的产前胎儿异常表现及母体异常等。
1 资料与方法 1.1 研究对象4例Williams-Beuren综合征家系具体临床信息如下:
家系1:孕妇,23岁,孕2次,自然流产1次。末次月经为2013年5月8日,孕16周唐氏筛查报告21三体风险值为1/2 304,于停经24周B超提示胎儿大小约23周;停经28周B超提示胎儿大小相当于26+3周,胎儿左肾实质回声不均,肾皮质下见一小液性暗区4 mm×4 mm。于停经29周行羊膜腔穿刺术,对羊水细胞行染色体核型分析、多重链接依赖探针扩增计数(MLPA)检测(P095,P036,P070,P245)及微阵列比较基因组杂交技术(array-CGH)检测,结果发现胎儿为 Williams-Beuren综合征患儿。经遗传咨询,孕妇选择引产终止妊娠。2014年再次妊娠,末次月经为2014年8月27日,为避免再次妊娠该类综合征患儿,孕妇要求行产前诊断。于孕18周行羊膜腔穿刺术,羊水染色体核型分析、MLPA检测均未发现异常。
家系2:患儿,女,现10岁,因智力发育落后,于3岁9个月大时行智商测定,IQ结果为47。患儿呈现特殊面容:鼻梁低平、鼻孔朝前、眶周丰满、下颌小、牙齿发育不良(图 1A、B)。染色体核型分析结果为46, XX, 15S+,其余临床信息不详。现其母亲再次妊娠,为避免再次生育相同疾病患儿来我院遗传咨询。抽取患儿外周血行染色体核型分析、MLPA(P245)检测及array-CGH检测,结果提示患儿为Williams-Beuren综合征。其母亲于孕18周行羊膜腔穿刺术,羊水细胞染色体核型分析、MLPA检测(P095,P036,P070,P245)均未发现异常。
家系3:患儿,女,其母亲孕期无明显异常。患儿出生后于5岁时发现心脏杂音(胸骨右缘及左缘第二肋间可闻及收缩期3 / 6级杂音,A2<P2),心脏彩色多普勒超声检查示主动脉瓣上狭窄(中度),患儿呈现特殊面容:眼距宽、眶周丰满、鼻梁低平、鼻孔朝前、下颌小(图 1C),拟诊Williams-Beuren综合征。家属因经济问题,未对患儿行手术治疗及进一步遗传学检测。患儿9岁时,其母亲再次妊娠来我院行遗传咨询,抽取患儿外周血行染色体核型分析、MLPA(P245)检测及array-CGH检测证实患儿为Williams-Beuren综合征。于孕18周对孕妇行羊膜腔穿刺术,羊水细胞染色体核型分析、MLPA检测(P095,P036,P070,P245)均未发现异常。
家系4:患儿,男,其父母拟生育第二胎前来遗传咨询,自述患儿有先天性心脏病史(主动脉弓缩窄),已行手术治疗。就诊时发现患儿逻辑思维能力混乱,待人友好,不惧陌生人,呈现特殊面容:眼距宽、眶周丰满、眉毛稀疏、下唇外翻、鼻唇沟长、牙齿发育不整齐(图 1D、E)。遂抽取患儿外周血行染色体核型分析、MLPA(P245)检测及array-CGH检测,提示为Williams-Beuren综合征。其母亲于2013年再次怀孕,于孕18周行羊膜腔穿刺术,羊水细胞染色体核型分析、MLPA检测(P095,P036,P070,P245)结果均未发现异常。
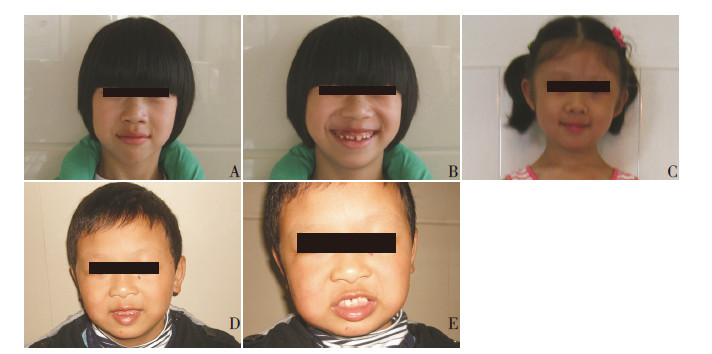 |
图 1 3 个不同家系患儿图片 图A、B 分别显示家系2 患儿的面部特征及牙齿发育不良;图C 为家系3 患儿的面 部特征;图D、E 分别为家系4 患儿的面部特征及牙齿发育不良。3 个家系之间没有亲缘关联。 |
外周血及羊水标本经培养后,常规行G显带染色体核型分析。
1.3 基因组DNA提取外周血及羊水标本基因组DNA采用Gentra Puregene Blood Kit(Qiagen公司生产)提取。提取出的DNA使用Nanodrop2000蛋白核酸分析仪检测DNA浓度及纯度。确保DNA总量大于2 500 ng,A260/A280在1.8~2.0之间后再进行后续实验。
1.4 MLPA检测采用MLPA P036、P070、P245试剂盒(MRC-Holland公司生产)对外周血及羊水基因组DNA进行23对染色体亚端粒微缺失微重复检测及常见染色体微缺失综合征检测(Prader-willi/Angelman综合征、DiGeorger综合征、Williams综合征、猫叫综合征等)。羊水标本加做MLPA P095检测以排除13、18、21、X、Y五种常见染色体非整倍体异常。实验操作流程均按照MRC-Holland公司试剂盒说明书进行。
1.5 array-CGH检测家系1标本采用DNA Chip Version 1.0(香港中文大学设计)于Agilent芯片检测平台上进行检测;家系2、3、4标本使用Agilent Oligonucleotide array 180 K芯片进行分析。
2 结果 2.1 染色体核型分析(G显带)结果家系2、3、4患儿的3份外周血标本及家系1孕妇、家系2、3、4患儿母亲的5份羊水标本G显带核型分析均未发现异常。
2.2 MLPA检测家系2、3、4患儿的3份外周血标本及家系1孕妇第2次妊娠羊水细胞标本MLPA P245检测均发现7q11.23区域ELN基因探针信号值降低(图 2),MLPA P036、P070、P095检测均无异常发现。其余4份羊水细胞标本MLPA P095、P036、P070、P245均无异常发现,且胎儿现均已顺利出生,随访至今尚无异常发现。
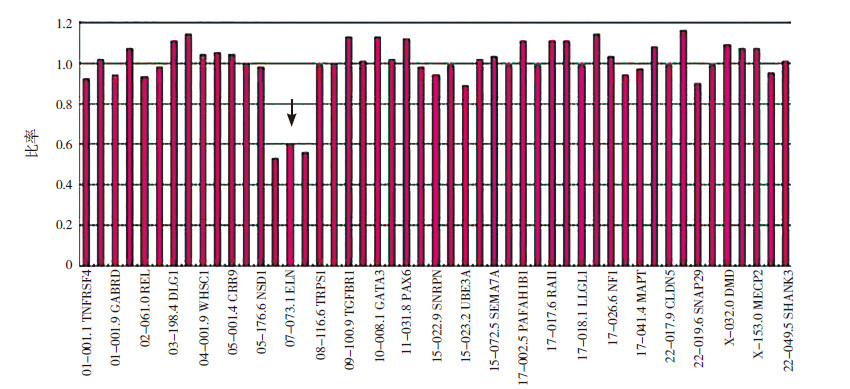 |
图 2 家系2 患儿MLPA(P245)柱形图结果 与正常女性比较,可见ELN 基因探针所处位置信号与正常人信 号的比值为0.5 左右(箭头所示),其余探针的信号比值均在1.0 左右,由此可判断ELN 基因所在区域存在缺失。 |
家系1孕妇第2次妊娠羊水标本经array-CGH检测发现arr[hg19]7q11.23(72,875,683-74,285,
345)×1,缺失大小约为1.4 Mb,检索Decipher数据库提示该缺失为致病性,临床表现为Williams-Beuren综合征(图 3)。3例患儿外周血标本检测结果均于7号染色体7q11.23区域(Chr7: 72,364,314-73,777,467 NCBI136/hg18)发现1.413 Mb的缺失,经检索Decipher数据库提示为Williams-Beuren综合征(图 4)。
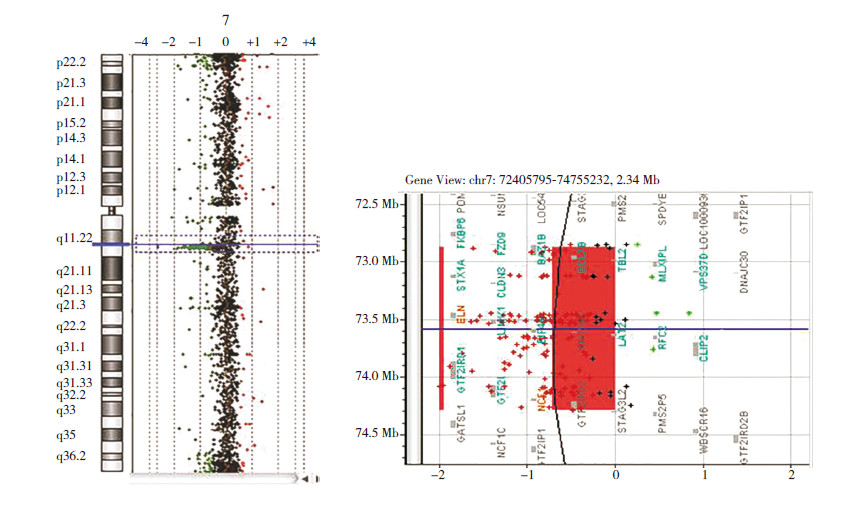 |
图 3 家系1 孕妇第2 次妊娠羊水标本array-CGH 结果图 左侧显示的是羊水标本7 号染色体的缺失区域(蓝 色方框所示位置),右侧为缺失区域放大图。 |
 |
图 4 家系2、3、4 患儿外周血array-CGH 结果图 三者缺失区域一致。左侧显示的是7 号染色体的缺失区域(蓝 色箭头所示位置),右侧为缺失区域放大图。 |
约90%~95%的Williams-Beuren综合征患者于染色体7q11.23区域缺失约1.55 Mb,涉及26~28个基因。5%~8%的Williams-Beuren综合征患者缺失大小为1.8 Mb,涉及28个基因。二者区别主要在于缺失区域是否包含NCF1基因和GTF2IRD2基因[4]。上述两类缺失患者中除高血压发病风险不同之外尚未发现其他表型差异[8, 9]。另外约有2%的患者存在非典型缺失。本次研究的4例家系中,3例患儿经Agilent Oligonucleotide array 180K芯片检测的标本缺失区域相同,均为arr[hg18]7q11.23(72,364,314-73,777,467)×1,缺失区域涉及基因从TRIM50到GTF2I,包括了从FKBP6到GTF2I的所有基因。1例孕妇经DNA Chip Version 1.0检测阳性标本缺失区域为arr[hg19]7q11.23(72,875,683-74,285,345)×1,包含从BAZ1B到GTF2IR所有基因,未包含FKBP6及FZD9两个基因。FKBP6及FZD9基因缺失与Williams-Beuren综合征表型的相关性尚不十分明确,FZD9基因可能与患者骨质减少有关[1];FKBP6基因参与精子的生成过程,在敲除FKBP6基因的雄性小鼠中可观察到无精或少(弱)精等表现,而敲除此基因的雌性小鼠则没有异常[10]。
Williams-Beuren综合征属于常染色体显性遗传性疾病,患者染色体变异可遗传自患病父母,但几乎所有Williams-Beuren综合征患者的染色体变异是父亲或母亲生殖细胞形成过程中的自发变异,因此对于曾生育过该综合征患儿的健康夫妇,再次生育Williams-Beuren综合征患儿的概率小于1%[1]。本次的4例家系中,夫妇双方再次妊娠时均未发现胎儿存在7q11.23区域微缺失。
Array-CGH技术能够检测出常规染色体核型不能发现的染色体微缺失和微重复,从而大大提高了染色体结构异常的检出率。目前,该项技术已经被推荐作为不明原因生长发育迟缓、智力低下、自闭症谱系障碍以及先天性畸形患儿的一线遗传学检测技术[11, 12, 13, 14]。在产前诊断领域该技术也被推荐为产前超声检查发现胎儿存在结构异常的一线检测方法[15, 16]。MLPA技术操作简便,成本远远低于array-CGH技术,同时又能够对常见的染色体结构异常进行检测,因此该技术可以作为一种筛查技术应用于上述领域。MLPA技术也可以同FISH技术一样作为一种验证方法来对array-CGH技术等其他方法检出的染色体结构异常进行验证。通过MLPA及array-CGH技术,我们能够在产前及新生儿期确诊Williams-Beuren综合征患者,从而为孕妇及其家属决定是否继续妊娠提供遗传学参考信息,指导儿科医生对该综合征患儿进行早期治疗和长期管理。
| [1] | Pober BR. Williams-Beuren syndrome[J]. N Engl J Med, 2010, 362(3):239-252. |
| [2] | Str?mme P, Bj?rnstad PG, Ramstad K. Prevalence estimation of Williams syndrome[J]. J Child Neurol, 2002, 17(4):269-271. |
| [3] | Gray JC 3rd, Krazinski AW, Schoepf UJ, et al. Cardiovascular manifestations of Williams syndrome:imaging findings[J]. J Cardiovasc Comput Tomogr, 2013, 7(6):400-407. |
| [4] | Pober BR, Johnson M, Urban Z. Mechanisms and treatment of cardiovascular disease in Williams-Beuren syndrome[J]. J Clin Invest, 2008, 118(5):1606-1615. |
| [5] | Delio M, Pope K, Wang T, et al. Spectrum of elastin sequence variants and cardiovascular phenotypes in 49 patients with Williams-Beuren syndrome[J]. Am J Med Genet A, 2013, 161A(3):527-533. |
 2015, Vol. 17
2015, Vol. 17


