2. 潍坊市中医院消化内科, 山东潍坊 261000;
3. 同济大学附属上海市肺科医院心肺循环科, 上海 200433
下呼吸道感染(lower respiratory tract infection, LRTI)是儿科常见的感染性疾病之一,是导致全球儿童高死亡率的主要原因[1, 2, 3]。LRTI的临床诊断主要依据 LRTI 诱因、临床症状、体征和胸部X 线检查等[2, 3, 4],但是不同病原菌引起的 LRTI 临床表现的症状与体征十分相似,往往难以鉴别。目前临床影像学及实验室检测指标不能明确判断是否为细菌感染导致的LRTI,因此抗生素治疗仍然是治疗 LRTI 的主要武器,减少 LRTI 患儿的抗生素使用对我国乃至全球抗生素的消费和抗生素耐药性的发展有显著影响[1, 2, 3]。研究证实降钙素原(procalcitionin, PCT)对指导小儿感染性疾病的抗生素治疗和病情预后的评估有效[4, 5, 6, 7]。然而,仅有部分小的单中心临床试验表明 PCT 可能对指导儿科患者 LRTI 治疗有益[4, 6, 7],且PCT指导对社区获得性肺炎(community acquired pneumonia, CAP)或非CAP感染患儿抗生素使用是否有不同尚不清楚。因此,本研究通过前瞻性临床分析,旨在观察 PCT在指导不同感染途径的LRTI患儿抗生素使用中的价值和意义。
1 资料与方法 1.1 研究对象选取 2011 年 1 月至 2014 年 1 月于潍坊市妇幼保健院收住急诊或住院治疗的 LRTI 患儿396例为研究对象,年龄 1 个月至 18 岁。
排除标准:患儿家属不愿参加本次研究或不能提供书面知情同意书;严重免疫功能抑制者(如 HIV 感染);中性粒细胞减少症者(<1 000×109/L;囊性纤维化者;急性喉炎者;近 14 d内已经在住院者;其他严重的感染患者。
LRTI的诊断参照 2013年第8版《儿科学》[8]及《儿童社区获得性肺炎管理指南》[9]。运用随机数字表法将符合条件的患儿随机分为 PCT 指导抗生素治疗组(PCT 组)和临床指导标准治疗组(对照组)。并按照是否为CAP进行亚组分析。本研究获得潍坊市妇幼保健院医学伦理委员会的批准以及患儿家属签署的书面知情同意书。
1.2 资料收集收集患儿入院后 24 h内的基础数据,包括性别、年龄、生命体征、既往史及诊断,同时完善血常规、血清PCT、C-反应蛋白(CRP)及胸片检查等相关检查。
1.3 检测指标及方法患儿入院后 24 h内抽取外周静脉血 4 mL以进行血清 PCT和CRP含量的检测。应用半定量的免疫色谱检测法测定血清中PCT浓度,PCT试剂盒由德国BRAHM·S提供。其检测值范围为0.05~200.0 ng/mL; PCT≥0.5 ng/mL为异常。血清CRP的测定使用美国COULTER公司的试剂盒,采用免疫透射比浊法,通过免疫荧光检测仪进行检测,其检测范围为0.6~210 mg/L。
1.4 抗生素的指导和端点评估(1)PCT 组:根据既往成人 LRTI 临床试验研究结果指导抗生素的使用[6, 10, 11, 12, 13]。该统计算法提供了血清PCT 指导抗生素治疗细菌感染性 LRTI 的可能性:“绝对给予”(PCT>0.5 ng/mL),“可能给予 ”(PCT 0.26~0.5 ng/mL),“可能不给予”(PCT 0.1~0.25 ng/mL)和“绝对不能给予”(PCT<0.1 ng/mL)。该指导方法不适用于有生命危险的重症感染患者。当患儿的临床状态稳定且血清PCT <0.25 ng/mL时停用抗生素;初始 PCT>10 ng/mL 的患儿,当血清 PCT 水平下降初始值的 90%时停用抗生素。第 5 天继续使用抗生素的依据为:血清PCT >1 ng/mL 持续 7 d,0.51~1 ng/mL持续 5 d,0.26~0.5 ng/mL持续 3 d,≤0.25 ng/mL 时停用抗生素。
(2)对照组:参照《儿童社区获得性肺炎管理指南》[9]和《急性呼吸道感染抗生素合理使用指南(试行)(下)》[13]结合实验室血常规、CRP及病原学检测结果,常规给予细菌性、支原体及衣原体感染患儿抗生素治疗,不伴有合并症的患儿给予抗生素治疗 7~10 d,伴有合并症(如胸腔积液、脓胸、脓肿)的患儿给予 14 d或更长时间的治疗[14];无抗生素使用指征的病毒性肺炎患儿,以对症疗法、支持疗法为主。
记录患儿抗生素使用情况,也包括住院情况及症状的出现情况等。
安全性监测包括对 LRTI 并发症的评估:严重不良事件的发生或疾病加重入院,复发性感染需用抗生素治疗,任何需要加用抗生素的合并症。
1.5 统计学分析采用SPSS 19.0统计软件包进行统计学分析。偏态分布计量资料以中位数(四分位区间)[M(P25,P75)]表示,组间比较采用Wilcoxon 秩和检验;计数资料用百分率(%)表示,组间比较采用卡方检验。P<0.05 为差异有统计学意义。
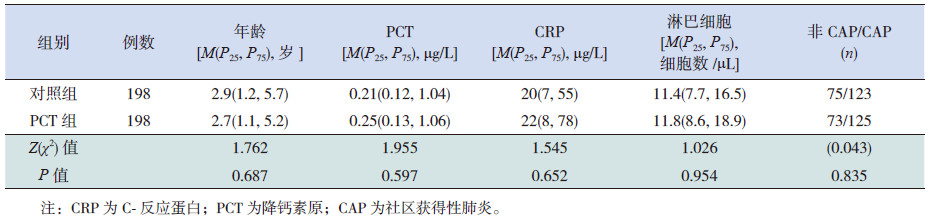
2 结果 2.1 两组各项基线资料的比较PCT 组和对照组中男童均为158例,女童40例。两组患儿年龄、血清PCT、CRP和淋巴细胞水平等指标在两组间比较差异无统计学意义;两组CAP和非CAP患儿的构成比差异亦无统计学意义(表 1)。
| 表 1 两组患儿各项基线资料的比较 |
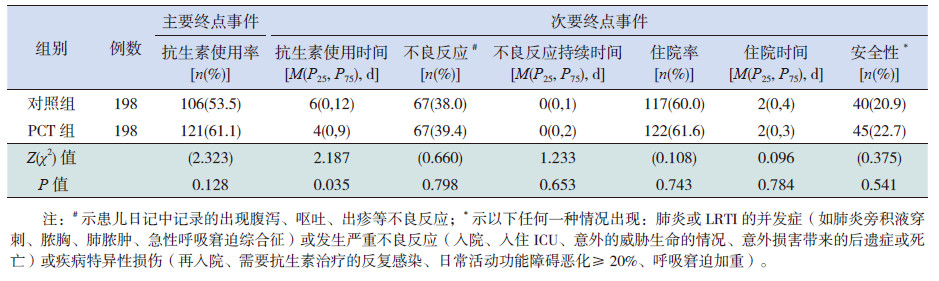
PCT组和对照组两组抗生素使用率比较差异无统计学意义,但PCT 组抗生素使用时间较对照组显著缩短,差异有统计学意义(表 2)。
| 表 2 两组患儿主要终点和次要终点事件的有效性和安全性 |
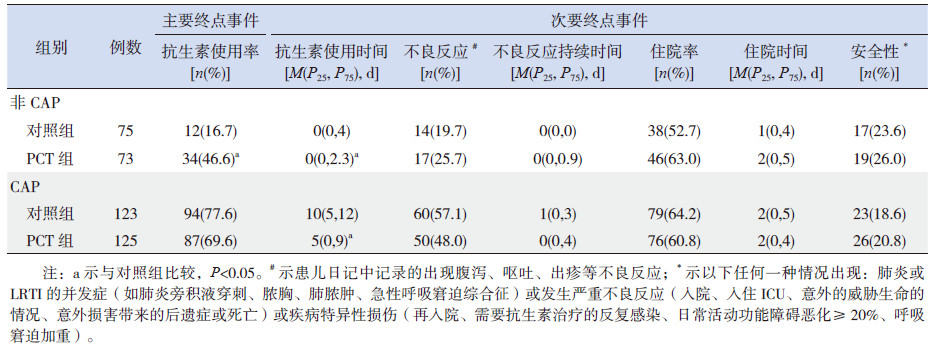
两组LRTI 患儿接受抗生素治疗的不良反应发生率和不良反应持续时间、住院率及住院持续时间及安全性(包括严重不良事件、LRTI并发症和疾病特异性损伤)差异无统计学意义(表 2)。在亚组分析中,非 CAP及 CAP患儿接受 PCT 指导后使用抗生素与对照组相比,抗生素治疗的不良反应发生率和不良反应发生率持续时间、住院率和住院时间及安全性差异亦无统计学意义(表 3)。
| 表 3 两组患儿主要终点和次要终点事件的有效性和安全性亚组分析 |
萨日娜等[4]研究提示PCT 已经用于临床指导 LRTI 患儿初始治疗抗生素的使用,仅能降低抗生素使用率,不能减少抗生素使用时间,本研究结果与之不一致。本研究结果提示PCT 指导治疗CAP 患儿的抗生素使用率与对照组比较差异无统计学意义,PCT指导治疗的非 CAP亚组患儿的抗生素使用率反而高于对照组,因此 PCT 指导并没有改善 LRTI 患儿的抗生素使用率,具体原因可能如下:首先,该院儿科总体上抗生素使用率较低;第二,采用成年 LRTI 患者试验结果计算出的 PCT 阈值来指导 LRTI 患儿抗生素的应用,尽管对于 CAP 患儿有效[6],可能此值对于非 CAP 患儿而言太低。低的 PCT 阈值对 PCT 含量较低的非 CAP患儿影响更明显。在Esposito 等[6]的研究中,提示PCT 含量 0.25 ng/mL 作为临界值可以很好地指导 CAP 患儿抗生素的治疗,并减少抗生素相关的不良事件。大量的研究证实,血清PCT 水平在 0.5~2 ng/mL 才能有效鉴别细菌和病毒感染,PCT 水平过低敏感性较低[15, 16]。在本研究中,虽然 PCT 指导在 CAP 患儿抗生素的使用率有下降的趋势,但导致了非CAP患儿中抗生素的使用率增加,此结果与Baer 等[10]的研究结果一致。
在本研究中,不论是在亚组,还是所有患儿中 PCT 组抗生素使用时间均较对照组显著降低。抗生素使用时间减少最明显的在 CAP 亚组,这与既往发表的成年LRTI患者的研究结果一致[4, 5, 11, 17],与新生儿败血症治疗的研究结果类似[7],与儿童和青少年的LRTI治疗结果不同[4, 10],他们的研究显示 PCT 指导治疗并不能缩短非 CAP 患儿的抗生素使用时间。本研究结果与文献[4, 10]不同的原因可能是入选研究对象的临床特征不同及医生使用抗生素的规则不同,具体的原因有待进一步的深入研究。
尽管 PCT 指导抗生素治疗没有影响抗生素的不良反应发生率,尤其是在非 CAP 患儿,由于抗生素的使用率增加,导致抗生素的不良反应发生也有增加的趋势,但与对照组比较差异无统计学意义。这可能缘于抗生素使用时间较短,所有患儿均有较好的预后,没有明显的不良事件。同样,PCT指导治疗的CAP患儿可能由于抗生素使用时间缩短和预后较好,也没有明显的不良事件。
综上所述,本研究显示,应用血清PCT 指导LRTI患儿抗生素的使用,可缩短患儿抗生素的使用时间,提高患者依从性,有助于降低抗菌素耐药性。
| [1] | Gerber JS, Prasad PA, Fiks AG, et al. Effect of an outpatient antimicrobial stewardship intervention on broad-spectrum antibiotic prescribing by primary care pediatricians:a randomized trial[J]. JAMA, 2013, 309(22):2345-2352. |
| [2] | Mangione-Smith R, Zhou C, Robinson JD, et al. Communication practices and antibiotic use for acute respiratory tract infections in children[J]. Ann Fam Med, 2015, 13(3):221-227. |
| [3] | Francis NA, Butler CC, Hood K, et al. Effect of using an interactive booklet about childhood respiratory tract infections in primary care consultations on reconsulting and antibiotic prescribing:a cluster randomised controlled trial[J]. BMJ, 2009, 339:b2885. |
| [4] | 萨日娜, 王爱琼, 孟红, 等. 降钙素原在儿童下呼吸道感染初始治疗中指导抗生素使用的意义[J]. 中国当代儿科杂志, 2014, 16(2):211-213. |
| [5] | 奇英征, 多力坤· 木扎帕尔. 降钙素原和D- 二聚体对全身炎症反应综合征患儿病情预后的判断价值[J]. 中国当代儿科杂志, 2014, 16(4):384-388. |
| [6] | Esposito S, Tagliabue C, Picciolli I, et al. Procalcitonin measurements for guiding antibiotic treatment in pediatric pneumonia[J]. Respir Med, 2011, 105(12):1939-1945. |
| [7] | Stocker M, Fontana M, El Helou S, et al. Use of procalcitoninguided decision-making to shorten antibiotic therapy in suspected neonatal early-onset sepsis:prospective randomized intervention trial[J]. Neonatology, 2010, 97(2):165-174. |
| [8] | 王卫平. 儿科学[M]. 第8版. 北京:人民卫生出版社, 2013: 269-287. |
| [9] | 中华医学会儿科学分会呼吸学组; 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013修订)(上)[J]. 中华儿科杂志, 2013, 51(10):745-752. |
| [10] | Baer G, Baumann P, Buettcher M, et al. Procalcitonin guidance to reduce antibiotic treatment of lower respiratory tract infection in children and adolescents (ProPAED):a randomized controlled trial[J]. PLoS One, 2013, 8(8):e68419. |
| [11] | Schuetz P, Kutz A, Grolimund E, et al. Excluding infection through procalcitonin testing improves outcomes of congestive heart failure patients presenting with acute respiratory symptoms:results from the randomized ProHOSP trial[J]. Int J Cardiol, 2014, 175(3):464-472. |
| [12] | Schuetz P, Christ-Crain M, Thomann R, et al. Effect of procalcitonin-based guidelines vs standard guidelines on antibiotic use in lower respiratory tract infections:the ProHOSP randomized controlled trial[J]. JAMA, 2009, 302(10):1059- 1066. |
| [13] | 中华医学会儿科学分会呼吸学组; 《中华儿科杂志》编辑委员会. 急性呼吸道感染抗生素合理使用指南(试行)(下)[J]. 中华儿科杂志, 2001, 39(6):379-384. |
| [14] | British Thoracic Society Standards of Care Committee. British Thoracic Society Guidelines for the Management of Community Acquired Pneumonia in Childhood[J]. Thorax, 2002, 57(Suppl 1):i1-i24. |
| [15] | Nascimento-Carvalho CM, Cardoso MR, Barral A, et al. Procalcitonin is useful in identifying bacteraemia among children with pneumonia[J]. Scand J Infect Dis, 2010, 42(9): 644-649. |
| [16] | Don M, Valent F, Korppi M, et al. Differentiation of bacterial and vital community-acquired pneumonia in children[J]. Pediatr Int, 2009, 51(1):91-96. |
| [17] | Branche AR, Walsh EE, Vargas R, et al. Serum procalcitonin measurement and viral testing to guide antibiotic use for respiratory infections in hospitalized adults:a randomized controlled trial[J]. J Infect Dis, 2015, 212(11):1692-1700. |
 2015, Vol. 17
2015, Vol. 17