2. 武汉市儿童医院呼吸内科, 湖北武汉 430016
支气管哮喘(哮喘)是由多种细胞(包括呼吸道炎性细胞和结构细胞)和细胞组分参与的、 以气流受阻和呼吸道高反应性为特征的慢性炎症性疾病,其主要病理生理机制是呼吸道炎症和呼吸道重塑。维生素D 不仅是钙、磷代谢的重要调节因子,而且还具有抗肿瘤、抗炎、免疫调节、减慢细胞周期、减轻呼吸道重塑等作用[1];半乳糖凝集素-3(galectin-3,Gal-3)是半乳糖凝集素家族的重要成员之一,有参与炎症反应、调节细胞生长、抗凋亡和介导细胞黏附等多种生物学功能[2]。 Dorsch 等[3] 研究显示,对左心室重构患者,维生素D 水平与Gal-3 无明显相关,但Aubin 等[4] 研究却发现,1,25(OH)2D3 可上调大鼠颅骨细胞中Gal-3 表达。本研究拟通过检测哮喘患儿血清25(OH)D3 水平、血清及支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中Gal-3 水平,探讨25(OH)D3 与Gal-3 在哮喘患儿发病机制中的作用及意义。
1 资料与方法 1.1 研究对象选取武汉市儿童医院2013 年1 月至2014 年 12 月呼吸科病房确诊哮喘的50 例患儿为哮喘组,其中男33 例,女17 例;年龄范围1 岁6 个月至 8 岁10 个月,中位年龄5 岁4 个月;体重范围 9.6~28.7 kg,中位体重16.7 kg。所有患儿诊断标准均符合《儿童支气管哮喘诊断与防治指南》(2008 版)[5] 中关于儿童支气管哮喘的诊断标准;并排除严重肝肾疾病合并骨质疏松或甲状腺疾病、1 个月内口服或静脉使用过糖皮质激素或免疫调节剂、 近3 个月内服用维生素D 或钙剂者。根据哮喘患儿血清25(OH)D3 水平不同将50 例哮喘患儿分为维生素D 适当组(>30 ng/mL,n=7)、不足组(20~ 30 ng/mL,n=12)和缺乏组( < 20 ng/mL,n=31)[6]。 选取同期20 例因气道发育畸形(n=6)和支气管异物(n=14)住院的患儿为对照组,其中男15 例、 女5 例;年龄范围10 个月至6 岁3 个月,中位年龄4 岁8 个月;体重范围7.3~23.6 kg,中位体重 12.4 kg。所有患儿近期均无感染和慢性肝肾疾病病史,且排除过敏性和免疫相关性疾病。哮喘组与对照组患儿的性别、年龄、体重等方面比较差异均无统计学意义(χ2=1.186,Z=1.373、1.851,P>0.05)。以上各组患儿均经家长同意并签署知情同意书后行纤维支气管镜术及支气管肺泡灌洗术。
1.2 标本采集所有研究对象均取空腹静脉抗凝血4 mL,室温静置2 h 后以2 000 r/min 离心15 min,留取血清,-70℃冷藏保存待测。哮喘组(所有患儿行纤维支气管镜检查时均处于哮喘缓解期,距前次哮喘发作时间在2 周以上)在完成支气管镜检查后行支气管肺泡灌洗术,均取右肺中叶进行灌洗;对照组取右肺中叶(气道发育畸形)或非异物侧肺作为灌洗部位,当支气管镜嵌入上述部位时,经支气管镜吸引孔注入37℃无菌生理盐水 5~10 mL/ 次进行灌洗2 次,体重 < 20 kg 者,每次灌洗量5~10 mL,共2 次; 体重≥ 20 kg 者,每次灌洗量10 mL,共2 次,灌洗后立即以 100~150 mm Hg 负压进行抽吸,手术操作时间 15~30 min 不等。第1 次灌洗所得BALF 送检病原学培养,其余灌洗液混匀,每份标本均以4℃,1 500 r/min,离心半径13.5 cm,离心10 min,沉渣用于细胞学分析,上清液置于-70℃保存用于细胞因子分析。
1.3 细胞学检查BALF 沉渣采用计数池法行细胞计数,结果以 ×106/mL 表示;细胞分类计数涂片的制备采用涂片法,沉渣涂片后以瑞氏染色法染色,每张涂片计数600 个细胞,取两张涂片的平均值。
1.4 细胞因子检测采用ELISA 法每周集中一次测定血清25(OH)D3 水平、血清总IgE(TIgE)水平、血清和BALF 中 Gal-3 水平,试剂盒由上海江莱生物科技有限公司提供,严格按说明书进行操作。
1.5 统计学分析应用SPSS 17.0 软件对结果进行统计学分析。 正态分布计量资料以均数± 标准差(x± s )表示,两组间均数比较采用t 检验,多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q 检验; 非正态分布计量资料以中位数(四分位数间距) [M(P25,P75)] 表示,多组间比较采用Kruskal Wallis H 检验,组间两两比较采用Nemenyi 法检验; 计数资料以百分率(%)表示,两组间比较采用χ2 检验;相关分析用Pearson 相关或Spearman 相关分析。P < 0.05 为差异有统计学意义。
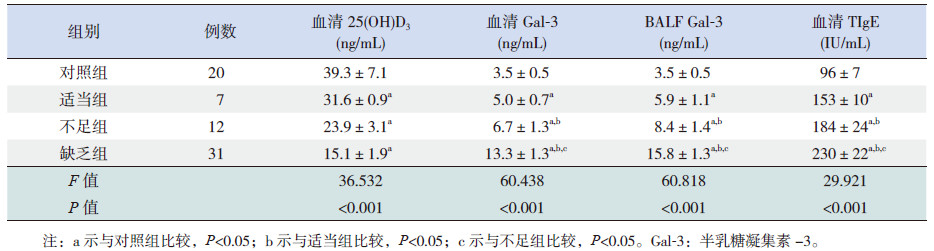
2 结果 2.1 两组患儿血清及BALF 中各指标水平哮喘组患儿血清中25(OH)D3 水平较对照组低 (P <0.001),血清Gal-3、TIgE 水平及BALF 中 Gal-3 水平均较对照组高(P <0.001),见表 1。
| 表 1 两组患儿血清及BALF 中各指标水平比较(x± s) |
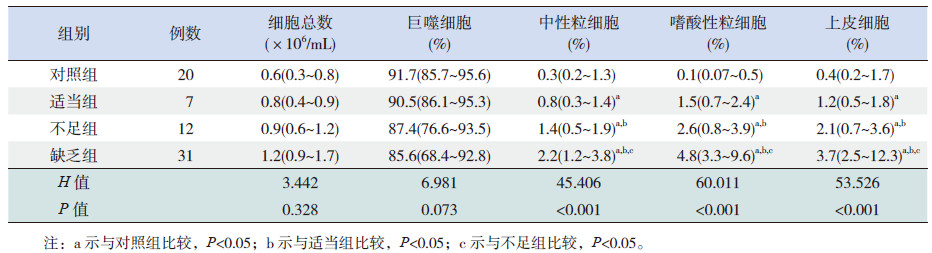
各组患儿BALF 中细胞总数及巨噬细胞计数比较差异无统计学意义(P>0.05);缺乏组、不足组及适当组患儿中性粒细胞、嗜酸性粒细胞及上皮细胞计数均高于对照组(P <0.05);缺乏组中性粒细胞、嗜酸性粒细胞及上皮细胞计数较不足组及适当组增高(P <0.05);不足组患儿中性粒细胞、嗜酸性粒细胞及上皮细胞计数亦高于适当组 (P <0.05)。见表 2。
| 表 2 各组患儿BALF 细胞总数及分类细胞计数比较 [M(P25, P75)] |
缺乏组、不足组及适当组血清及BALF 中 Gal-3 水平、血清TIgE 水平均高于对照组(P <0.05); 缺乏组血清及BALF 中Gal-3 水平、血清TIgE 水平较不足组及适当组增高(P <0.05);不足组血清及BALF 中Gal-3 水平、血清TIgE 水平高于适当组(P <0.05)。见表 3。
| 表 3 各组患儿血清及BALF 中各指标水平比较(x± s) |
随着哮喘患儿血清25(OH)D3 水平的下降,BALF 中中性粒细胞数、嗜酸性粒细胞数及上皮细胞数逐渐升高。秩相关分析显示,血清25(OH)D3 水平与BALF 中中性粒细胞数、嗜酸性粒细胞数及上皮细胞数呈负相关(分别r=-0.683、-0.795、 -0.670,P <0.05)。
哮喘患儿血清25(OH)D3 水平与BALF 中细胞总数、巨噬细胞数无明显相关性(分别r=0.157、 0.137,P>0.05)。
随着哮喘患儿血清25(OH)D3 水平的下降,血清中Gal-3、TIgE 水平逐渐升高。直线相关分析显示,血清中25(OH)D3 水平与血清Gal-3、TIgE 水平呈负相关(分别r=-0.759、-0.875,P <0.05)。
3 讨论随着分子生物学、流行病学的迅速发展,越来越多的研究结果表明,维生素D 不仅在钙和骨骼代谢中发挥着重要作用,还在炎症、感染、免疫等方面同样发挥着极其重要的作用[7]。目前流行病学研究发现,许多肺部疾病包括支气管哮喘、 慢性阻塞性肺疾病、肺纤维化、呼吸道感染、肺结核等均与体内维生素D 水平缺乏有关[8, 9] 。
目前公认的维生素D 不足和缺乏的标准由 Holick [6] 首先报道,一般认为,适当为血清维生素D 水平>30 ng/mL,不足为20~30 ng/mL,而缺乏为 < 20 ng/mL。本研究结果显示,哮喘组患儿血清中25(OH)D3 水平较对照组低,提示哮喘患儿普遍存在维生素D 缺乏或不足现象。Uysalol 等[10] 研究了85 例哮喘患儿和85 例对照组儿童,发现哮喘患儿血清25(OH)D3 水平较对照组低且有统计学意义,与本研究结果一致。Bener 等[11] 也认为,缺乏血清维生素D 是儿童哮喘最强的预测指标,相比血清IgE 水平及哮喘家族史更有预测意义。
哮喘组患儿血清TIgE 水平较对照组高,两组比较有统计学意义,哮喘患儿血清25(OH)D3 水平与TIgE 水平呈负相关(r=-0.875)。结果提示,哮喘患儿血清25(OH)D3 水平增高可以抑制TIgE 的过度表达。马秀丽等[12] 研究了30 例哮喘儿童血清 25(OH)D3 水平与TIgE 的相关性,结果显示支气管哮喘患儿血清25(OH)D3 水平与TIgE 水平呈负相关,与本研究结果相似。
哮喘呼吸道炎症有多种细胞成分和炎性细胞的参与,这些炎性细胞主要包括嗜酸性粒细胞 (EOS)、中性粒细胞(PMN)、巨噬细胞和肥大细胞等。本研究结果显示,不同血清25(OH)D3 水平哮喘患儿及对照组患儿BALF 细胞总数及巨噬细胞数比较差异无统计学意义;但中性粒细胞、嗜酸性粒细胞及上皮细胞数比较差异有统计学意义; 血清25(OH)D3 水平与BALF 中中性粒细胞、嗜酸性粒细胞及上皮细胞数呈负相关,以上结果表明嗜酸性粒细胞、中性粒细胞和上皮细胞等参与了哮喘儿童呼吸道炎性反应,提示增高血清25(OH)D3 水平可以抑制哮喘患儿气道中嗜酸性粒细胞、中性粒细胞等炎性细胞的过度募集。蒋鲲等[13] 检测了中重度、轻度哮喘和对照组儿童BALF 中EOS,发现哮喘组BALF 中EOS 较对照组明显升高。刘佩意等[14] 比较了不同剂量1,25(OH)2D3 对哮喘大鼠模型的影响,发现低、中剂量1,25(OH)2D3 处理组哮喘大鼠BALF 中EOS 数较哮喘组明显降低。Trujillo 等[15] 发现DBP 基因敲除大鼠炎症肺泡中多形核白细胞(PMN)募集程度较野生型大鼠减少约50%,提示维生素D 可能通过血浆中DBP 影响PMN 的募集。Hirsch 等[16] 研究显示,通过减少PMN 中VDR 和1α- 羟化酶的表达,维生素D 在新生儿PMN 中抗感染活性较成人比较明显受损,表明维生素D 是通过PMN 中VDR 和1α- 羟化酶实现其抗感染作用的。
本研究同时显示,哮喘患儿25(OH)D3 缺乏组血清Gal-3 水平为13.3±1.3 ng/mL,不足组为 6.7±1.3 ng/mL,适当组为5.0±0.7 ng/mL,对照组为3.5±0.5 ng/mL; 缺乏组BALF 中Gal-3 水平为 15.8±1.3 ng/mL,不足组为8.4±1.4 ng/mL,适当组为5.9±1.1 ng/mL,对照组为3.5±0.5 ng/mL;组间两两比较差异均有统计学意义;直线相关分析显示,血清中25(OH)D3 水平与Gal-3 水平呈负相关。 表明25(OH)D3 与Gal-3 参与了哮喘的发生、发展,提示增高血清25(OH)D3 水平可以抑制哮喘患儿气道炎性反应。本课题组前期的研究已证实,哮喘患儿血清及BALF 中Gal-3 水平均明显升高,Gal-3 可能参与了哮喘的发生和发展[17],本研究显示,血清中25(OH)D3 水平与Gal-3 水平呈负相关,表明25(OH)D3 与Gal-3 共同参与哮喘患儿呼吸道炎性反应。作用机制可能为:低血清25(OH)D3 水平致呼吸道炎性细胞(中性粒细胞、嗜酸性粒细胞等) 募集,募集的炎性细胞与Gal-3 相互作用,促使炎症细胞释放多种炎症因子(如IL-4、IL-5、IL-13 及TGF-β 等)参与呼吸道炎症反应,引起哮喘发作[18, 19]。Rao 等[20] 已证实,Gal-3 可作为一种细胞间黏附分子,通过与嗜酸性粒细胞可逆性结合,嗜酸性粒细胞可通过附着、滚动等方式,紧密黏附于呼吸道上皮细胞,从而释放炎性因子,导致哮喘发作。
当然,本研究尚具有一定局限性。由于医学伦理学及知情同意的原因,本研究尚缺乏组织病理学证据;由于时间的限制,本研究缺乏补充维生素D 后哮喘患儿血清及BALF 中Gal-3 变化的资料,这都是有待解决的问题。
综上所述,哮喘患儿普遍存在维生素D 缺乏或不足,25(OH)D3 及Gal-3 可能参与了哮喘患儿呼吸道炎性反应,与哮喘发生、发展相关。但 25(OH)D3 及Gal-3 参与哮喘患儿呼吸道炎性反应具体机制,有待更深入的研究。
| [1] | Iqbal SF, Freishtat RJ. Mechanism of action of vitamin D in the asthmatic lung[J]. J Investig Med, 2011, 59(8):1200-1202. |
| [2] | Saegusa J, Hsu DK, Chen HY, et al. Galectin-3 is critical for the development of the allergic inflammatory response in a mouse model of atopic dermatitis[J]. Am J Pathol, 2009, 174(3):922- 931. |
| [3] | Dorsch MP, Nemerovski CW, Ellingrod VL, et al. Vitamin D receptor genetics on extracellular matrix biomarkers and hemodynamics in systolic heart failure[J]. J Cardiovasc Pharmacol Ther, 2014, 19(5):439-445. |
| [4] | Aubin JE, Gupta AK, Bhargava U, et al. Expression and regulation of galectin 3 in rat osteoblastic cells[J]. J Cell Physiol, 1996, 169(3):468-480. |
| [5] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志, 2008, 46(10):745-753. |
| [6] | Holick MF. Vitamin D deficiency[J]. N Engl J Med, 2007, 357(3):266-281. |
| [7] | Reichel H, Koeffler HP, Norman AW, et al. The role of the vitamin D endocrine system in health and disease[J]. N Engl J Med, 1989, 320(15):980-991. |
| [8] | Brehm JM, Schuemann B, Fuhlbrigge AL, et al. Serum vitamin D levels and severe asthma exacerbations in the Childhood Asthma Management Program study[J]. J Allergy Clin Immunol, 2010, 126(1):52-58. |
| [9] | Martineau AR, Timms PM, Bothamley GH, et al. High-dose vitamin D(3) during intensive-phase antimicrobial treatment of pulmonary tuberculosis:a double-blind randomised controlled trial[J]. Lancet, 2011, 377(9761):242-250. |
| [10] | Uysalol M, Mutlu LC, Saracoglu GV, et al. Childhood asthma and vitamin D deficiency in Turkey:is there cause and effect relationship between them?[J]. Ital J Pediatr, 2013, 39:78. |
| [11] | Bener A, Ehlayel MS, Tulic MK, et al. Vitamin D deficiency as a strong predictor of asthma in children[J]. Int Arch Allergy Immunol, 2012, 157(2):168-175. |
| [12] | 马秀丽, 甄艳芬. 支气管哮喘儿童血清25(OH)D3和总免疫球蛋白E的变化[J]. 中国当代儿科杂志, 2011, 13(7):551- 553. |
| [13] | 蒋鲲, 陈和斌, 王莹, 等. IL-17和TGF-β1在支气管哮喘患儿血清及支气管肺泡灌洗液中的变化及临床意义[J]. 中国当代儿科杂志, 2013, 15(8):604-608. |
| [14] | 刘佩意, 陈相, 蒋卓勤, 等. 早期补充维生素D对幼年哮喘大鼠肺组织炎症因子的影响[J]. 中华预防医学杂志, 2011, 45(7):645-649. |
| [15] | Trujillo G, Habiel DM, Ge L, et al. Neutrophil recruitment to the lung in both C5a- and CXCL1-induced alveolitis is impaired in vitamin D-binding protein-deficient mice[J]. J Immunol, 2013, 191(2):848-856. |
| [16] | Hirsch D, Archer FE, Joshi-Kale M, et al. Decreased antiinflammatory responses to vitamin D in neonatal neutrophils[J]. Mediators Inflamm, 2011, 2011:598345. |
| [17] | 蒋鲲, 陈和斌, 王莹, 等. 支气管哮喘患儿血清及支气管肺泡灌洗液中半乳糖凝集素-3和转化生长因子-β1的变化[J]. 临床儿科杂志, 2013, 31(2):113-116. |
| [18] | MacKinnon AC, Farnworth SL, Hodkinson PS, et al. Regulation of alternative macrophage activation by galectin-3[J]. J Immunol, 2008, 180(4):2650-2658. |
| [19] | Fattouh R, Jordana M. TGF-beta, eosinophils and IL-13 in allergic airway remodeling:a critical appraisal with therapeutic considerations[J]. Inflamm Allergy Drug Targets, 2008, 7(4): 224-236. |
| [20] | Rao SP, Wang Z, Zuberi RI, et al. Galectin-3 functions as an adhesion molecule to support eosinophil rolling and adhesion under conditions of flow[J]. J Immunol, 2007, 179(11):7800- 7807. |
 2015, Vol. 17
2015, Vol. 17