新生儿败血症是导致新生儿、尤其是早产儿死亡的主要原因,据流行病学资料统计,足月儿发病率约占1%,极低出生体重儿发病率则高达 20%,早发型败血症病死率为13%,晚发型败血症的病死率为8.9%,极低出生体重儿病死率可达 20% 以上[1, 2, 3]。其易感因素包括母体和环境暴露、 免疫状态和炎症反应。过去几年的研究显示基因功能或表达的变化可以调节上述这些相互作用的因素,但这些研究多集中在成人及儿童[4, 5, 6]。
细菌感染的最初反应是通过细胞表面受体识别病原相关分子模式(pathogen-associated molecular patterns,PAMPs) 实现的。Toll 样受体(toll-like receptor,TLR)是启动先天免疫反应的一类模式识别受体(pattern recognition receptors,PRRs),是机体抵抗病原微生物的第一道屏障,在先天免疫和获得性免疫中发挥重要的抗感染免疫功能[7]。 TLR2 主要识别G+ 菌的成分如肽聚糖和磷壁酸,TLR5 则主要识别G- 菌鞭毛蛋白,TLRs 与配体结合后,跨膜信号通过TLR 胞内结构域激活核因子- κB(NF- κB)并上调肿瘤坏死因子(TNF)等细胞因子的表达,增强机体的炎症反应,达到杀伤病原体的目的[8]。
新生儿免疫系统不成熟,因此功能完善的先天免疫系统对于阻止病原微生物的入侵是至关重要的。研究认为,TLR 某些基因关键位点的突变或序列改变将影响TLR 功能,与新生儿败血症的发生、发展有关,但由于相关研究有限,样本量小,亟需在不同病原的感染和不同的人群中进一步验证[9, 10, 11]。迄今为止,在中国汉族人群中尚未见 TLR 基因多态性和新生儿败血症的研究。根据国际人类单体型计划数据库和文献搜索,我们选择3 个单核苷酸多态性(SNP)位点,TLR2 (rs5743708、 rs3804099) 和TLR5(rs5744105) 进行病例- 对照研究,采用微测序技术检测TLR 基因多态性,旨在寻找新生儿败血症的易感基因,建立预警体系,指导早期个体化治疗。
1 资料与方法 1.1 研究对象选取2011 年5 月至2014 年1 月在无锡市人民医院新生儿科住院的败血症患儿114 例纳入败血症组。纳入标准:(1)具有临床表现并培养出致病菌,如系条件致病菌,则须在另1 次同部位或其他部位培养出同种细菌。(2)具有临床表现并具有非特异性检查结果阳性≥ 2 项。新生儿败血症的诊断依照2003 年中华医学会《新生儿败血症诊疗方案》[12]。同期选取在本院新生儿科住院的非感染性新生儿172 例纳入对照组。非感染性新生儿定义:无胎膜早破或新生儿母亲产前感染病史,无感染临床表现及实验室阳性指标,因其他原因入院的新生儿。败血症组和对照组若出现下列情况之一时被排除:(1)合并严重先天畸形(如染色体异常和先天性心脏病等);(2)合并遗传代谢性疾病。本研究获得无锡市人民医院伦理委员会讨论通过,所有患儿家长均已签署知情同意书。
1.2 DNA 提取两组患儿均采集静脉全血2 mL EDTA 抗凝,-70℃冰箱保存。按DNA 试剂盒(上海生工生物工程技术服务有限公司)的操作说明提取DNA,-20℃冰箱保存。
1.3 引物设计及合成根据GenBank 提供的基因序列和有关文献,应用Primer Premier 5 软件设计PCR 引物,委托上海捷瑞公司合成。rs5743708 位点上游引物: 5'-GTGAGTGGTGCAAGTATGAAC-3',下游引物: 5'-AACCTAGGACTTTATCGCAGC-3',片段长度 27 bp。rs3804099 位点上游引物:5'-AGAGTGGGAAATATGGACACC- 3',下游引物: 5 ' - T C T C G C A G T T C C A A A C A T T C C - 3 ' ,片段长度33 bp。rs5744105 位点上游引物: 5'-TCTTCCTTGGAAAAGGGAGAC-3',下游引物: 5'-TGTGTTTTCACAGGAGCATGG-3' ,片段长度 36 bp。反应体系(15 μL):DNA 1 μL,10×buffer 1.5 μL,MgCl2(25 mmol/L)1.5 μL,dNTP 0.3 μL,上下游引物共0.15 μL,Taq 酶0.3 μL,加双蒸水至 15 μL。扩增条件:95℃预变性3 min;94℃变性 15 s,60℃退火15 s,72℃延伸30 s,至-0.5℃,共11 个循环;94 ℃ 变性15 s,54 ℃ 退火15 s,72℃延伸30 s,共24 个循环;72℃再延伸3 min。
1.4 PCR 产物纯化总反应体系为7 μL,包括PCR 产物3 μL,外切酶Exo Ⅰ 0.2 μL,Sap 0.2 μL(大连TaKaRa),Exo Ⅰ buffer 0.7 μL,去离子水2.9 μL。反应条件: 30 ℃ 孵育45 min,80 ℃ 终止反应15 min 以灭活 Exo Ⅰ,4℃保存。
1.5 SNaPshot 延伸反应及测序总反应体系为6 μL,包括PCR 产物 2 μL,SNaPshot Mix 试剂1 μL,延伸上下游引物各1 μL,双蒸水2 μL。反应条件:96℃预变性1 min;96℃ 变性10 s,52℃退火5 s,60℃延伸30 s,共30 个循环。取1 μL 延伸产物,加8 μL 高度去离子甲酰胺,95℃变性3 min,立即冰水浴,移至测序仪检测荧光信号。根据峰的颜色可知掺入的碱基种类,从而确定该样本的基因型,根据峰移动的胶位置确定该延伸产物对应的SNP 位点,应用GeneMaper 3.0 软件进行数据分析。
1.6 统计学分析用SPSS 19.0 统计软件对数据进行统计学分析。采用频率计数法计算败血症组和对照组TLR2 (rs5743708)、TLR2(rs3804099)、TLR5(rs5744105) 基因多态性,然后经Hardy-Weinberg 遗传平衡定律检验。等位基因及基因型频率用百分率(%)表示,两组间比较采用卡方检验,若1 ≤理论频数 < 5,使用连续校正卡方检验。应用logistic 回归模型分析TLR 基因多态性与败血症的关系。P <0.05 为差异有统计学意义。
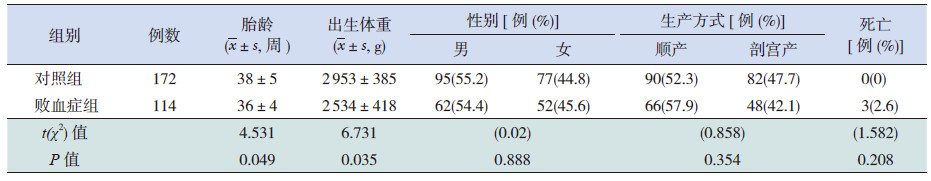
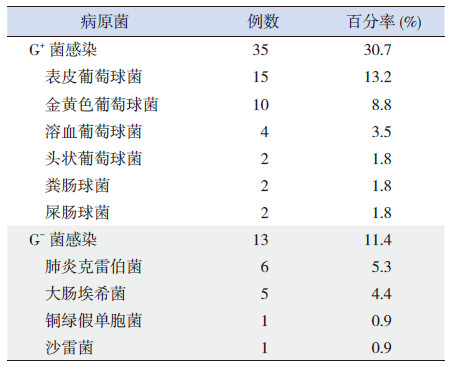
2 结果 2.1 资料的一般情况败血症组胎龄和出生体重均低于对照组 (P <0.05),性别、生产方式和病死率在两组间比较差异无统计学意义(P>0.05,表 1)。病原学(血培养)结果显示,败血症组G+ 菌感染占30.7%,其中表皮葡萄球菌和金黄色葡萄球菌检出率分别为13.2% 和8.8%;G- 菌感染占11.4%,其中肺炎克雷伯菌和大肠埃希菌为主要致病菌,检出率分别为5.3% 和4.4%。见表 2。
| 表 1 两组新生儿的临床资料比较 |
| 表 2 败血症组病原菌分布 (n=114) |
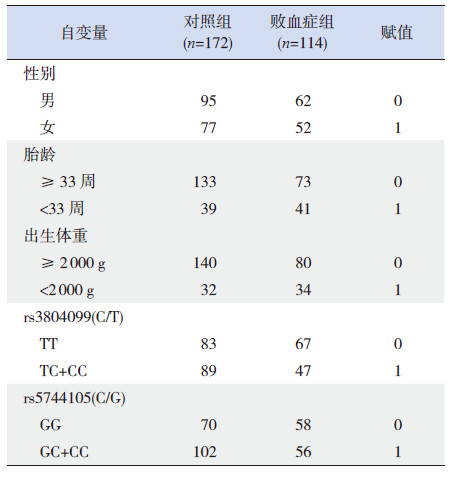
对照组与败血症组TLR2 基因rs3804099 位点基因型分布均符合Hardy-Weinberg 平衡定律(分别χ2=1.167、0.489,P>0.05);各基因型在败血症组与对照组中分布的差异有统计学意义(P <0.05)。 TLR5 基因rs5744105 位点在对照组与败血症组中的基因型分布均符合Hardy-Weinberg 平衡定律 ( 分别χ2=0.817、0.042,P>0.05); 各基因型在败血症组与对照组中分布的差异有统计学意义 (P <0.05)。TLR2 基因rs5743708 位点在对照组与败血症组中所有基因型均为GG 型,未发现突变。 rs3804099 位点和rs5744105 位点等位基因频率在两组间分布差异均无统计学意义(P>0.05)。见表 3。
| 表 3 各位点基因型及等位基因在各组中的分布情况 [ 例(%)] |
35 例血培养示G+ 菌感染患儿rs3804099 位点的TT、TC、CC 基因型频率分别为71%(25/35)、 23%(8/35)、6%(2/35),其各基因型分布与对照组相比差异有统计学意义(χ2=6.469,P=0.044)。13 例血培养示G- 菌感染患儿 rs5744105 位点的GG、GC、CC 基因型频率分别为62%(8/13)、31%(4/13)、8%(1/13),其各基因型分布与对照组相比差异无统计学意义 (χ2=2.165,P=0.339)。
2.3 多因素logistic 回归分析以新生儿败血症为应变量,性别、胎龄、出生体重、SNP 位点rs3804099 和rs5744105 为自变量,应用多因素logistic 回归分析致新生儿败血症的危险因素,自变量赋值及各组例数分布情况见表 4。
| 表 4 新生儿败血症危险因素的logistic 回归分析模型量 化方案及例数分布 |
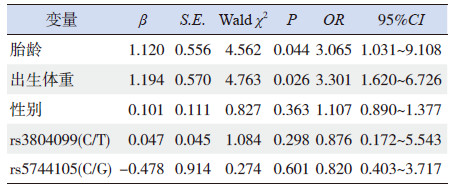
Logistic 回归分析结果显示低胎龄(OR=3.065,P <0.05)、低出生体重(OR=3.301,P <0.05)是新生儿败血症发病的危险因素;性别(OR=1.107,P>0.05)、rs3804099(C/T)(OR=0.876,P>0.05) 和rs5744105(C/G)(OR=0.820,P>0.05)基因多态性不是新生儿败血症发病的危险因素。见表 5。
| 表 5 新生儿败血症危险因素的logistic 回归分析结果 |
人类90% 的遗传信息是由基因SNP 所引起的,随着基因组学研究的深入,遗传背景对人类非遗传性疾病的发生、发展的影响日益受到重视。研究证实,基因多态性是决定人体对应激易感性与耐受性、临床表型多样性及药物治疗反应差异性的重要因素[7]。目前关于基因多态性与新生儿败血症易感性的研究有限,因此亟需在中国汉族人群中进行相关候选基因的研究。
新生儿败血症发病机制复杂,涉及致病菌、 机体的先天免疫和获得性免疫功能及多方面下游事件的相互作用最终导致器官功能障碍或死亡,机体对入侵病原体的免疫防御功能受基因调控所改变是可能的发病机制之一。机体识别入侵微生物最重要的方式是通过模式识别受体(PRRs)来迅速识别大量不同PAMPs 并做出应答。TLR 是启动先天免疫反应的一类PRRs,是一组与先天免疫密切相关的受体家族[13]。迄今发现哺乳动物TLR 家族主要有10 种受体(TLR1~10),分布于不同的免疫细胞表面,不同TLR 识别病原谱不同,TLR2 主要识别G+ 菌的成分如肽聚糖和磷壁酸,TLR5 则主要识别G- 菌鞭毛蛋白,但是,结合后引起的信号传导通路几乎是相同的,最终引起炎症介质和抗炎介质的生成。
SNP 主要是指在基因组水平上由单个碱基的缺失、插入或置换导致的单碱基突变频率大于1%。 某些SNP 可以影响基因的转录以及转录后翻译,从而影响所表达蛋白质的量甚至结构和功能。某些SNP 发生在非编码区域或不能引起蛋白质改变的编码区域。虽然一个基因内存在多个SNP 位点,但多数研究集中于某几个位点,而实际上对不同 SNP 位点进行整体研究,即由这些不同SNP 构成的单倍型,更利于发现基因与疾病或某种表型的相关性。
TLR2 基因位于染色体4p32,包含3 个外显子。 其中rs3804099 位于第3 外显子第199 位氨基酸,是标签SNP,在一定程度上可以代表该位点临近区域的其他SNPs。rs3804099(C/T)突变不引起氨基酸的改变,为同义突变。rs5743708 位于内含子753 位氨基酸,A/G 突变引起精氨酸变成谷氨酰胺,为非同义突变。TLR5 基因位于染色体1q41,多态性位点rs5744105 位于内含子,5548 号核苷酸C/G 突变引起内含子变化。
本研究在无锡地区汉族人群中评价了TLR2 基因rs3804099、rs5743708 位点和TLR5 rs5744105 位点与新生儿败血症易感性的关系,发现携带 rs3804099、rs5744105 和rs5743708 基因型与新生儿败血症的发生无明显相关。Abu-Maziad 等[9] 在美国爱荷华州儿童医院募集535 名早产儿进行研究,发现TLR2 基因rs3804099 多态性改变与早产儿对G+ 菌败血症的易感性有关。Esposito 等[11] 在意大利米兰募集299 名早产儿进行研究,未发现 rs3804099 与早产儿败血症的易感性有关。这说明不同人群、种族基因SNP 存在显著差异。Sampath 等[10] 在408 例极低出生体重儿(包含90 例细菌培养阳性的败血症患儿)的研究中发现,rs5743708 与极低出生体重儿发生败血症无明显关系。单小鸥等[14] 通过研究提出rs5743708 多态性与温州地区汉族儿童致命性阳性细菌感染尚无明显的相关性。本研究结果与上述研究一致,说明rs5743708 在无锡地区汉族人群突变发生率低。有报道TLR2 基因rs5743708 多态性与早产有关[15],但目前其与新生儿败血症的易感性尚无明确关系。另有研究报道TLR2 基因rs5743708 位点A/G 突变使机体对葡萄球菌易感性增加[16, 17]。Nachtigall 等[18] 纳入 145 例德国成人ICU 患者,发现携带rs5743708 突变基因的杂合子发生严重败血症和败血症休克的起病时间缩短。分析本研究与上述研究结果不同的主要原因可能与研究群体不同有关。
在我国,大肠埃希菌和铜绿假单胞菌是引起新生儿败血症的常见G- 菌[19],两者均具有鞭毛,TLR5 能够识别细菌鞭毛蛋白上由13 个氨基酸残基所组成的PAMPs,结合后激活NF-κB 信号转导通路,产生TNF-α,IL-6,IL-8 等炎症细胞因子,在细菌鞭毛诱导的炎症应答过程中起着核心作用,与脓毒症的发生和发展密切相关[20, 21]。Abu-Maziad 等[9] 研究显示TLR5 基因 rs5744105 多态性与新生儿大肠埃希菌和铜绿假单胞菌败血症有关。另有研究发现TLR5(rs5744168)基因多态性与军团菌肺炎有关[22]。王志富等[23] 对TLR5 基因的其他3 个 SNP 位点(rs5744168、rs5744174 和rs2072493) 与成人脓毒症发生风险及疾病严重程度的相关性进行研究,认为TLR5 基因上述多态性位点可能在成人脓毒症的发生、发展和病程转归中不发挥重要作用。Sampath 等[10] 研究认为rs5744168 与极低出生体重儿发生败血症无明显关系。
综上,我们对TLR2(rs5743708、rs3804099) 和TLR5(rs5744105)基因多态性与新生儿败血症的易感性进行关联研究,结果表明,低胎龄、 低出生体重与新生儿败血症的发生密切相关; rs5743708、rs3804099 和rs5744105 可能不是新生儿败血症的易感基因,携带rs5743708、rs3804099 和rs5744105 基因型的个体并未增加罹患新生儿败血症的风险。由于本研究样本量较小,因此需要大规模的合作,在多中心大样本的研究中进一步证实。
| [1] | Mehta K, Bhatta NK, Majhi S, et al. Oral zinc supplementation for reducing mortality in probable neonatal sepsis:a double blind randomized placebo controlled trial[J]. Indian Pediatr, 2013, 50(4):390-393. |
| [2] | Tiskumara R, Fakharee SH, Liu CQ, et al. Neonatal infections in Asia[J]. Arch Dis Child Fetal Neonatal Ed, 2009, 94(2): F144-F148. |
| [3] | Stoll BJ, Hansen NI, Bell EF, et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network[J]. Pediatrics, 2010, 126(3):443-456. |
| [4] | Netea MG, Wijmenga C, O'Neill LA. Genetic variation in Tolllike receptors and disease susceptibility[J]. Nat immunol, 2012, 13(6):535-542. |
| [5] | Wong HR. Genetics and genomics in pediatric septic shock[J]. Crit Care Med, 2012, 40(5):1618-1626. |
| [6] | Jabandziev P, Smerek M, Michalek J, et al. Multiple gene-togene interactions in children with sepsis:a combination of five gene variants predicts outcome of life-threatening sepsis[J]. Crit Care, 2014, 18(1):R1. |
| [7] | Skevaki C, Pararas M, Kostelidou K, et al. Single nucleotide polymorphisms of Toll-like receptors and susceptibility to infectious diseases[J]. Clin Exp Immunol, 2015, 180(2):165- 177. |
| [8] | Kawasaki T, Kawai T. Toll-like receptor signaling pathways[J]. Front Immunol, 2014, 5:461. |
| [9] | Abu-Maziad A, Schaa K, Bell EF, et al. Role of polymorphic variants as genetic modulators of infection in neonatal sepsis[J]. Pediatr Res, 2010, 68(4):323-329. |
| [10] | Sampath V, Mulrooney NP, Garland JS, et al. Toll-like receptor genetic variants are associated with Gram-negative infections in VLBW infants[J]. J Perinatol, 2013, 33(10):772-777. |
| [11] | Esposito S, Zampiero A, Pugni L, et al. Genetic polymorphisms and sepsis in premature neonates[J]. PLoS One, 2014, 9(7): e101248. |
| [12] | 中华医学会儿科学分会新生儿学组, 《中华医学会中华儿科杂志》编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12):897-899. |
| [13] | Akira S, Uematsu S, Takeuchi O. Pathogen recognition and innate immunity[J]. Cell, 2006, 124(4):783-801. |
| [14] | 单小鸥, 吴颖, 叶璟, 等. 温州地区汉族儿童脓毒症与Toll 样受体基因多态性[J]. 中华儿科杂志, 2010, 48(1):15-18. |
| [15] | Krediet TG, Wiertsema SP, Vossers MJ, et al. Toll-like receptor 2 polymorphism is associated with preterm birth[J]. Pediatr Res, 2007, 62(4):474-476. |
| [16] | Sutherland AM, Walley KR, Russell JA. Polymorphisms in CD14, mannose-binding lectin, and Toll like receptor-2 are associated with increased prevalence of infection in critically ill adults[J]. Crit Care Med, 2005, 33(3):638-644. |
| [17] | Moore CE, Segal S, Berendt AR, et al. Lack of association between Toll-like receptor 2 polymorphisms and susceptibility to severe disease caused by Staphylococcus aureus[J]. Clin Diagn Lab Immunol, 2004, 11(6):1194-1197. |
| [18] | Nachtigall I, Tamarkin A, Tafelski S, et al. Polymorphisms of the toll-like receptor 2 and 4 genes are associated with faster progression and a more severe course of sepsis in critically ill patients[J]. J Int Med Res, 2014, 42(1):93-110. |
| [19] | 王政力, 余加林. 新生儿败血症诊断新进展[J]. 中国当代儿科杂志, 2013, 15(3):236-240. |
| [20] | Rolli J, Loukili N, Levrand S, et al. Bacterial flagellin elicits widespread innate immune defense mechanisms, apoptotic signaling, and a sepsis-like systemic inflammatory response in mice[J]. Crit Care, 2010, 14(4):R160. |
| [21] | Kawai T, Akira S. The role of pattern-recognition receptors in innate immunity:update on Toll-like receptors[J]. Nat Immunol, 2010, 11(5):373-384. |
| [22] | Hawn TR, Verbon A, Lettinga KD, et al. A common dominant TLR5 stop codon polymorphism abolishes flagellin signaling and is associated with susceptibility to legionnaires' disease[J]. J Exp Med, 2003, 198(10):1563-1572. |
| [23] | 王志富, 周钢桥, 方宇, 等. Toll样受体5基因多态性与中国人群脓毒症的相关性研究[J]. 医学分子生物学杂志, 2009, 6(4):325-330. |
 2015, Vol. 17
2015, Vol. 17