蛋白尿作为一个独立危险因素在慢性肾脏病进展过程中发挥重要作用,肾间质纤维化是此过程的最终病理表现[1],其中肾小管上皮细胞向间充质细胞转化,即上皮细胞-间充质细胞转变(epithelial-mesenchymal transformation, EMT)是形成肾间质纤维化(TIF)的主要机制之一[2]。多种细胞因子参与EMT的调控,包括转化生长因子-β1(transforming growth factor-β1, TGF-β1)和骨形成蛋白-7(bone morphogenetic protein-7, BMP-7),一般认为,BMP-7具有维持肾小管上皮细胞表型、并逆转EMT的作用[3]。
同源盒基因(homeobox gene, HOX)在控制发育、调控动物的器官发生和细胞分化中起关键作用[4],且与肾脏发生发展等密切相关[5]。同源盒基因A13(Homeobox A13, HOXA13)是HOX基因家族成员,其基因突变可导致四肢和泌尿生殖系统发育异常[6]。研究表明HOXA13参与了抑制肾脏纤维化途径[7],也可抑制促EMT因子TGF-β1介导的转录活性[8]。HOXA13可能参与调节EMT及TIF,但具体机制尚不清楚。
本研究拟通过人血清白蛋白(human serum albumin, HSA)刺激人肾小管上皮细胞(HKC),观察细胞形态变化及EMT相关指标如上皮细胞标志物角蛋白(CK)、间充质细胞标志物波形蛋白(vimentin)的变化,探讨HOXA13在人血清白蛋白诱导肾小管上皮细胞EMT发生中的作用,在此过程中进一步探讨BMP-7的变化情况及其与HOXA13变化的关系。
1 材料与方法 1.1 主要材料与试剂主要材料与试剂包括:HKC细胞株(来自于中国科学院细胞库);人血清白蛋白(美国Sigma公司);DMEM高糖培养基(美国Hyclone公司);胎牛血清(上海Gibco公司);胰蛋白酶(美国Hyclone公司);兔抗人HOXA13单克隆抗体(美国Santa Cruz公司);兔抗人CK单克隆抗体(美国 Proteintech公司);兔抗人vimentin单克隆抗体(美国 Proteintech公司);兔抗人CBP单克隆抗体(美国 Proteintech公司);兔抗人GR单克隆抗体(美国 Proteintech公司);兔抗BMP-7多克隆抗体(美国Abcam公司);兔抗人β-actin单克降抗体(美国 Proteintech公司);辣根过氧化物酶(HRP)标记羊抗兔IgG和羊抗鼠IgG(美国Proteintech公司);脂质体2000(美国 Invitrogen公司);组织细胞蛋白裂解液RIPA(上海碧云天生物技术有限公司);质粒pGV230-eGFP-HOXA13(上海吉凯基因化学技术有限公司)。
1.2 细胞培养与干预HKC细胞株培养于含10%胎牛血清的DMEM高糖培养基中,培养条件为温度37℃,含5%CO2。用胰蛋白酶消化后接种于6孔培养板中,待细胞达到80%融合,换成无血清培养基培养24 h,使细胞同步于静止期后,其中1组细胞换成含20 mg/mL HSA的无血清培养基培养48 h(HSA组);不含HSA培养的细胞为对照组。每组至少重复3次。
1.3 细胞免疫化学方法用普通培养基及含20 mg/mL HSA的DMEM高糖培养基培养细胞48 h达80%融合时,将细胞用甲醇固定,3%H2O2、灭活内源性过氧化物酶、正常小牛血清封闭,滴加一抗(1 : 200) 4℃过夜,次日滴加二抗,DAB显色,苏木素复染。实验独立重复3次。
1.4 质粒转染转染具体操作参考脂质体2000说明书进行。质粒转染细胞分为3组:未转染HKC+20 mg/mL HSA组(简称未转染组);转染质粒pGV230-eGFP-HOXA13的HKC+20 mg/mL HSA组(简称HOXA13转染组);转染质粒pGV230-eGFP空载体的HKC+20 mg/mL HSA组(简称阴性对照转染组)。每组设3个平行样本。
1.5 免疫印迹分析将HKC细胞加入100 μL预冷的组织细胞裂解液(使用前加入l : 100的PMSF)冰上裂解30 min。4℃12 000 r/min 离心5 min,上清液移入新的0.5 mL EP管中,用BCA蛋白检测试剂盒测定蛋白浓度。取变性的蛋白50 μg/孔,用相应浓度的SDS-PAGE胶进行电泳。恒压下将蛋白转至PVDF膜,5%脱脂奶粉封闭1 h,分别加入一抗(vimentin 1 : 1 000;HOXA13、CK 1 : 200;BMP-7 1 : 500;β-actin 1 : 4 000),4℃过夜。PBST洗膜3次,加入对应的HRP标记IgG(1 : 4 000)孵育1 h。PBST洗膜3次后显影,将PVDF膜固定在Kodak暗箱,采用Kodak IS4000凝胶成像分析系统曝光扫描和分析结果,以所测得各条带的吸光度与内参照β-actin吸光度的比值代表表达量值。实验独立重复3次。
1.6 统计学分析应用SPSS 22.0统计软件进行统计学分析。计量资料用均数±标准差( x±s)表示,两组间比较采用成组t检验,多组间比较采用单因素方差分析,多个样本均数的两两比较采用SNK-q检验。对有相关趋势的变量采用Pearson相关分析。P<0.05示差异有统计学意义。
2 结果 2.1 细胞培养形态学观察相差显微镜观察结果显示,在普通培基中正常生长的HKC细胞为近圆形,呈鹅卵石样且与邻近的细胞连接紧密,贴壁生长(图 1A);经20 mg/mL HSA 刺激48 h后,HKC细胞逐渐变为梭形,甚至向周边伸出伪足样突起,细胞间连接逐渐稀疏(图 1B)。
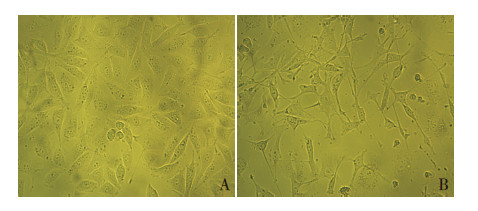 |
图 1 细胞培养形态学观察(光镜,×200) A:正 常HKC 细胞,细胞呈鹅卵石样贴壁生长;B:20 mg/mL HSA 刺激 HKC 细胞48 h 后细胞呈梭形贴壁生长。 |
细胞免疫组化结果显示:对照组HKC细胞CK表达明显,主要位于细胞膜,平均光密度值0.048±0.013;20 mg/mL HSA 刺激48 h后,CK表达明显下调,平均光密度值0.021±0.009(图 2);与对照组比较,HSA组CK染色的平均光密度值明显降低(t=23.41,P=0.004)。
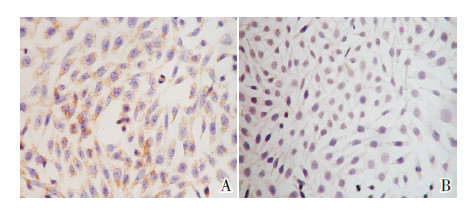 |
图 2 细胞免疫组化检测CK 蛋白的表达(DAB 显色, ×400) A 为对照组,B 为HSA 组。HSA 组CK 阳性表达较对照组明显减少。棕黄色为CK 阳性表达部位。 |
对照组HKC细胞vimentin阳性表达少,平均光密度值为0.0022±0.0009;HSA刺激48 h后,vimentin表达明显增加,主要分布于细胞质,平均光密度值0.041±0.013(图 3);HSA组vimentin染色的平均光密度值与对照组比较明显增加,(t=29.48,P=0.001)。
 |
图 3 细胞免疫组化检测vimentin 蛋白的表达(DAB 显色,×400) A 为对照组,B 为 HSA 组。HSA 组vimentin 阳性表达较对照组明显增多。棕黄色为vimentin 阳性表达部位。 |
免疫印迹分析结果显示:HSA组HKC细胞CK蛋白相对表达量(0.15±0.01)明显低于对照组(0.53±0.05)(t=12.12,P=0.008),而vimentin蛋白表达在HSA组的相对表达量(0.51±0.01)明显高于对照组(0.44±0.02)(t=22.12,P=0.009)(图 4)。
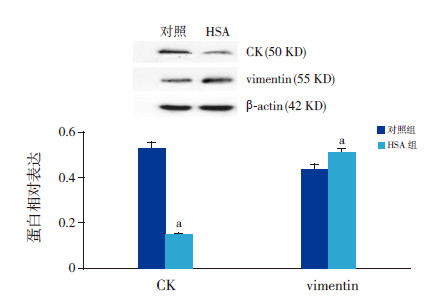 |
图 4 HSA 超载对HKC 细胞CK 和vimentin 蛋白表 达的影响 上图为电泳条带结果:HSA 组HKC 细胞CK 蛋白表达低于对照组,而vimentin 蛋白表达高于对照组。下图为统计结果(n=3):a 示与对照组比较,P<0.01。 |
免疫印迹分析结果显示:HSA组HKC细胞HOXA13蛋白相对表达水平(0.16±0.01)较对照组(0.47±0.02)明显降低(t=2.45,P=0.001);BMP-7蛋白表达在HSA组的相对表达量(0.28±0.02)亦明显低于对照组(0.76±0.05)(t=10.21,P=0.004)(图 5)。
 |
图 5 HSA 超载对HKC 细胞HOXA13 和BMP-7 蛋白表达的影响 上图为电泳条带结果:HSA 组HKC 细胞 HOXA13 和BMP-7 蛋白表达均低于对照组。下图为统计结果(n=3): a 示与对照组比较,P<0.01。 |
在20 mg/mL HSA这一浓度刺激HKC的48 h过程中,HOXA13蛋白表达与BMP-7蛋白表达呈正相关(r=0. 85,P=0.004)(图 6)。
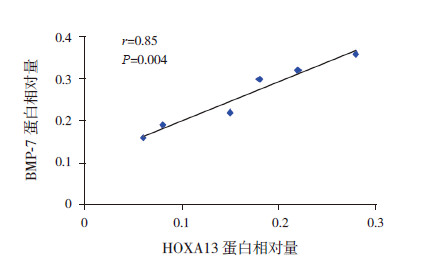 |
图 6 HSA 超载HKC 细胞 HOXA13 与BMP-7 蛋白表达的相关关系 |
质粒转染的3组细胞HOXA13蛋白的相对表达量比较差异有统计学意义(F=24.54,P=0.015),其中HOXA13转染组HKC细胞HOXA13蛋白相对表达(0.75±0.04)较未转染组(0.41±0.01)和阴性对照转染组(0.42±0.02)明显升高(分别P=0.002、0.005),而阴性对照转染组与未转染组比较差异无统计学意义(图 7)。
 |
图 7 HKC 细胞质粒转染效果鉴定(免疫印迹) 上图为电泳条带结果:HOXA13 转染组HOXA13 蛋白表达高于未转染组和阴性对照转染组。下图为统计结果(n=3):a 示与未转染组及阴性对照转染组比较,P<0.01。 |
免疫印迹分析结果显示:质粒转染的3组细胞CK蛋白相对表达比较差异有统计学意义(F=32.14,P=0.006),其中HOXA13转染组CK蛋白相对表达(0.54±0.06)与未转染组(0.15±0.01)及阴性对照转染组(0.16±0.01)比较均明显上升(分别P=0.004、0.001),而未转染组与阴性对照转染组间比较差异无统计学意义(P>0.05)。3组vimentin蛋白相对表达比较差异有统计学意义(F=51.22,P=0.004),其中HOXA13转染组vimentin蛋白相对表达(0.33±0.02)较未转染组(0.51±0.04)及阴性对照转染组(0.52±0.03)比较均显著下降(分别P=0.021、P=0.007),而未转染组与阴性对照转染组间比较差异无统计学意义(图 8)。
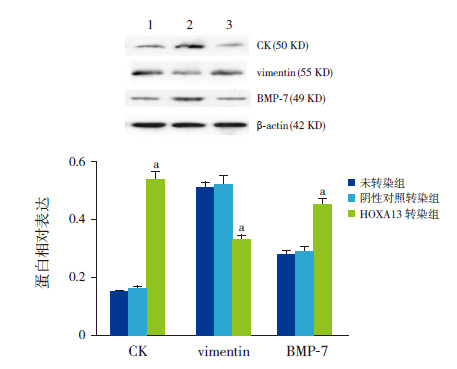 |
图 8 HOXA13 转染对HSA 超载的HKC 细胞CK、vimentin 和BMP-7 蛋白表达的影响 上图为电泳条带结果:1 为未转染组,2 为HOXA13 转染组,3 为阴性对照转染组。与阴性对照转染组和未转染组比较,HOXA13 转染组CK 和BMP-7 蛋白表达较高,而vimentin 表达较低。下图为统计结果(n=3):a示与未转染组及阴性对照转染组比较,P<0.05。 |
免疫印迹分析结果显示:质粒转染的3组细胞BMP-7蛋白相对表达比较差异有统计学意义(F=28.58,P=0.009),其中HOXA13转染组BMP-7蛋白相对表达量(0.45±0.03)与未转染组(0.28±0.03)及阴性对照转染组(0.29±0.02)比较,均明显上升(分别P=0.004、P=0.022),而未转染组与阴性对照转染组间比较差异无统计学意义(图 8)。
3 讨论白蛋白是蛋白尿的主要成分,而蛋白尿是引起小管间质损伤及TIF的独立危险因素,是促进EMT发生的重要介质之一[9]。本研究结果表明,白蛋白超载HKC后,HKC逐渐失去自身原有的细胞形态,并获得了成纤维细胞样的细胞形态[10]。本研究在预实验HSA不同浓度(0、10、20、30 mg/mL)和不同时间(0、12、24、48、72 h)刺激HKC培养的基础上,选定20 mg/mL HSA刺激HKC 48 h,结果发现HKC细胞逐渐丧失其上皮细胞标记物—CK的表达逐渐下降,而间充质细胞标记物逐渐显现—vimentin的表达逐渐增高,上皮细胞也逐渐转变为梭形。以上结果说明白蛋白超载诱导了肾小管上皮细胞间充质转化,即发生了EMT。
HOX是一类在进化上高度保守的基因,作为脊椎动物生长发育和细胞分化的主控基因,在中枢神经系统、中轴骨、胃肠道、尿殖管、外生殖器和肢体发育中均具有重要作用。哺乳动物HOX基因有39个,分为HOXA、HOXB、HOXC和HOXD 4簇,每簇又按照基因序列的同源性分为13个组,分别定位于不同染色体的特定区域。HOXA13为A簇13号基因,在哺乳动物胚胎发育中起重要作用,且与肢体的形成及生殖发育相关[11]。有研究认为,HOXA13具有抑制肾纤维化的作用,能够抑制TGF-β1介导的转录活性[7, 8]。然而,HOXA13在肾小管上皮细胞EMT以及TIF发生中的作用尚不清楚。本研究在证明白蛋白超载能够诱导HKC细胞发生EMT的同时,发现伴随着EMT的发生及HKC细胞内HOXA13的表达降低。为了阐明HOXA13在白蛋白超载诱导肾小管上皮细胞EMT中的作用,本研究通过基因转染技术上调HKC细胞内的HOXA13表达,继而观察HOXA13过表达对白蛋白超载所致EMT的影响,结果显示脂质体转染上调HKC细胞内HOXA13表达后,过表达的HOXA13能够显著减轻HSA所诱导的HKC细胞CK表达的减少以及vimentin表达的增加,提示HOXA13过表达具有抑制白蛋白超载诱导HKC细胞发生EMT的作用。
BMP-7 是一种在胚胎期肾脏发育过程中调控间充质-上皮细胞转化的重要细胞因子,可维持肾小管上皮细胞表型[12],具有拮抗内源性TGF-β1的作用[13]。有研究发现,HOXA13突变小鼠中BMP-7表达下降[14, 15],提示HOXA13具有调节BMP-7表达的作用。本研究结果显示:在HSA诱导人肾小管上皮细胞发生EMT过程中,HOXA13和BMP-7表达同步下降;而基因转染HOXA13 过表达能够抑制白蛋白超载所致的BMP-7下降、即HOXA13过表达具有上调BMP-7表达的作用。BMP-7作为与肾原性间充质毗连的间质细胞群的存活因子,可减少致炎细胞因子和生长因子的分泌,逆转肾小管上皮细胞EMT过程,进而减轻已形成的肾纤维化[12]。据此推测HOXA13 过表达逆转EMT 进程可能系通过促进BMP-7 表达而发挥作用,其具体机制尚待进一步研究。
综上所述,转染核转录因子HOXA13抑制白蛋白超载诱导HKC细胞发生EMT的作用可能与HOXA13上调BMP-7表达有关。
| [1] | Eddy AA. Overview of the cellular and molecular basis of kidney fibrosis[J]. Kidney Int Suppl (2011), 2014, 4(1):2-8. |
| [2] | Prunotto M, Budd DC, Gabbiani G, et al. Epithelialmesenchymal crosstalk alteration in kidney fibrosis[J]. J Pathol, 2012, 228(2):131-147. |
| [3] | Wang Z, Zhao J, Zhang J, et al. Protective effect of BMP-7 against aristolochic acid-induced renal tubular epithelial cell injury[J]. Toxicol Lett, 2010, 198(3):348-357. |
| [4] | Quinonez SC, Innis JW. Human HOX gene disorders[J]. Mol Genet Metab, 2014, 111(1):4-15. |
| [5] | Wellik DM. HOX genes and kidney development[J]. Pediatr Nephrol, 2011, 26(9):1559-1565. |
| [6] | Parker L, Mangwani J, Wakeling E, et al. Hallux valgus interphalangeus and a novel mutation in HOXA13. Part of the broadening spectrum of Hand-Foot-Genital syndrome[J]. Foot Ankle Surg, 2011, 17(2):e28-e30. |
| [7] | Hamasaki Y, Doi K, Okamoto K, et al. 3-Hydroxy-3- methylglutaryl-coenzyme A reductase inhibitor simvastatin ameliorates renal fibrosis through HOXA13-USAG-1 pathway[J]. Lab Invest, 2012, 92(8):1161-1170. |
| [8] | Williams TM, Williams ME, Heaton JH, et al. Group 13 HOX proteins interact with the MH2 domain of R-Smads and modulate Smad transcriptional activation functions independent of HOX DNA-binding capability[J]. Nucleic Acids Res, 2005, 33(14):4475-4484. |
| [9] | Ibrini J, Fadel S, Chana RS, et al. Albumin-induced epithelial mesenchymal transformation[J]. Nephron Exp Nephrol, 2012, 120(3):e91-e102. |
| [10] | 姜莹, 李晓燕, 何庆南, 等. 白蛋白超载对人肾小管上皮细胞EMT及激素耐药相关因素的影响[J]. 中国现代医学杂志, 2010, 20(21):3299-3308. |
| [11] | Imagawa E, Kayserili H, Nishimura G, et al. Severe manifestations of hand-foot-genital syndrome associated with a novel HOXA13 mutation[J]. Am J Med Genet A, 2014, 164A(9):2398-2402. |
| [12] | Li RX, Yiu WH, Tang SC. Role of bone morphogenetic protein-7 in renal fibrosis[J]. Front Physiol, 2015, 6:114. |
| [13] | 李小琴, 郑玲芳. 新生儿呼吸窘迫综合征患儿血清TGF-β1及BMP-7的表达及意义[J]. 中国当代儿科杂志, 2015, 17(5): 445-448. |
| [14] | Morgan EA, Nguyen SB, Scott V, et al. Loss of BMP7 and Fgf8 signaling in Hoxa13-mutant mice causes hypospadia[J]. Development, 2003, 130(14):3095-3109. |
| [15] | Knosp WM, Scott V, Bachinger HP, et al. HOXA13 regulates the expression of bone morphogenetic proteins 2 and 7 to control distal limb morphogenesis[J]. Development, 2004, 131(18): 4581-4592. |
 2015, Vol. 17
2015, Vol. 17


