长链非编码RNA(long non-coding RNA, lncRNA)是一类长度超过200个碱基的非编码RNA分子[1],它们能在转录前、转录中和转录后多个层面调节蛋白编码基因的表达。脑组织中存在一些特有的lncRNA[2],且在进化越高级的哺乳动物脑组织中,lncRNA的含量越高,越复杂[3],提示lncRNA可能在脑发育及高级认知功能进化过程中起着重要作用。研究表明,lncRNA参与了神经系统的多种生理病理学过程,如神经系统发育[4]、脑卒中[5]、阿尔兹海默症[6]等。目前,关于lncRNA与缺氧缺血性脑病的研究鲜有报道。在缺氧缺血模型的研究中,本课题组采用基因表达谱芯片技术发现,lncRNA BC088414在缺氧缺血后脑组织中的表达增加,且BC088414的表达与肾上腺素能受体β2(β2-adrenergic receptor, Adrb2)和半胱氨酸蛋白酶6(caspase 6, Casp6)的表达呈正相关,提示BC088414可能通过调节Adrb2和Casp6的表达在缺氧缺血脑损伤中发挥作用。为证实这一观点,本研究拟采用氧糖剥夺(oxygen glucose deprivation, OGD)法处理大鼠肾上腺噬铬细胞瘤(pheochromocytoma, PC12)细胞,建立体外神经细胞缺氧缺血损伤模型,探讨BC088414与缺氧缺血神经细胞损伤的关系。
1 材料与方法 1.1 主要试剂DMEM、0.25%胰蛋白酶液和胎牛血清购自美国GIBCO公司;Ⅰ型胶原酶购自美国SIGMA公司;小分子干扰RNA(small interfering RNA,siRNA)分子由上海吉玛制药技术有限公司合成;X-treme GENE siRNA转染试剂和TUNEL凋亡检测试剂购自德国ROCHE公司;TRIzol购自美国INTROGEN公司;RNA反转录试剂盒及荧光定量PCR试剂盒购自美国FERMENTAS公司;所有引物的设计与合成由苏州金唯智生物科技有限公司完成;荧光显微镜(Nickon,日本),Image Pro Plus 4.5图像分析软件(Media Cybernetics公司,美国)。
1.2 PC12细胞培养PC12细胞用DMEM(含10%胎牛血清)培养于Ⅰ型胶原酶包被的细胞培养瓶中,置于CO2培养箱中,于37℃、5% CO2饱和湿度下培养。待细胞生长至80%融合时,用0.25%胰蛋白酶液消化传代,用于后续实验。
1.3 siRNA转染PC12细胞针对BC088414序列不同区域设计合成3种不同的siRNA分子,即siR-1、siR-2、siR-3,序列见表 1,将细胞以6×104/mL接种于6孔板中,置于37℃、5% CO2培养箱中培养。待细胞生长至80%融合时进行转染。分为6组,即空脂质体对照组(空白对照组)、与BC088414无序列同源性的阴性对照组(阴性对照组)、siR-1组、siR-2组、siR-3组和3种siRNA共同转染的siR-C组,每组6个复孔,实验重复3次。
1.4 PC12细胞OGD模型制备将PC12细胞分为4组,即与BC088414无同源序列的阴性对照常氧组(常氧组)、阴性对照氧糖剥夺组(OGD组)、siRNA常氧组(siRNA组)和siRNA氧糖剥夺组(siRNA OGD组),每组3个复孔,实验重复3次。OGD组弃去培养液,用PBS洗涤2次,更换为无葡萄糖无血清DMEM培养液;于37℃、1%O2+99%N2/CO2条件下培养6 h,即缺氧缺血6 h。6 h后终止缺氧,并更换为含葡萄糖和10%胎牛血清的DMEM培养基,以形成再灌注。再灌注后24 h,进行后续实验。
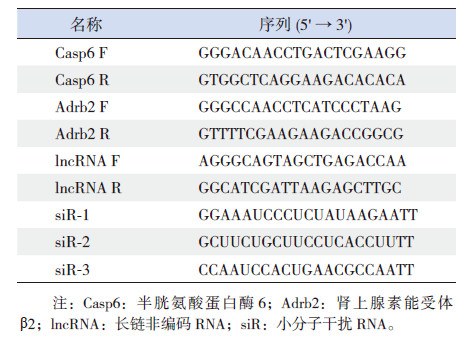
1.5 实时定量PCR用TRIzol法提取总RNA,按照试剂盒说明书将RNA逆转录为cDNA。定量PCR反应体系为10 μL,其中cDNA 2 μL,2×Master Mix 0.5 μL,10 μM的上下游引物各0.5 μL,加ddH2O至10 μL。反应条件:95℃预变性10 min;95℃变性10 s,60℃退火60 s,40个循环。扩增反应结束后,95℃ 10 s,60℃ 60 s,95℃ 15 s,以建立PCR产物的熔解曲线。数据采用公式2-△△Ct方法计算。引物序列见表 1。
| 表 1 引物及siRNA 序列 |
将PC12细胞接种于Ⅰ型胶原酶包被的细胞爬片上。OGD 6 h、复氧24 h后,按照TUNEL细胞凋亡检测说明书检测PC12细胞凋亡情况。即细胞经4%新鲜多聚甲醛固定、0.3%过氧化氢/甲醇作用、0.1%Triton X-100通透处理后,滴加TUNEL反应液,37℃反应1 h,DAPI作用5 min,封片。荧光显微镜下观察(激发波长450~500 nm,检测波长515~565 nm),每组观察3张细胞爬片,每张细胞爬片随机观察3~4个视野,计数凋亡细胞。计算凋亡指数(apoptosis index, AI)=(凋亡细胞数/总细胞数)×100%。
1.7 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差( x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果 2.1 缺氧缺血损伤后PC12细胞中BC088414、Adrb2和Casp6 mRNA的表达及细胞凋亡情况TUNEL结果表明,常氧组偶见凋亡阳性细胞,而OGD组凋亡阳性细胞数明显增加(图 1),OGD组凋亡指数(49.06±0.55)明显高于常氧组(1.54±0.14,t=84.31,P<0.01),说明缺氧缺血诱导PC12细胞凋亡发生。
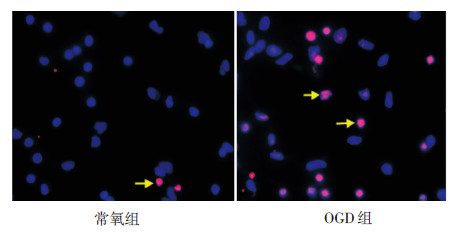 |
图 1 TUNEL 法检测PC12 细胞凋亡结果(DAPI,×400) 常氧组偶见凋亡细胞,OGD 组细胞凋亡数明显增多。凋亡细胞如箭头所示。 |
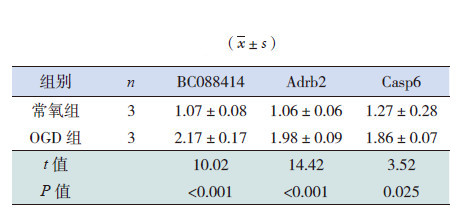
OGD处理后,PC12细胞中lncRNA BC088414表达水平明显高于常氧组(P<0.001),且Adrb2和Casp6 mRNA水平也显著高于常氧组(均P<0.05),见表 2。
| 表 2 OGD 对PC12 细胞BC088414、Adrb2 和Casp6 mRNA 表达的影响 |
BC088414 siRNA分子转染PC12细胞后24 h,采用实时定量PCR法检测lncRNA BC088414的表达。结果表明,空白对照组(1.00±0.19)、阴性对照组(1.15±0.12)、siR-1组(0.67±0.07)、siR-2组(1.21±0.34)、siR-3组(1.32±0.19)和siR-C组(0.41±0.03)lncRNA BC088414的表达水平比较差异有统计学意义(F=82.88,P=0.046),与空白对照组相比,siR-1组和siR-C组BC088414的表达明显降低(P<0.05),其中3种siRNA分子(siR-C组)同时转染PC12细胞对BC088414的抑制率高达60%,而阴性对照组、siR-2组和siR-3组BC088414的表达与空白对照组比较无明显变化(P>0.05,图 2)。因此,采用3种siRNA分子同时转染进行后续实验。
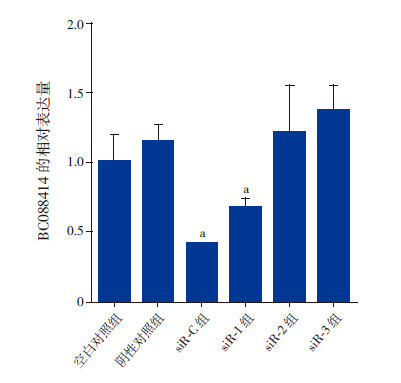 |
图 2 不同siRNA 分子对lncRNA BC088414 表达的影响(n=3) a 示与空白对照组相比,P<0.05。 |
siRNA转染24 h后进行OGD处理,24 h后收集细胞采用荧光定量PCR检测BC088414、Adrb2和Casp6的mRNA表达。结果发现,常氧组(1.054±0.052)、siRNA组(0.472±0.095)、OGD组(1.669±0.432)和siRNA OGD组(0.661±0.018)lncRNA BC088414的表达水平比较差异有统计学意义(F=18.70,P=0.044),其中与常氧组相比,siRNA组BC088414的表达水平显著下降(P<0.05);与OGD 组相比,siRNA OGD组BC088414的表达水平亦显著降低(P<0.05)。见图 3。
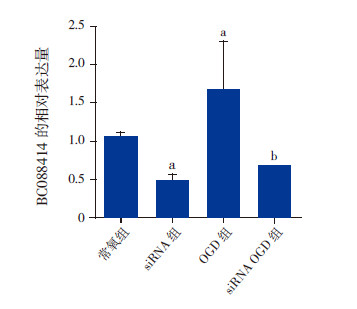 |
图 3 敲除BC088414 在常氧和氧糖剥夺条件下对BC088414 表达的影响(n=3) a 示与常氧组相比,P<0.05;b 示与OGD 组相比,P<0.05。 |
与常氧组相比,siRNA组Adrb2和Casp6 mRNA的表达均明显减少(P<0.01),表明抑制BC088414表达,可抑制Adrb2和Casp6 mRNA的表达;与OGD组相比,siRNA OGD组Adrb2和Casp6 mRNA的表达均降低(P<0.05),表明敲除BC088414可抑制OGD诱导的Adrb2和Casp6 mRNA表达上调。见表 3和图 4。
| 表 3 抑制BC088414 对PC12 细胞中Adrb2 和Casp6 mRNA 表达的影响 |
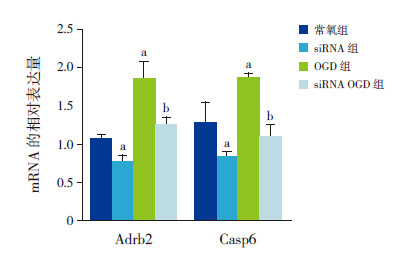 |
图 4 敲除BC088414 在常氧和氧糖剥夺条件下对 Adrb2 和Casp6 mRNA 表达的影响(n=3) a 示与常氧组 相比,P<0.05;b 示与OGD 组相比,P<0.05。 |
TUNEL结果表明,OGD组PC12细胞凋亡指数为53%±5%,siRNA OGD组细胞凋亡指数为34%±3%。与OGD组相比,siRNA OGD组凋亡细胞数明显减少(t=4.931,P=0.039),说明沉默BC088414基因可抑制OGD诱导的PC12细胞凋亡。见图 5。
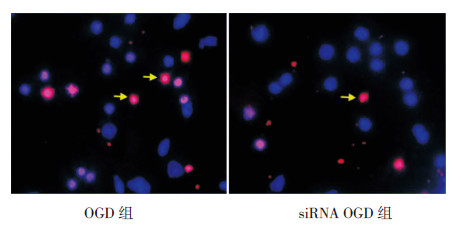 |
图 5 抑制BC088414 对PC12 细胞凋亡的影响(TUNEL 法,DAPI,×400) OGD 组凋亡细胞较多,siRNA OGD 组凋亡细胞数明显减少。箭头所示为凋亡细胞。 |
新生儿缺氧缺血性脑病(hypoxia ischemia encephalopathy, HIE)是引起新生儿期死亡和严重神经损害的主要原因[7],重症患儿病死率高,存活者多留有神经系统后遗症如脑瘫、智力障碍等。其发病机制及神经细胞损伤后的修复机制尚不完全清楚,临床缺乏特异治疗方法。因此,探讨缺氧缺血性脑病的发病及修复机制,对临床治疗HIE具有重要意义。
细胞凋亡是HIE引起的神经元死亡的主要方式,这使其成为药物治疗HIE的重要靶点。细胞凋亡调控涉及一系列基因的激活、表达和调控过程。研究表明,lncRNA在X染色体沉默、基因表达调控和染色体表观修饰等多种重要的细胞调控过程中起着重要作用[8]。因此,探讨细胞凋亡调控的lncRNA机制可能为深入阐明缺氧缺血脑损伤的发病及修复机制奠定基础。
本课题组曾采用基因芯片技术筛查了缺氧缺血大鼠脑组织和假手术大鼠脑组织中lncRNA和mRNA的表达,发现缺氧缺血后脑组织中lncRNA和mRNA的表达谱发生了显著改变,其中,lncRNA BC088414和Adrb2、Casp6 mRNA的表达均增加。编码-非编码基因共表达网络分析结果表明,BC088414与Adrb2和Casp6的表达呈正相关。本研究中,我们也发现在体外培养PC12神经细胞中,lncRNA BC088414与Adrb2和Casp6 mRNA的表达呈类似改变。采用siRNA分子抑制lncRNA BC088414 后,PC12细胞中Adrb2和Casp6表达减少,而且,BC088414 siRNA还可以降低OGD诱导的Adrb2和Casp6 mRNA表达水平。这些结果进一步证实,在缺氧缺血神经细胞中lncRNA BC088414表达上调,BC088414可促进Adrb2和Casp6 mRNA表达。
β肾上腺素能受体是一类七跨膜螺旋G偶联受体,它们是介导中枢肾上腺素能介质的主要受体之一。脑组织中存在β1、β2和β3三种受体亚型。目前,关于脑β肾上腺素能受体的研究还很缺乏。Mizuki等[9]在成年沙土鼠的研究中,发现阻断左颈总动脉后24 h,脑组织中β肾上腺素能受体明显减少。而在本研究中,无论在新生大鼠缺氧缺血脑损伤动物模型还是在体外培养PC12 OGD模型中,均发现Adrb2 mRNA明显增加。这种差异可能是由于两种模型采用的实验动物和造模方法等不同导致缺氧缺血时β受体的变化机制不尽相同所致。研究表明,Adrb2在脑卒中或脑缺血引起的神经细胞凋亡中起着非常重要的作用。有研究报道,敲除Adrb2基因,可促进小鼠脑组织中热休克蛋白72(heat shock protein 72, Hsp72)表达[10],下调促凋亡蛋白Noxa表达或阻断NF-κB激活[11],抑制细胞坏死和凋亡,从而使脑梗死体积变小、神经功能损伤减轻。本研究中,抑制BC088414表达使OGD后PC12细胞中Adrb2 mRNA水平明显降低,细胞凋亡显著减少。因此,我们推测BC088414具有促进细胞凋亡的作用,其部分机制可能是促进Adrb2表达。
半胱氨酸蛋白水解酶(caspases)在介导细胞凋亡的过程中起着非常重要的作用。Casp6又称为Mch2,是caspase家族的一员,属于凋亡效应分子。研究表明,Casp6在神经变性疾病,如脑卒中[12]、脑缺氧缺血损伤[13]、亨丁顿舞蹈症和阿尔兹海默病[14]中起着非常重要的作用。业已证实,在缺氧缺血脑损伤中,Casp6可通过激活死亡受体6裂解细胞骨架蛋白介导细胞死亡[15]。敲除Casp6基因能减轻缺血引起的神经损害。本研究中,抑制BC088414可降低PC12细胞中Casp6 mRNA水平,抑制OGD诱导的PC12细胞凋亡,提示BC088414可能通过调节Casp6的表达发挥促凋亡作用。
综上,这些研究结果证实,在体外培养神经细胞中,缺氧缺血会引起lncRNA BC088414表达上调,上调的BC088414可能通过促进Adrb2和Casp6的表达促进神经细胞凋亡,这些发现或将为发现缺氧缺血神经细胞损伤发病及修复的新机制提供理论支持,为寻求临床治疗缺氧缺血性脑病提供新靶点。
| [1] | Derrien T, Johnson R, Bussotti G, et al. The GENCODE v7 catalog of human long noncoding RNAs:analysis of their gene structure, evolution, and expression[J]. Genome Res, 2012, 22(9):1775-1789. |
| [2] | Lv J, Cui W, Liu H, et al. Identification and characterization of long non-coding RNAs related to mouse embryonic brain development from available transcriptomic data[J]. PLoS ONE, 2013, 8(8):e71152. |
| [3] | Clark BS, Blackshaw S. Long non-coding RNA-dependent transcriptional regulation in neuronal development and disease[J]. Front Genet, 2014, 5:164. |
| [4] | Mercer TR, Qureshi IA, Gokhan S, et al. Long noncoding RNAs in neuronal-glial fate specification and oligodendrocyte lineage maturation[J]. BMC Neurosci, 2010, 11:14. |
| [5] | Dharap A, Nakka VP, Vemuganti R. Effect of focal ischemia on long noncoding RNAs[J]. Stroke, 2012, 43(10):2800-2802. |
| [6] | Modarresi F, Faghihi MA, Patel NS, et al. Knockdown of BACE1-AS nonprotein-coding transcript modulates betaamyloid-related hippocampal neurogenesis[J]. Int J Alzheimers Dis, 2011, 2011:929042. |
| [7] | Wachtel EV, Hendricks-Mu?oz KD. Current management of the infant who presents with neonatal encephalopathy[J]. Curr Probl Pediatr Adolesc Heath Care, 2011, 41(5):132-153. |
| [8] | Batista PJ, Chang HY. Long noncoding RNAs:cellular address codes in development and disease[J]. Cell, 2013, 152(6):1298- 1307. |
| [9] | Mizuki T, Kobayashi H, Ueno S, et al. Differential changes in alpha- and beta-adrenoceptors in the cerebral cortex and hippocampus of the Mongolian gerbil after unilateral brain ischemia[J]. Stroke, 1995, 26(12):2333-2337. |
| [10] | Han RQ, Ouyang YB, Xu L, et al. Postischemic brain injury is attenuated in mice lacking the beta2-adrenergic receptor[J]. Anesth Analg, 2009, 108(1):280-287. |
| [11] | White RE, Palm C, Xu L, et al. Mice lacking the β2 adrenergic receptor have a unique genetic profile before and after focal brain ischaemia[J]. ASN Neuro, 2012, 4(5):pii:e00096. |
| [12] | Akpan N, Serrano-Saiz E, Zacharia BE, et al. Intranasal delivery of caspase-9 inhibitor reduces caspase-6-dependent axon/ neuron loss and improves neurological function after stroke[J]. J Neurosci, 2011, 31(24):8894-8904. |
| [13] | Baburamani AA, Miyakuni Y, Vontell R, et al. Does caspase-6 have a role in perinatal brain injury?[J]. Dev Neurosci, 2015, 37(4-5):321-337. |
| [14] | Wang XJ, Cao Q, Zhang Y, et al. Activation and regulation of caspase-6 and its role in neurodegenerative diseases[J]. Annu Rev Pharrnacol Toxicol, 2015, 55:553-572. |
| [15] | Nikolaev A, McLaughlin T, O'Leary DD, et al. APP binds DR6 to trigger axon pruning and neuron death via distinct caspases[J]. Nature, 2009, 457(7232):981-989. |
 2015, Vol. 17
2015, Vol. 17