新生儿肠穿孔是新生儿严重的急腹症之一,病死率高达 40%~70%[1],是严重威胁患儿生命的临床问题。本病往往由多种病因综合作用所致,以新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)所致穿孔最常见,而特发性肠穿孔则较少见[1,2]。由于特发性肠穿孔发病机制目前尚未明了,且在疾病早期缺乏明显的症状与体征,影像学上无特异性表现,因此术前很难鉴别特发性肠穿孔与 NEC 穿孔。现对因气腹症行剖腹探查术确诊为新生儿肠穿孔的 101 例患儿的临床资料进行总结,并对特发性肠穿孔和 NEC 穿孔患儿的临床资料进行对比分析,报告如下。 1 资料与方法
1.1 研究对象及方法
2000 年 1 月至 2014 年 6 月我院新生儿重症监护病房共收治临床诊断为新生儿气腹症患儿 126例,其中放弃手术治疗 25 例,行剖腹探查术确诊为肠穿孔的共有 101 例。对剖腹探查术确诊为肠穿孔的 101 例患儿的临床资料,包括一般资料、病因、穿孔部位、并发症、致病菌、病死率相关因素等进行回顾性分析。 1.2 统计学分析
采用 SPSS 19.0 统计软件进行统计学分析。计数资料采用百分率表示,组间比较采用χ2检验或 Fisher确切概率法。正态分布的计量资料采用均值 ± 标准差(x±s)表示,两样本间均值比较采用独立样本t检验;非正态分布计量资料采用中位数和四分位数间距 [P50(P25,P75)] 表示,组间比较采用独立样本 Mann-Whitney U检验。死亡的危险因素进行logistic 多元回归分析。P<0.05 示差异有统计学意义。2 结果
2.1 一般情况
纳入分析的 101 例患儿中,男 74 例,女 27 例;出生胎龄 24+4~41+5周,平均胎龄 36±4 周,其中胎龄<37周者53例,≥37周者48例;出生体重 700~4 200 g,平均 2 531±914 g,其中出生体重<2 500 g 者 45 例,≥ 2 500 g 者 56 例。入院年龄 0.5 h至 28 d,中位年龄 4 d。临床诊断穿孔到手术时间<4 h 者 72 例,4~8 h(包括 8 h)者 15 例,>8 h 者14 例。出生时有明确窒息史者 14 例。 2.2 新生儿肠穿孔病因、穿孔部位和常见并发症
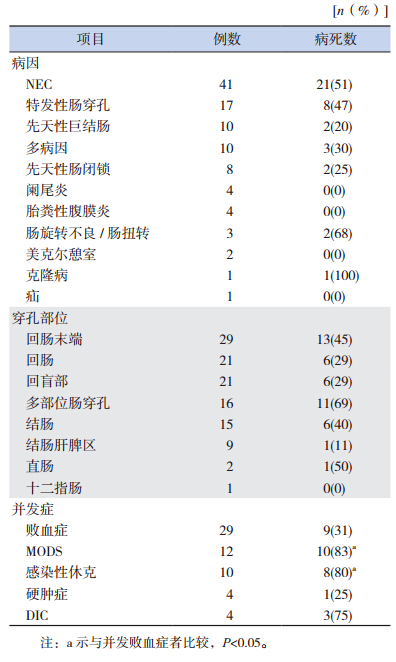
101 例新生儿肠穿孔中原发病因主要为 NEC(41 例,40.6%),其次为特发性肠穿孔(17 例,16.8%)、先天性巨结肠(10 例,9.9%),具体见表 1。穿孔部位中最常见的是回肠末端,共 29 例,其次是结肠及结肠肝脾区(24 例),具体见表 1。
肠穿孔常见并发症依次为败血症、多器官功能障碍综合征(MODS)、感染性休克、弥散性血管内凝血(DIC)、硬肿症(表 1)。病死率以并发 MODS 患儿最高,达 83%,其次是并发感染性休克(80%),并发 MODS、感染性休克患儿的病死率高于并发败血症者(P<0.05),其余并发症者两两比较差异均无统计学意义(P=0.05),见表 1。
| 表 1 新生儿肠穿孔病因、穿孔部位和常见并发症与病死率 |
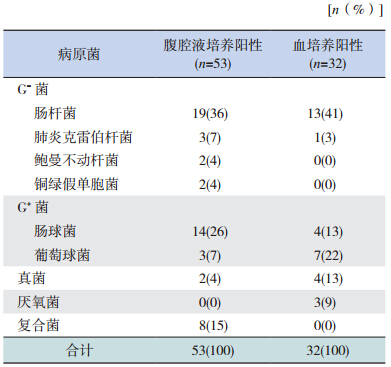
84 例患儿行腹腔液病原菌培养,结果 53 例阳性。阳性病例中G+菌 17 株(17/53,32%),其中肠球菌 14 株,葡萄球菌 3 株;G-菌 26 株(26/53,49%),其中肠杆菌19 株,肺炎克雷伯杆菌3株;真菌 2 株(2/53,4%);复合菌 8 株(8/53,15%)。85 例患儿行血液培养,阳性 32 例,与腹腔液培养同时阳性 23 例,其中与腹腔液培养结果一致的有 12 例。腹腔液和血液培养阳性病原菌分布见表 2。
| 表 2 患儿腹腔液和血液培养阳性病原菌分布情况 |
特发性肠穿孔组腹腔液培养致病菌中G+菌1例(肠球菌),G-菌 9 例(肠杆菌 5 例、铜绿假单胞菌 2 例、肺炎克雷伯菌 2 例)。NEC 穿孔组G+菌 13 例,均为肠球菌;G-菌 6 例(肠杆菌 5 例、鲍曼不动杆菌 1 例);复合菌 4 例。特发性肠穿孔组与 NEC 穿孔组病原菌分布不同(χ2=11.558,P=0.003)。 2.4 特发性肠穿孔组与 NEC 肠穿孔组临床资料的比较
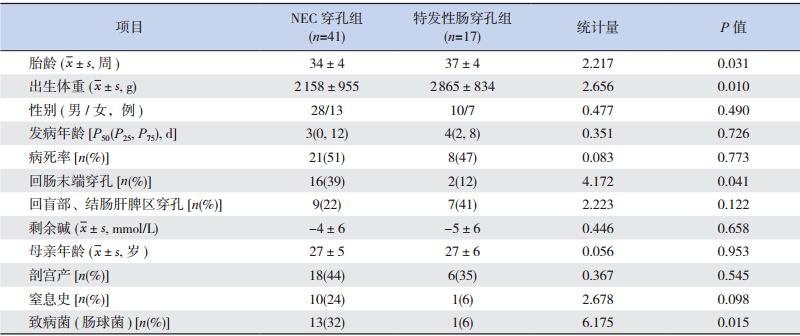
特发性肠穿孔组患儿平均出生体重及平均胎龄均明显大于 NEC 穿孔组(P=<0.05);两组回肠末端穿孔发生率和致病菌分布的比较差异有统计学意义(P=<0.05);但 NEC 穿孔组与特发性肠穿孔组在性别、发病年龄、病死率、剩余碱、母亲年龄、出生方式、窒息史等方面的比较中,差异无统计学意义(P=0.05),见表 3。
| 表 3 NEC 穿孔组与特发性肠穿孔组临床资料的比较 |
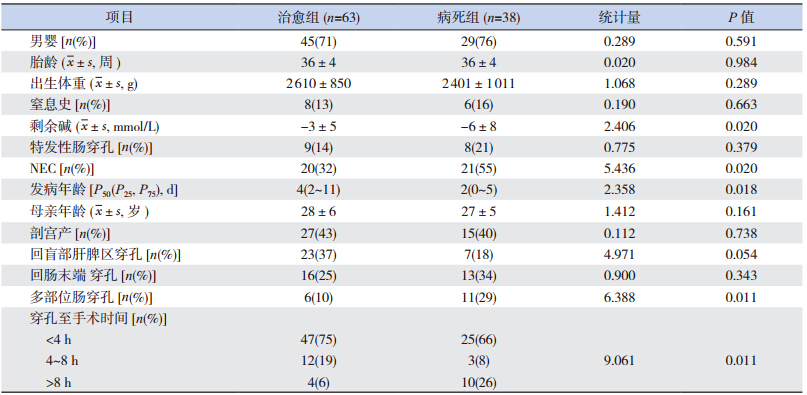
101 例患儿均行剖腹探查,有 63 例存活,38例死亡,病死率为 37.6%。术中可见腹腔内游离浑浊黄色液或胎粪 50~300 mL 不等。术后治愈组与病死组临床特点的比较见表 4,两组性别、胎龄、出生体重、窒息史、母亲年龄、出生方式、特发性肠穿孔比例等比较差异无统计学意义(P=0.05),但在酸中毒严重程度、NEC 比例、发病年龄、临床诊断穿孔至手术时间、多部位肠穿孔率等方面两组比较差异有统计学意义(均P<0.05)。
| 表 4 治愈组与病死组临床特点的比较 |
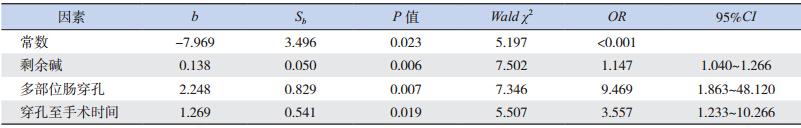
对上述单因素分析两组差异有统计学意义的指标,即剩余碱、NEC、发病年龄、多部位肠穿孔、穿孔至手术时间进行多因素 logistic 回归分析,发现剩余碱(酸中毒)、多部位肠穿孔、穿孔至手术时间较长是新生儿肠穿孔死亡的独立危险因素(P<0.05),见表 5。
| 表 5 死亡相关危险因素的 logistic 回归分析结果 |
新生儿肠穿孔的病因及发病机制至今仍未完全明了,目前一般认为是多因素综合作用的结果,其常见病因包括梗阻性肠穿孔,如肠闭锁、肠旋转不良、美克尔憩室、胎粪性肠梗阻、疝等;肠壁病变性肠穿孔,如 NEC、阑尾炎、克隆病等;特发性肠穿孔,指无原发疾病、无外伤史、而肠道本身也无原发病变的穿孔[3]。
近年来随着早产儿存活率的提高、高危儿病死率的下降,NEC 的发病率逐年上升。NEC 肠穿孔的高危因素包括早产、感染、摄食、缺血、氧合不足、损伤、血管内置管和免疫因素等,20%~60% 的 NEC 患儿需要手术治疗[4]。本组资料中新生儿肠穿孔原发病因为 NEC 者达 41 例,占 40.6%,是新生儿肠穿孔的主要病因,这与既往报道结果一致[1];NEC 肠穿孔患儿中早产儿 29 例(71%),有窒息史 10 例(24%),腹腔液培养阳性25 例(61%),其中致病菌为肠球菌的有13 例,早产、窒息缺氧、感染等高危因素可能导致了NEC 肠穿孔。
目前国内外大多数学者认为特发性肠穿孔与NEC 肠穿孔是两种截然不同的临床疾病,有着不同的疾病特点[1,2,3,4,5,6,7]。本研究结果显示,特发性肠穿孔组平均出生体重及平均胎龄均大于 NEC 穿孔组,此结果与国内郭卫红等[2]、王献良等[6] 的报道相似,但与 Coates 等[7] 报道的结果相反,即特发性肠穿孔多见于体重和胎龄较低的早产儿,这可能与国外对于极低、尤其是超低出生体重儿的积极救治而且成活率较高有关,而国内大多超低出生体重儿放弃治疗,使该一群体在新生儿重症监护室救治所占比例很低。我院姜娜等[8] 报道2008年1月至 2012 年 12 月间收住新生儿重症监护病房的超早产儿 118 例,而统计同期收住入院新生儿病人为 14 537 人次,超早产儿仅占住院新生儿的 0.81%。
特发性肠穿孔较为罕见,本研究中 2000 年 1 月至2014 年 6 月间共收治特发性肠穿孔患儿 17 例,每年 1~2 例,与郭卫红等[2] 报道相似。特发性肠穿孔与 NEC 肠穿孔致病菌不同,Coates 等[7] 报道,NEC 肠穿孔以肠杆菌为主,特发性肠穿孔以念珠菌、凝固酶阴性葡萄球菌为主;特发性肠穿孔出生体重及胎龄均小,更容易发生真菌感染。而本研究中 NEC 肠穿孔患儿肠球菌比例明显高于其他菌种。分析其原因,可能源于致病菌分布具有明显的地域差异,既往发达国家主要以B 族溶血性链球菌(GBS)为主,其次是大肠杆菌,由于近年来加强对 GBS 的防治,GBS 的感染率已下降,因此大肠杆菌感染的比例上升。随着我国新生儿医学的发展,近年来有创操作如脐静脉置管、经外周中心静脉置管增多,新生儿血路感染革兰阳性菌逐步增多[9],GBS 感染率有显著上升趋势[10]。也门、几内亚等最不发达地区革兰阴性菌占血培养阳性的 97.8%,肺炎克雷伯菌居首位,假单胞菌次之[11]。住院时间长的患儿为真菌感染的高危人群,本组病例真菌感染率低于国外其他文献报道[7],主要可能与本组资料与国外相比,新生儿平均胎龄和体重较大有关。另外我们提倡尽早胃肠内喂养,严格掌握抗生素、皮质醇等药物使用指征,在使用抗生素时间较长的患儿使用预防剂量抗真菌药物预防真菌感染,可能降低了真菌感染发生率和耐药菌株的出现[11]。
本组资料中,41% 的特发性肠穿孔发生于回盲部和结肠肝脾曲,推测回盲部、脾曲、乙状结肠直肠交界区在解剖结构上为肠管的 3 个特殊部位,血运供应处于边缘动脉分布变异较多的区域,甚至可有发育不全或缺如,造成这些区域对缺血损伤比较敏感,成为穿孔的好发部位,血压降低或局部血流灌注减少可引起非钳闭性缺血损伤,可能是导致特发性肠穿孔的主要原因[2]。Hyginus 等
[1] 报道,新生儿肠穿孔的死亡危险因素为 NEC、多部位肠穿孔、延迟手术时间、早产。本研究中新生儿肠穿孔的死亡危险因素为酸中毒、多部位肠穿孔和穿孔至手术时间较长。患儿肠穿孔造成肠液丢失,微循环障碍,酸中毒程度可以反映病情严重程度。多部位肠穿孔的病死率明显高于单一部位穿孔,这是因为新生儿肠穿孔本身是一种极危险的急腹症,多部位肠穿孔的患儿病情更严重。穿孔至手术的时间越长,腹腔内和全身的炎症反应越严重,病死率也随之增加。因此,早期诊断、尽早手术对降低新生儿肠穿孔患儿病死率至关重要。
综上,本研究提示,新生儿肠穿孔病因多样,以 NEC 为主;NEC 穿孔与特发性肠穿孔具有不同的致病菌、发病机制,是相互独立的疾病;新生儿肠穿孔患儿死亡的主要危险因素包括酸中毒、多部位肠穿孔、穿孔至手术时间较长。因此,早期诊断、尽早手术是挽救肠穿孔患儿生命的主要手段。
| [1] | Hyginus EO, Jideoffor U, Victor M, et al. Gastrointestinal perforation in neonates: aetiology and risk factors[J]. J Neonatal Surg, 2013, 2(3): 30-35. |
| [2] | 郭卫红, 陈永卫, 侯大为, 等. 新生儿单纯肠穿孔临床分析[J].中国新生儿杂志, 2006, 21(6): 336-339. |
| [3] | 刘清茂, 梁军. 新生儿特发性结肠穿孔3例报告[J]. 中国当代儿科杂志, 2008, 10(2): 263. |
| [4] | 童笑梅. 坏死性小肠结肠炎[M]//邵肖梅. 实用新生儿学. 第4版.北京: 人民卫生出版社, 2012: 477-483. |
| [5] | Chan KY, Leung FW, Lam HS, et al. Immunoregulatory protein profiles of necrotizing enterocolitis versus spontaneous intestinal perforation in preterm infants[J]. PLoS One, 2012, 5(7): e36977. |
| [6] | 王献良, 谢文雅, 靳三丁, 等. 新生儿单纯性结肠穿孔诊治[J]. 中华实用诊断与治疗杂志, 2010, 24(6): 618-619. |
| [7] | Coates EW, Karlowicz MG, Croitoru DP, et al. Distinctive distribution of pathogens associated with peritonitis in neonates with focal intestinal perforation compared with necrotizing enterocolitis[J]. Pediatrics, 2005, 116(2): e241-e246. |
| [8] | 姜娜, 汪盈, 王琦, 等. 超早产儿医院感染及危险因素分析[J]. 中华儿科杂志, 2014, 52(2): 137-141. |
| [9] | 麦菁芸, 董琳, 林振浪, 等. 新生儿医院感染的调查分析[J]. 中华儿科杂志, 2011, 49(12): 915-920. |
| [10] | 朱敏丽, 朱将虎, 李海静, 等. 新生儿B族链球菌脑膜炎13例临床分析和随访[J].中华儿科杂志, 2014, 52(2): 133-136. |
| [11] | 周丽, 孔祥永, 张万巧, 等. 新生儿败血症临床特点和病原学耐药性分析[J]. 中华临床医师杂志, 2013, 7(11): 5125-5128. |
 2015, Vol. 17
2015, Vol. 17