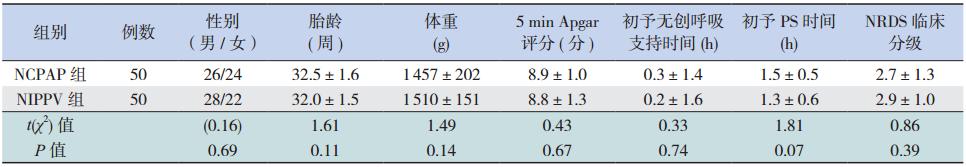
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是由围生期缺氧所致的脑损伤,目前研究证明亚低温治疗新生儿 HIE 具有临床可行性,是改善其预后的重要手段[1]。国内已有相关系统评价,发现亚低温治疗可降低 HIE 患儿病死率,改善患儿神经系统发育障碍[2,3,4]。近年随着亚低温技术在临床的推广应用,新的研究结果不断公布,有必要对原有的系统评价进行更新,本研究进一步对亚低温治疗新生儿 HIE 的远期预后进行相关评价,旨在为临床提供医疗决策。 1 资料与方法 1.1 纳入标准
(1)研究设计:国内外公开发表的关于亚低温治疗新生儿 HIE 的随机对照研究(RCT)或半随机对照研究,文种限中、英文。排除研究设计不严谨(如对照设计不合理)、无相应统计指标、不能获得全文的文献;排除研究对象包含合并先天畸形的新生儿的文献。
(2)干预措施:试验组在出生后 6 h 内开始亚低温治疗,通过体表(头部或全身)降温使脑温或中心体温降至 32.0~35.0℃,并维持 48~72 h,其他治疗措施与对照组相同;对照组均采用综合治疗,直肠或皮肤温度保持在 36.0~37.5℃。
(3)研究对象:因围生期窒息导致 HIE 的足月或近足月新生儿(胎龄≥ 35 周)。围生期窒息的诊断为:10 min Apgar 评分≤ 5 分,出生后 1 h内至少一次脐血或动脉血 pH ≤ 7.1 或碱缺失(base deficit,BD)≥ 12 mmol/L,出生后 10 min 持续进行复苏或机械通气。HIE 的诊断根据文献[5,6],采用标准的神经系统评估方法,根据 Sarnat 分度进行判断。
(4)主要结局观察指标:亚低温治疗的安全性、病死率及远期(12~24 月龄及 6~8 岁)神经系统后遗症的发生率(包括脑瘫、发育迟缓等指标)。
(5)次要结局观察指标:亚低温治疗后 1 周内的不良反应,包括窦性心动过缓、心律失常、低血压、凝血功能障碍、血小板减少、低血糖、电解质紊乱、肝功能损害等。 1.2 检索策略
以 perinatal、newborn、child、neonate、cool、hypothermia、hypoxic ischaemic、asphyxia、encephalopathy 为英文检索词,以亚低温、新生儿、儿童、缺氧、缺血、脑损伤、脑病为中文检索词,计算机检索 Cochrane Library、PubMed、EMbase、中国生物医学文献数据库、万方数据库等,收集符合纳入标准的研究,检索时限均为从建库至2014 年 3 月。检索策略采用主题词与自由词相结合的方式,并辅以手工检索会议资料和追溯纳入文献的参考文献。 1.3 资料提取与质量评价
由两名评价员独立提取纳入研究资料,包括试验设计方法、期刊名称、第一作者、出版年、国别、随访时间、病死率等评价指标,然后对结果进行交叉核对,对有分歧而难以确定是否纳入的研究通过讨论或与第三位研究员协商确定。采用 Cochrane Handbook 提供的方法对文献进行质量评价[7]。 1.4 统计学分析
采用 Cochrane 协作网提供的 RevMan 5.1 软件进行 Meta 分析。对纳入研究进行异质性分析,统计学异质性采用卡方检验,检验水平为α=0.10 ,对无异质性(P>0.05)的研究结果采用固定效应模型合并效应量,存在异质性(P<0.05)的则采用随机效应模型分析。如研究间异质性太大,无法进行 Meta 分析时,则进行描述性分析。 2 结果 2.1 检索结果及纳入研究的基本特征
初检文献 1 054 篇,通过阅读摘要和全文排除后纳入 31 篇,最后经过认真阅读全文,最终纳入符合标准的共 8 个研究。温度探测部位各研究间略有差异,其中文献 [9] 中试验组温度探测部位为食管,其余均为直肠。多数研究的随访时间在 24个月内,仅纳入的 NICHD 和 CoolCap 两个研究随访至儿童期(6~8 岁)。所纳入 8 个研究的基本情况见表 1。
| 表 1 纳入文献的基本情况 |
大多数的文献描述了具体的随机分配的方法,详细描述了失访情况(表 2)。对报道亚低温治疗病死率的 8 项研究进行回归分析,绘制漏斗图,未见明显发表偏倚(图 1)。
| 表 2 纳入文献的方法学质量评价 |
 | 图 1 发表偏倚的漏斗图 |
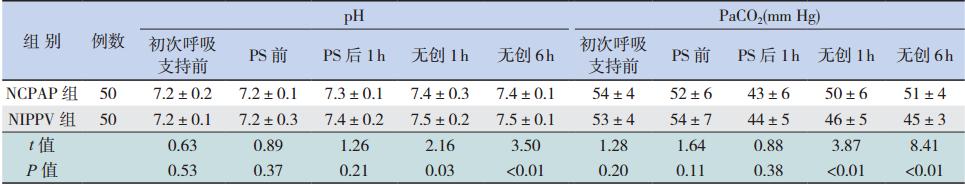
(1)病死率:异质性检验示纳入研究间无异质性,采用固定效应模型。其中 3 项研究报道了选择性头部亚低温治疗病死率,Meta 分析结果提示选择性头部亚低温治疗未能显著降低病死率(RR=0.80,95%CI:0.60~1.06,P=0.12)。另 5 项研究报道了全身亚低温治疗病死率,Meta分析结果提示全身亚低温治疗能显著降低病死率(RR=0.73,95%CI:0.61~0.89,P<0.01)。见表 3。
| 表 3 亚低温治疗组与对照组 24 月龄内疗效分析 |
(2)严重神经系统发育障碍发生率:异质性检验示纳入研究间无异质性,采用固定效应模型。其中 3 项研究选用选择性头部亚低温治疗,Meta分析结果示RR=0.72,95%CI:0.50~1.05,P=0.09;5 项研究选用全身亚低温治疗,Meta 分析结果示RR= 0.79,95%CI:0.62~1.01,P=0.06,提示全身或者选择性头部亚低温治疗均不能降低严重神经系统发育障碍发生率,见表 3。
(3)生长发育延迟发生率:异质性检验示纳入研究间无异质性,采用固定效应模型。其中2 项研究选用选择性头部亚低温治疗,Meta 分析结果提示选择性头部亚低温治疗未能降低生长发育延迟发生率(RR=0.86,95%CI:0.54~1.36,P=0.51)。4 项研究选用全身亚低温治疗,Meta分析结果提示全身亚低温治疗能显著降低生长发育延迟发生率(RR=0.70,95%CI:0.54~0.93,P=0.01)。见表 3。
(4) 脑瘫发生率:异质性检验示纳入研究间无异质性,采用固定效应模型。有 3 项研究选用选择性头部亚低温治疗,Meta 分析结果示RR=0.65,95%CI:0.46~0.94,P=0.02;有 4 项研究选用全身亚低温治疗,Meta 分析结果示RR=0.67,95%CI: 0.52~0.86,P<0.01,提示选择性头部或全身亚低温治疗能显著降低脑瘫发生率,见表 3。
(5)失明发生率:异质性检验示纳入研究间无异质性,采用固定效应模型。其中 2 项研究采用选择性头部亚低温治疗,Meta 分析结果示RR=0.57,95%CI:0.23~1.37,P=0.21;5 项 研 究采用全身亚低温治疗,Meta 分析结果示RR=0.64,95%CI:0.35~1.17,P=0.15,提示全身或者选择性头部亚低温治疗均不能降低失明发生率,见表 3。
(6) 听力损伤发生率:异质性检验示纳入研究间无异质性,采用固定效应模型。其中 2 项研究采用选择性头部亚低温治疗,Meta 分析结果示RR=1.43,95%CI:0.36~5.72,P=0.61;5 项 研 究采用全身亚低温治疗,Meta 分析结果示RR=0.52,95%CI:0.25,1.11,P=0.09,提示全身或者选择性头部亚低温治疗均不能降低听力损伤发生率,见表 3。 2.4 6~8 岁结局观察指标
仅有 2 项研究报道了亚低温治疗新生儿 HIE的儿童期随访结果,且评价指标间存在较大的异质性,故仅做描述性分析。在 CoolCap 研究中[16],共计 62 例患儿获得长期(7~8 岁)随访结果,其中亚低温治疗组 32 例,对照组 30 例,采用儿童功能独立性评定量表(WeeFIM)对患儿的自理、认知能力进行评估,结果发现两组间差异无统计学意义(P=0.83),但该研究失访例数较大。在NICHD 研究中[17],共计 190 例患儿获得长期(6~7岁)随访结果,其中亚低温治疗组 97 例,对照组93 例,结果显示:亚低温治疗组病死率低于对照组(P<0.05);亚低温治疗组死亡 / 严重伤残合并发生率较对照组明显降低(P<0.05);轻度智力障碍(IQ<70)、脑瘫、中度及重度伤残发生率两组间差异无统计学意义(P>0.05)。 2.5 不良反应发生率
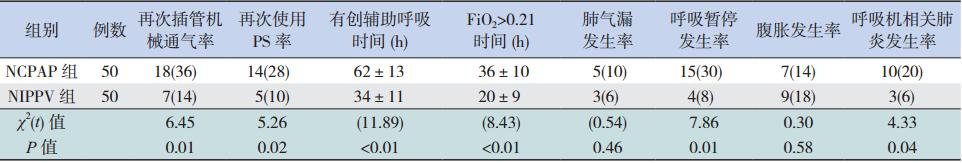
有多项研究报道了亚低温治疗组和对照组不良反应发生率,包括心血管并发症(如窦性心律过缓、心律失常、低血压)、凝血功能异常(凝血障碍、血小板减少症)、内环境紊乱(低血钾、低血糖)、脓毒症、肝功能异常。Meta 分析结果提示:与对照组相比,全身或选择性头部亚低温治疗组窦性心动过缓发生率显著增高(P<0.01);选择性头部亚低温治疗组血小板减少症发生率显著增高(P<0.05);全身亚低温治疗组低血糖发生率显著增高(P<0.05)。其他不良反应发生率两组间差异无统计学意义。 3 讨论
本 Meta 分析在既往系统评价的基础上,纳入了 TOBY、ICE、Neo.nEURO 等新的临床研究(如文献[10]、[11]、[15]),剔除了既往 Meta 分析中病例数过少、随访时间过短及资料不完整的文献,使纳入研究对象的异质性更低。此外,临床普遍应用的 Apgar 评分容易受主观影响,而依据 Sarnat分度在生后 6 h 内筛选存在假阳性的可能,可能给临床带来过度诊断和干预,在本研究纳入的文献中,大多数研究报道了患儿的血气标准;HIE 发病的关键环节是继发性能量衰竭的发生,研究发现亚低温治疗在缺氧缺血后 6 h 内开始并维持至二次能量衰竭阶段疗效明显,本 Meta 分析纳入对象治疗开始时间均在出生后 6 h 内,大多数研究的低温治疗持续时间为 72 h;目标温度是亚低温疗法的关键之一,目前尚无临床证据支持中、深度低温(28~32℃、17~27℃)对患儿有益,本 Meta 分析纳入研究的目标温度范围为 32.0~35.0℃;上述纳入文献标准的细化使得本 Meta 分析的结果更为可信。结果发现:随访至12~24 月龄时,与对照组相比,全身亚低温治疗组病死率、生长发育延迟发生率、脑瘫发生率显著降低;选择性头部亚低温治疗组仅脑瘫发生率显著降低。严重神经系统发育障碍发生率、失明发生率、听力损伤发生率对照组与亚低温治疗组间差异均无统计学意义。本研究结果提示在病死率等方面选择性头部亚低温治疗组疗效不及全身亚低温治疗组,原因可能是前者纳入的研究样本量过小。由于目前尚无临床研究对不同亚低温治疗方法进行直接对比研究,仍不能确定哪一种亚低温治疗方法更优越。关于新生儿 HIE 远期预后评价一直是研究的热点。本研究发现,当随访至 6~7 岁时,与对照组相比,亚低温治疗降低了病死率及死亡 / 严重伤残合并发生率,但这仅是基于一个研究的数据,亚低温治疗新生儿 HIE 对儿童期转归的影响有待进一步多中心研究。Guillet 等[16] 及 Shankaran 等[17]发现 12~24 月龄的神经功能评价结果与儿童期预后明显关联。振幅整合脑电图、磁共振成像、颅脑超声、Sarnat 临床分度对新生儿 HIE 远期预后均有重要作用,其中振幅整合脑电图灵敏度和特异度都较高,且容易实施,以临床神经评估为中心同时结合其他脑监护及脑影像技术的综合运用可能是出生后判断预后的最佳办法,能帮助患儿家长决定是否救治及临床医生决定是否实施亚低温治疗;而在 12~24 月龄时,神经功能评估可能对儿童期转归具有较好的预测能力,能帮助家长及早对患儿进行康复训练[18,19,20]。
目前亚低温治疗新生儿 HIE 的研究多集中在发达国家,在医疗设施相对落后的地区此类研究较少,故有学者提出不同地区经济条件的差异可能会使其临床实际效应各不相同。Galvao 等[21]系统评价纳入 16 个研究(共 1 889 例患儿),发现无论是全身亚低温治疗或选择性头部亚低温治疗,其疗效均与当地的经济条件无显著关联,但此 Meta 分析对研究对象的纳入条件过宽,且仅对病死率进行了分析,未对生长发育延迟、脑瘫等指标进行评价。亚低温治疗方法经济方便,本身并不需要很复杂的仪器和人员培训,如 ICE 试验中采用凝胶冰袋即可使直肠温度维持在 33~34℃,2010 年美国儿科学会已将亚低温治疗作为新生儿窒息复苏后的常规治疗方法。本 Meta 分析所纳入研究的实施地基本为经济发达地区,降温的措施包括专业的亚低温治疗仪和简易降温方法如冰袋、降温垫等,研究结果与 Galvao 等结论部分一致,提示在发展中国家可适宜开展亚低温治疗。
本研究的局限性:(1)所纳入研究集中在经济发达地区,缺乏对低经济收入国家的相关研究,导致分析结果偏倚;(2)仅有 2 篇文献涉及儿童期疗效评价,且为描述性研究,结果可信度不高,目前仍缺乏可靠的远期预后预测指标;(3)Meta分析本身有一定的局限性,其结果的可靠性依赖于纳入文献的质量。尽管本研究对纳入文献进行了严格的筛选,但各试验的研究对象仍不尽相同,在一定程度上影响了研究结果的准确性。因此,在今后的研究中需要开展设计严格的大样本随机对照试验进行临床疗效的评价。
综上,本 Meta 分析提示全身亚低温治疗可降低新生儿 HIE 的病死率、生长发育延迟发生率、脑瘫发生率;选择性头部亚低温治疗仅降低脑瘫发生率;随访至 12~24 月龄时,亚低温治疗具有良好的疗效,儿童期疗效仍待观察。另外,亚低温治疗无明显不良反应,临床耐受性好,今后可作为我国新生儿 HIE 治疗的常规推荐,但其作用机制及标准实施方案尚待进一步的研究。
| [1] | 张鹏, 程国强. 亚低温治疗新生儿缺氧缺血性脑病的研究进展[J]. 中国当代儿科杂志, 2013, 15(10): 918-922. |
| [2] | 刘翠青, 夏耀方, 袁玉肖, 等. 头部亚低温对新生儿缺氧缺血性脑病半胱氨酸蛋白酶-3和白介素-18的影响[J]. 中国当代儿科杂志, 2010, 12(9): 690-692. |
| [3] | 王英娟, 潘凯丽, 赵晓莉, 等. 促红细胞生成素治疗新生儿缺氧缺血性脑病疗效观察[J].中国当代儿科杂志, 2011, 13(11): 855-858. |
| [4] | 王来栓, 程国强, 周文浩. 亚低温治疗胎龄大于35周龄新生儿缺氧缺血性脑病效果及安全性的荟萃分析[J].中华医学杂志, 2012, 92(20): 1400-1404. |
| [5] | 中华医学会儿科学分会新生儿学组. 新生儿缺氧缺血性脑病诊断标准[J].中国当代儿科杂志, 2005, 7(2): 97-98. |
| [6] | 母得志. 新生儿缺氧缺血性脑病的诊断和治疗[J]. 实用儿科临床杂志, 2011, 26(14): 1144-1147. |
| [7] | Higgins JPT, Green S. Cochrane handbook for systematic reviews of interventions: version 5.1.0[DB/OL]. Cochrane Collaboration, 2011. http://www.cochrane-handbook.org/. |
| [8] | Battin MR, Penrice J, Gunn TR, et al. Treatment of term infants with head cooling and mild systemic hypothermia (35.0 degrees C and 34.5 degrees C) after perinatal asphyxia[J]. Pediatrics, 2003, 111(2): 244-251. |
| [9] | Shankaran S, Pappas A, Laptook AR, et al. Outcomes of safety and effectiveness in a multicenter randomized, controlled trial of whole-body hypothermia for neonatal hypoxic-ischemic encephalopathy[J]. Pediatrics, 2008, 122(4): e791-e798. |
| [10] | Jacobs SE, Morley CJ, Inder TE, et al. Whole-body hypothermia for term and near-term newborns with hypoxic-ischemic encephalopathy: a randomized controlled trial[J]. Arch Pediatr Adolesc Med, 2011, 165(8): 692-700. |
| [11] | Simbruner G, Mittal RA, Rohlmann F, et al. Systemic hypothermia after neonatal encephalopathy: outcomes of neo.nEURO.network RCT[J]. Pediatrics, 2010, 126(4): e771-e778. |
| [12] | Gluckman PD, Wyatt JS, Azzopardi D, et al. Selective head cooling with mild systemic hypothermia after neonatal encephalopathy: multicentre randomised trial[J]. Lancet, 2005, 365(9460): 663-670. |
| [13] | Eicher DJ, Wagner CL, Katikaneni LP, et al. Moderate hypothermia in neonatal encephalopathy: efficacy outcomes[J]. Pediatr Neurol, 2005, 32(1): 11-17. |
| [14] | Zhou WH, Cheng GQ, Shao XM, et al. Selective head cooling with mild systemic hypothermia after neonatal hypoxic-ischemic encephalopathy: a multicenter randomized controlled trial in China[J]. J Pediatr, 2010, 157(3): 367-372. |
| [15] | Azzopardi DV, Strohm B, Edwards AD, et al. Moderate hypothermia to treat perinatal asphyxial encephalopathy[J]. N Engl J Med, 2009, 361(14): 1349-1358. |
| [16] | Guillet R, Edwards AD, Thoresen M, et al. Seven- to eight-year follow-up of the CoolCap trial of head cooling for neonatal encephalopathy[J]. Pediatr Res, 2012, 71(2):205-209. |
| [17] | Shankaran S, Pappas A, McDonald SA, et al. Childhood outcomes after hypothermia for neonatal encephalopathy[J]. N Engl J Med, 2012, 366(22): 2085-2092. |
| [18] | 尤嘉, 刘俐, 张明, 等. T1WI信号强度与1H MRS在新生儿缺氧缺血性脑病诊断中的价值[J].中国当代儿科杂志, 2011, 13(2): 107-110. |
| [19] | 林碧云, 张鹏, 程国强, 等. 大于35周胎龄新生儿缺氧缺血性脑病远期预后评价体系荟萃分析[J]. 中华医学杂志, 2014, 94(2): 115-121. |
| [20] | van Laerhoven H, de Haan TR, Offringa M, et al. Prognostic tests in term neonates with hypoxic-ischemic encephalopathy: a systematic review[J]. Pediatrics, 2013, 131(1): 88-98. |
| [21] | Galvao TF, Silva MT, Marques MC, et al. Hypothermia for perinatal brain hypoxia-ischemia in different resource settings: a systematic review[J]. J Trop Pediatr, 2013, 59(6): 453-459. |
 2015, Vol. 17
2015, Vol. 17