超早早产儿是指胎龄小于 28 周的早产儿,由于其胎龄小,发育不完善,常需要呼吸支持和氧疗[1]。但不合理的氧疗与早产儿视网膜病(ROP)的发生有关,而且高流量的氧气还可能与早产儿支气管肺发育不良(BPD)、脑瘫都有着极大的关系[2-4]。因而,有人提出应该降低吸氧浓度,但后来人们发现维持较低的氧饱和度会导致更多的超早早产儿死亡[5-6]。2005 年,国外开展了一个大样本的临床随机对照试验,即 STOP ROP (Supplemental Therapeutic Oxygen for Prethreshold Retinopathy of Prematurity),该试验以血氧饱和度作为分组指标,比较血氧饱和度分别为 89%~94%和 96%~99% 的两组患儿的预后等情况,结果发现,两组间的阈值 ROP 发生率无明显差异,但高氧组患儿的肺部负面影响增加[7]。随后,NeOProM(Neonatal Oxygenation Prospective Meta-analysis)团队在全世界范围内发起了更大样本的临床随机对照试验,但结果不尽相同[8-11]。由于该团队的试验采用的指标及方法相似,可信度较高,因此,本研究仅对该团队发表的文献进行了综合分析,希望为临床及科研工作提供参考。 1 资料与方法 1.1 纳入文献介绍
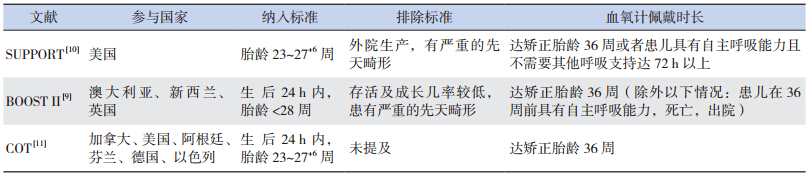
2003 年,由 30 位国际知名的生物统计学家、新生儿科医生等组成的 NeOProM 团队[8] 在全世界进行了 5 个多中心大样本的临床随机对照试验:SUPPORT(Surfactant Positive Pressure and Pulse Oximetry Randomized Trial) 试 验[10]、BOOST II(Benefits of Oxygen Saturation Targeting)试验(由英国、澳大利亚、新西兰 3 个试验组成)[9]及 COT(Canadian Oxygen Trial)试验[11],并发表了3 篇文献。这些试验主要纳入胎龄小于 28 周的早产儿,随机分配到高血氧饱和度组(91%~95%)和低血氧饱和度组(85%~89%),并利用经皮脉搏血氧饱和度计记录血氧饱和度的数值,直至矫正胎龄 36 周,这个过程中,由专人进行数据的下载和整合。 1.2 系统评价指标及定义
(1)病死率:(出院前或 18 月龄前死亡人数/入选患儿总数)×100%。
(2)相关疾病的发生率:包括早产儿视网膜病(ROP)、新生儿坏死性小肠结肠炎(NEC)、BPD、脑室内出血(IVH)、动脉导管未闭(PDA)的发生率。疾病发生率的计算:(试验期间各疾病发生例数 / 入选患儿总数)×100%。 1.3 统计学分析
采用 STATA 12.0 软件整合不同文献结果,采用随机效应模型对整合结果进行 Meta 分析和作图,并运用了Q及I2对各文献进行异质性检验,其中P值大于 0.10、I2小于 25% 为具有较高同质性。对试验结果的分析采用可信区间法,95%CI跨越 1即视为无统计学意义。 1.4 文献质量评价
根据 Cochrane 协作网系统评价员手册文献质量评价方法,两人分别从随机分配、分配隐藏、盲法、数据完整、选择性报告和其他偏倚风险 6个方面对文献质量进行评价[12]。 2 结果 2.1 纳入文献的质量
纳入研究的 3 篇文献均为多中心随机临床对照试验,并进行了临床随机对照试验的注册[8-11],接受 NeOProM 管理委员会对试验数据的审查,保证了数据的完整性,最大程度地减少了发表偏倚。此外,由研究设计者对患儿直接进行分组,并统一选用美国迈心诺(Masimo)公司生产的电子脉搏血氧计,由工程师对范围在 88%~92% 的血氧饱和度数值进行了改良[13],使得临床工作人员看到的数值与实际有 3% 的差异,例如显示的数值为90%,其在高血氧饱和组为 93%,而在低血氧饱和组为 87%,从而达到了双盲和分配隐藏的效果。综上所述,3 篇文献的质量评定均为 A 级。 2.2 纳入文献的基本情况
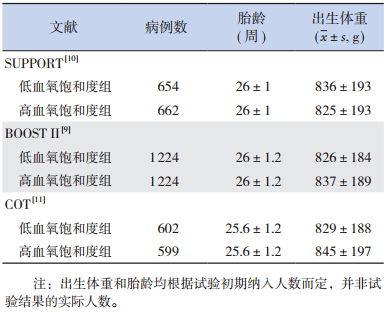
纳入文献的基本情况见表 1 和表 2,各文献对各指标定义略有差异(表 3)。2006 年,BOOST II开始进行病例的纳入。不久后,英国的研究人员发现脉搏血氧计在 87%~90% 的范围内显示读数较真实稍有下降,于是,从 2008 年 12 月开始,研究人员对还未完成试验的英国和澳大利亚的血氧计软件进行了更换,并将血氧计改良后的数据与原有数据分别进行整合[9]。2009 年 2 月至 6 月,COT 的技术人员对下属所有研究中心的血氧计软件进行了升级[11]。2010 年,SUPPORT 报道称低血氧饱和度组患儿的出院前病死率较高,此时BOOST II 的试验正在进行,DSMCs 及其他试验组分别对结果进行分析并认为试验可以继续进行。2010 年年底,DSMCs 对 BOOST II 和 SUPPORT 的试验数据进行 Meta 分析,得出了 BOOST II 试验血氧计改变前后两组病死率有差异的结论,因而停止了 BOOST II(澳大利亚和英国)的试验[8-11,14]。
| 表1 纳入文献中研究对象的一般情况 |
| 表2 纳入文献的基本情况 |
| 表3 纳入文献指标的选择 |
为了去除混杂因素对试验的影响,本研究所采用的指标均为文献中调整过后的RR值,其中SUPPORT 根据研究中心及胎龄对RR值进行调整,BOOST II 则依照试验所在的国家,COT 依照研究中心、病人信息进行调整。
对3 篇文献进行系统评价,结果提示低血氧饱和度组患儿死亡风险较高(RR:1.19,95%CI:1.05~1.35), 见 图 1; 低 血 氧 饱 和 度 组 患儿ROP 发生的风险较低(RR:0.73,95 %CI:0.53~1.00),见图 2;图 3 示低血氧饱和度组患儿NEC 发生的风险较高(RR:1.26,95 %CI:1.06~1.49);两组间 BPD 发生率差异无统计学意义(RR:0.95,95 %CI:0.86~1.04), 见 图 4;两组间PDA 发生率差异亦无统计学意义(RR:1.01,95%CI:0.94~1.08),见图 5。由于各文献间疾病的诊断标准稍有差异,因而仅采纳其中两篇文献对 IVH 发生率进行分析,结果显示两组间 IVH发生率差异无统计学意义(RR:1.10,95%CI:0.92~1.31),见图 6。
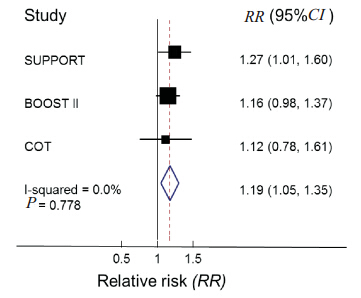 | 图 1 不同血氧饱和度患儿病死率的比较较高。 异质性检验P=0.778(>0.1),RR>1 提示低血氧饱和度组患儿死亡的风险 |
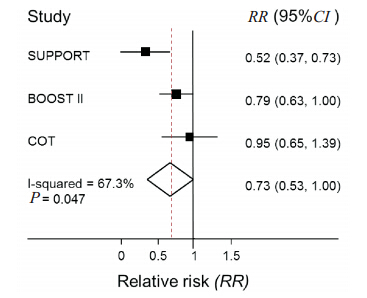 | 图2 不同血氧饱和度患儿 ROP 发生率的比较 异质性检验P=0.047(<0.1),RR<1 提示低血氧饱和度组患儿 ROP发生的风险较低。 |
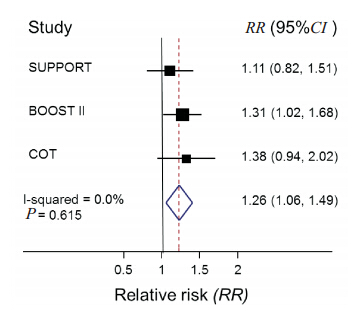 | 图 3 不同血氧饱和度患儿 NEC 发生率的比较 异质性检验P=0.615(>0.1),RR>1 提示低血氧饱和度组患儿 NEC发生的风险较高。 |
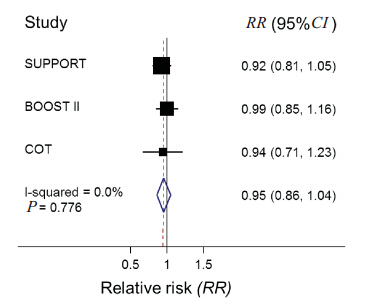 | 图 4 不同血氧饱和度患儿 BPD 发生率的比较 异质性检验P=0.776(>0.1),RR(95%CI)跨越 1 提示无统计学意义。 |
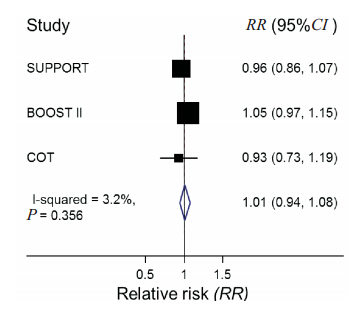 | 图 5 不同血氧饱和度患儿 PDA 发生率的比较 异质性检验P=0.356(>0.1),RR(95%CI)跨越 1 提示无统计学意义。 |
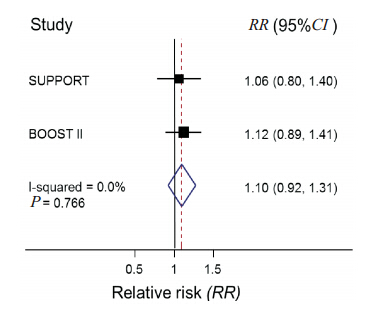 | 图 6 不同血氧饱和度患儿 IVH 发生率的比较 异质性检验P=0.766(>0.1),RR(95%CI)跨越 1 提示无统计学意义。 |
自从1942年第1例晶体后纤维增生症(retrolental fibroplasia, RLF)被提出,临床医生才逐渐了解患儿失去光明的原因[16]。半个多世纪以来,人们对患儿的氧疗指标进行了无数次的探索,例如,得到大家普遍公认的保持患儿的动脉血氧分压在 50~80 mm Hg 之间[17],依靠正常值换算方法,应保持血氧饱和度在 90%~95% 等[18]。但这些都是基于人们的共识,而非科学依据,目前仍然没有一个成文的、全世界适用的标准。对于我国而言,随着新生儿重症监护病房的普遍建立,越来越多的早产儿得以存活[19],合适的血氧饱和度对他们来说至关重要,因此,对此问题的研究迫在眉睫。
尽管 NeOProM 试图保持各个试验间的一致性,但试验过程中还是发生了许多问题,这使得结果的分析变得更为棘手。在 COT 发表的文献中,结果显示不同的血氧饱和度并未对早产儿的病死率有实质的影响[11]。而 SUPPORT 数据分析结果显示两组矫正胎龄达 36 周前病死率的RR及 95%CI为1.27(1.01~1.60),有统计学意义[10]。BOOST II则发现不同的血氧饱和度对早产儿 ROP 及 NEC 的发生均有影响,且血氧计软件改良后,患儿的病死率更高[9,14]。
Saugstad 等[18] 于 2014 年发表的 Meta 分析结果显示低血氧饱和度组患儿的死亡风险较高血氧饱和度组增加了 40%,而根据本研究结果,低血氧饱和度组死亡风险仅增加了 19%。究其原因,主要因为数据提取过程中,他们将 BOOST II 试验数据按不同国家分别进行提取,并仅采用了仪器改良后的数据,而这一数据显示患儿的病死率较高,此外,COT 的数据也采用了病死率较高的仪器改良后的OR值,因此,他们计算出来的低血氧饱和度组患儿的死亡风险大大提高,而本研究则基于 BOOST II 发表文献的原始数据,并将仪器改良前后的数据同时纳入,更具有说服力。就 ROP及 NEC 风险率而言,尽管数据提取过程有一定差异,但研究结果极为接近,高血氧饱和度组 ROP的风险率升高了 27%(Saugstad:26%),而 NEC的风险率降低了 26%(Saugstad:27%)。
在数据分析过程中,尽管我们努力减少偏倚和错误,但几篇文献间仍有一定差异,例如试验的纳入人群、随机化、血氧计的改进以及各个系统指标的定义等,除此之外,纳入文献例数较少也可能对结果产生一定的影响。目前,血氧计已经逐步替代监测动脉血氧分压来监测新生儿的氧合状态[20],在 BOOST II 中,由于这一关键仪器发生问题,使得显示屏读数偏高,这可能是造成血氧计改良后新生儿病死率偏高的原因之一[9]。
总之,本系统评价提示,维持低血氧饱和度能降低超早早产儿 ROP 的发生率,但同时病死率及 NEC 发生的风险也增加了。为了避免一部分患儿发生 ROP,而将另一部分患儿推向死亡的边缘,这显然是不可取的。那么,何种范围的血氧饱和度才是最为适合的呢?既对早产儿的生命安全没有危害,又能降低 ROP、NEC 的发生率,目前仍然无法轻易得出结论,这需要更多的临床试验数据支持。而为了找出这一合适的血氧饱和度,在试验中是否需要对不同胎龄的患儿进行区分,是否需要根据患儿出生后不同时间对吸氧方式和时长进行分层分析,这仍然是值得进一步探讨的问题。
| [1] | Askie LM, Henderson-Smart DJ, Ko H. Restricted versus liberal oxygen exposure for preventing morbidity and mortality in preterm or low birth weight[J]. Cochrane Database Syst Rev, 2009, (1): CD001077. |
| [2] | Jobe AH, Bancalari E. Bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2001, 163(7): 1723-1729. |
| [3] | Warner BB, Stuart LA, Papes RA, et al. Functional and pathological effects of prolonged hyperoxia in neonatal mice[J]. Am J Physiol, 1998, 275 (1 Pt 1): L110-L117. |
| [4] | Collins MP, Lorenz JM, Jetton JR, et al. Hypocapnia and other ventilation-related risk factors for cerebral palsy in low birth weight infants[J]. Pediatr Res, 2001, 50 (6): 712-719. |
| [5] | Chow LC, Wright KW, Sola A. Can changes in clinical practice decrease the incidence of severe retinopathy of prematurity in very low birth weight infants?[J]. Pediatrics, 2003, 111(2): 339-345. |
| [6] | Tin W, Milligan DW, Pennefather P, et al. Pulse oximetry, severe retinopathy, and outcome at one year in babies of less than 28 weeks gestation [J]. Arch Dis Child Fetal Neonatal Ed, 2001, 84(2): F106-F110. |
| [7] | The STOP-ROP Multicenter Study Group. Supplemental Therapeutic Oxygen for Prethreshold Retinopathy Of Prematurity (STOP-ROP). a randomized, controlled trial. I: primary outcomes [J]. Pediatrics, 2000, 105(2): 295-310. |
| [8] | Askie LM, Brocklehurst P, Darlow BA, et al. NeOProM: Neonatal Oxygenation Prospective Meta-analysis Collaboration study protocol [J]. BMC Pediatr, 2011, 11: 6. |
| [9] | BOOST II United Kingdom Collaborative Group, BOOST II Australia Collaborative Group, BOOST II New Zealand Collaborative Group, et al. Oxygen saturation and outcomes in preterm infants [J]. N Engl J Med, 2013, 368(22): 2094-2104. |
| [10] | Carlo WA, Finer NN, Walsh MC, et al. Target ranges of oxygen saturation in extremely preterm infants [J]. N Engl J Med, 2010, 362(21): 1959-1969. |
| [11] | Schmidt B, Whyte RK, Asztalos EV, et al. Effects of targeting higher vs lower arterial oxygen saturations on death or disability in extremely preterm infants: a randomized clinical trial [J]. JAMA, 2013, 309(20): 2111-2120. |
| [12] | Higgins JPT, Green S. Cochrane Handbook for Systematic Reviews of Interventions Version 5.0.17[updated Dec 2008] [DB /OL]. The Cochrane Collaboration, 2008. Available at www. Cochranehandbook.org. |
| [13] | Cole CH, Wright KW, Tarnow-Mordi W, et al. Resolving our uncertainty about oxygen therapy [J]. Pediatrics, 2003, 112(6 Pt 1): 1415-1419. |
| [14] | Stenson B, Brocklehurst P, Tarnow-Mordi W, et al. Increased 36-week survival with high oxygen saturation target in extremely preterm infants [J]. N Engl J Med, 2011, 364(17): 1680-1682. |
| [15] | Early Treatment For Retinopathy Of Prematurity Cooperative Group. Revised indications for the treatment of retinopathy of prematurity: results of the early treatment for retinopathy of prematurity randomized trial[J]. Arch Ophthalmol, 2003, 121(12): 1684-1694. |
| [16] | Silverman WA. A cautionary tale about supplemental oxygen: the albatross of neonatal medicine[J]. Pediatrics, 2004, 113(2): 394-396. |
| [17] | Anderson CG, Benitz WE, Madan A. Retinopathy of prematurity and pulse oximetry: a national survey of recent practices [J]. J Perinatol, 2004, 24(3): 164-168. |
| [18] | Saugstad OD, Aune D. Optimal oxygenation of extremely low birth weight infants: a meta-analysis and systematic review of the oxygen saturation target studies[J]. Neonatology, 2014, 105(1): 55-63. |
| [19] | 中华医学会儿科学分会新生儿学组. 早产儿管理指南(英文)[J]. 中国当代儿科杂志, 2005, 7(1): 1-7. |
| [20] | Myers TR, American Association for Respiratory Care. AARC Clinical Practice Guideline: selection of an oxygen delivery device for neonatal and pediatric patients--2002 revision & update [J]. Respir Care, 2002, 47(6): 707-716. |
 2015, Vol. 17
2015, Vol. 17