毛细支气管炎(以下简称毛支)是 2 岁以下婴幼儿特有的呼吸道感染性疾病,以气促、三凹征和喘鸣为主要临床表现,50% 以上为呼吸道合胞病毒(RSV)感染[1]。随访毛支患儿发现 33.9%发生哮喘[2],其发病机制有待进一步研究。CXCR3及其配体 IP-10 是重要的生物活性分子,在多种病毒感染中参与免疫应答。近年来关于其研究多集中在肿瘤[3]、肝炎[4]、移植排斥反应[5]、自身免疫性疾病[6] 等方面,在哮喘小鼠[7] 中也有研究,在毛支患儿中鲜有报道。毛支是一种常见的病毒感染性疾病,本研究旨在检测该疾病患儿外周血淋巴细胞表面CXCR3 的表达及血清中IP-10 的水平,以探讨其在毛支发病机制中的作用及意义,以期为毛支的临床诊断和治疗提供参考。 1 资料与方法 1.1 研究对象
随机选取2013年12月至2014年5月于我院儿内科住院的毛支患儿 55 例作为毛支组,按有无过敏因素分为毛支Ⅰ组和毛支Ⅱ组。毛支Ⅰ组:有过敏因素,如湿疹、过敏性鼻炎等,共 30 例,其中男 19 例,女 11 例,年龄 2~24 个月,平均7±3 个月;毛支Ⅱ组:无过敏因素,共 25 例,其中男 15 例,女 10 例,年龄 2~24 个月,平均 6±4个月。两组患儿均为首次喘息发作的初治患儿,有气促及咳喘憋症状,肺部听诊可闻及哮鸣音,胸部影像学检查征象为全肺不同程度的肺气肿或肺纹理增粗,符合毛支诊断标准[1]。同期同年龄段外科疝气、肾结石等非感染患儿 28 例作为对照组,其中男 16 例,女 12 例,年龄 2~36 个月,平均 9±5 个月。纳入本试验的所有儿童采血前 1 个月均无免疫药物治疗史;对照组无毛支史,毛支Ⅱ组及对照组均非过敏体质。3 组儿童年龄、性别差异无统计学意义(P>0.05)。该研究已通过我院伦理委员会同意和批准,并获患儿家长知情同意。 1.2 外周血淋巴细胞表面 CXCR3 表达的检测
CXCR3 在活化的 T 细胞上高度表达,其表面分子标志为 CD183,本研究通过检测 CD4+CD183+T 细胞占 CD4+T 细胞百分比、CD8+CD183+T 细胞占 CD8+T 细胞百分比来反映外周血淋巴细胞表面CXCR3 的表达。
3 组儿童均于入院当天采集静脉血 4 mL,其中 2 mL 新鲜全血经 EDTA-Na2 抗凝后用于检测外周血淋巴细胞表面 CXCR3 的表达。取流式专用管 6 支,在各管中分别加入 100 μL 抗凝混匀全血;在各管中顺序加入 CD4-FITC 20 μL、CD183-PE 20 μL;CD8-FITC 20 μL、CD183-PE 20 μL;CD4-FITC 20 μL、IgG1-PE 20 μL;CD8-FITC 20 μL、IgG1-PE 20 μL;CD183-PE 20 μL、IgG1-FITC 20 μL;IgG1-FITC 20 μL、IgG1-PE 20 μL。混匀,室温避光30 min。各管中加入红细胞裂解液 1 mL,室温避光 10 min,离心 5 min(1 500转 /min), 弃 上 清, 重 复 3 次。 再 加 入 1 mL PBS 液,混匀,采用流式细胞术分析其外周血中CD4+CD183+ T 细胞、CD8+CD183+ T 细胞的数量,分别以 CD4+CD183+ T 细胞占 CD4+ T 细胞百分比及CD8+CD183+ T 细胞占 CD8+ T 细胞百分比表示。鼠抗 人 CD4-FITC、CD8-FITC、CD183-PE和同型对照鼠抗人 IgG1 单克隆抗体购自美国 BD 公司;流式细胞仪为 FACS Calibur 型,购自美国 BD 公司。 1.3 血清中 IP-10 水平的检测
2 mL 静脉血 3 000 转 / min 离心 15 min,分离上层血清,-80℃冻存。血清 IP-10 浓度的检测采用 ELISA 法,按照试剂说明书操作。IP-10 试剂盒购自上海森雄科技实业有限公司(进口分装)。 1.4 统计学分析
采用 SPSS 17.0 统计软件分析,数据以均数 ±标准差(x±s)表示,组间比较采用单因素方差分析,两两比较采用 SNK 检验,P<0.05 为差异有统计学意义。 2 结果
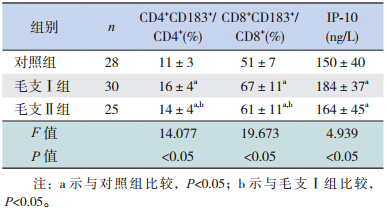
毛支Ⅰ组和毛支 II 组外周血 CD4+T 细胞表面 CD183+细胞的表达及 CD8+T 细胞表面 CD183+细胞的表达均高于对照组,差异有统计学意义(P<0.05),且毛支Ⅰ组高于毛支 II 组(P<0.05);毛支Ⅰ组及毛支Ⅱ组患儿血清 IP-10 的浓度高于对照组,差异有统计学意义(P<0.05),但毛支Ⅰ组与毛支Ⅱ组比较差异无统计学意义(表 1、图 1)。
| 表1 3 组患儿外周血 CD4+、CD8+淋巴细胞 CD183+的表达率及血清 IP-10 浓度的比较 (x±s) |
 | 图 1 3 组患儿外周血 CD4+、CD8+T 淋巴细胞中 CD183+的表达 |
毛支是由多种细胞因子参与的气道炎症性疾病,并伴有气道高反应性,尤其好发于 1~6 个月的小婴儿[8],其与哮喘的发生发展关系密切,但发病机制尚不完全清楚。目前研究认为是多种细胞组分参与的感染后继发的免疫功能异常性疾病[9],而对这些炎症细胞的活化和向气道迁移的过程中,趋化因子及其受体发挥重要作用[10]。CXCR3 为CXC 型趋化因子受体,在活化的 T 细胞上高度表达,其配体与 T 细胞的活化和迁移关系密切并高选择性作用于 CXCR3[11]。IP-10 主要来源于活化的成纤维细胞、单核巨噬细胞、内皮细胞和各种淋巴细胞等多种细胞[12]。CXCR3 与 IP-10 相互作用,可募集 T 细胞到免疫攻击部位,增强局部的抗感染免疫,引导炎症反应,在呼吸道上皮细胞的损伤和炎症过程中具有重要作用[7]。
CD4+/CD8+是反映免疫系统内环境稳定的重要指标,研究表明毛支患儿存在 T 细胞亚群变化[13]。本研究在此基础上进一步探讨 CXCR3 在 CD4+、CD8+T 细胞亚群的百分率,结果显示有无过敏因素的毛支患儿 CXCR3 在 CD4+、CD8+T 细胞的百分率均显著高于对照组,且血清 IP-10 的水平亦显著高于对照组,提示 CXCR3 通过与其配体结合及其相互作用,引导炎性细胞在呼吸道募集粘附,参与了呼吸道的炎症过程。趋化因子以配体 - 受体结合的形式发挥生物学效应。CXCR3 与 IP-10结合,促进循环中炎性细胞募集,引导炎性细胞粘附及转移至炎症部位,在炎症反应中发挥重要作用。
毛支中气道高反应性主要与 T 细胞浸润和嗜酸性粒细胞聚集活化有关[14],毛支中有过敏因素的患儿更易发生反复喘息,湿疹等特异性体质是影响毛支继发哮喘的重要因素[15]。CXCR3 与IP-10 结合,可能通过趋化嗜酸性粒细胞的聚集、诱导肥大细胞脱颗粒[13] 和加速肥大细胞向平滑肌趋化[7] 等引起炎症部位呼吸道损伤,在变应性炎症改变中起重要作用。本研究表明有过敏因素的毛支Ⅰ组 CXCR3 在 CD4+、CD8+T 细胞亚群的百分率均高于无过敏因素的毛支Ⅱ组,提示 CXCR3在毛支的致病过程中可能与过敏因素有关。是否可通过检测毛支患儿 CXCR3 预测哮喘的发病有待进一步研究。
总之,本研究表明,CXCR3 及 IP-10 参与了毛支的发病,CXCR3 可能与过敏因素有关。在哮喘中亦存在 CXCR3、IP-10 的高表达[7],提示毛支和哮喘可能存在相同或相似的发病机制。理论上认为应用 CXCR3、IP-10 的抗体治疗毛支以减轻临床症状或阻止其向哮喘进一步发展具有重要意义。
| [1] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7 版. 北京: 人民卫生出版社, 2002: 1175-1201. |
| [2] | 邓华,符州. 毛细支气管炎后支气管哮喘发生的相关因素[J]. 实用儿科临床杂志, 2009, 24(4): 274-276. |
| [3] | 朱鸿玲, 赵泽飞, 方瑾, 等. CXC趋化因子受体3在甲状腺乳头状癌的表达及临床意义[J]. 上海医学, 2012, 35(1): 41-43. |
| [4] | 祝先进, 宋艳芳, 曹颖平, 等. 慢性乙型肝炎患者外周血趋化因子CXCL10和CXCL11的表达及意义[J]. 临床肝胆病杂志, 2011, 27(8): 804-806. |
| [5] | 王海梁. 趋化因子CXC亚族及其受体CXCR3在肝移植急性排斥反应中的作用[D]. 第二军医大学学位论文, 2008. |
| [6] | 赵之, 李芳. 趋化因子及趋化因子受体3在自身免疫疾病中的作用[J]. 中国微生态学杂志, 2010, 22(10): 958-960. |
| [7] | 吴良霞, 吴珉, 林晓亮, 等. 哮喘小鼠肺组织中CXC趋化因子受体3和其配体干扰素-γ诱导蛋白10的表达及意义[J]. 实用儿科临床杂志, 2009, 24 (16): 1238-1240. |
| [8] | 邹丽萍, 张松林. 毛细支气管炎患儿ICAM-1和RANTES检测的意义[J]. 中国当代儿科杂志, 2010, 12 (3): 181-183. |
| [9] | Kim HH, Lee MH, Lee JS. Eosinophil cationic p rotein and che2 mokines in nasopharyngeal secretions of infants with respiratory syncytial virus (RSV) bronchiolitis and non-RSV bronchiolitis [J]. J Korean Med Sci, 2007, 22(1): 37242. |
| [10] | 郭宇, 李燕, 陈庄. 趋化因子在哮喘中的作用及研究进展[J]. 现代预防医学, 2012, 39(7): 1764-1767. |
| [11] | 张翔, 李文倩, 李建平, 等. CXCR3 及其相关配体的研究进展[J]. 免疫学杂志,2013, 29(4): 365-368. |
| [12] | Sauty A, Dziejman M, Taha RA, et al. The T cell-specific CXC chemokines IP-10, Mig, and I-TAC are expressed by aetivated human bronehial epithlial cells[J]. J Immunol, 1999, 162(6): 3549-3558. |
| [13] | 张松林. 毛细支气管炎患儿T淋巴细胞亚群、ICAM-1及RANTES检测意义的研究[D]. 郑州大学学位论文, 2010. |
| [14] | 袁瑞, 邹丽萍. 婴幼儿喘息性疾病外周血单个核细胞LFA-1及Mac-1检测意义的研究[D]. 郑州大学学位论文, 2012. |
| [15] | 李礼. 毛细支气管炎后继发支气管哮喘相关因素分析[J].中国现代医学杂志, 2010, 20(22): 3483-3487. |
 2015, Vol. 17
2015, Vol. 17