噬血性淋巴组织细胞增生症(hemophagocytic lymphohistiocytosis,HLH)是好发于儿童时期的由多种病因导致的单核 / 巨噬细胞系统失控性活化、增殖且伴随噬血细胞增多,并产生大量炎症细胞因子造成机体处于炎症状态的一组综合征[ 1 ]。临床主要表现为发热、脾肿大、全血细胞减少,部分患者出现肝功能障碍及凝血功能异常[ 2 ]。HLH 的具体发病机制尚未完全明了,目前认为该病主要是由于穿孔素依赖的细胞毒作用存在缺陷而造成机体多系统产生炎症反应[ 3 ]。
最近一项基因表达芯片研究发现 HLH 患儿中存在 B 淋巴细胞功能相关基因的表达下调,其中表达受抑最强的为 CCR2 基因,提示 CCR2 基因异常可能参与了HLH的发病机制[ 4, 5 ]。V64I(rs1799864)是位于 CCR2 基因上的一个非同义单orphism,SNP)位点,既往研 核 苷 酸 多 态 性(single nucleotide polym究发现该位点与多种炎症性疾病相关[ 6, 7, 8 ],而其在儿童 HLH 发病中的作用尚未见报道。因此,本研究旨在探讨CCR2 基因rs1799864 多态性与儿童 HLH 的关联性。 1 资料与方法 1.1 研究对象
选取2007年1月至2013年12月于广西医科大学第一附属医院儿科就诊的 86 例 HLH 患儿为研究对象,其中男 42 例,女 44 例,平均年龄6±4 岁。HLH 诊断及治疗标准参照国际组织细胞协会推荐的 HLH-2004 方案[ 2, 9 ]。同期选取于我院行健康体检儿童 128 例为对照组,其中男 62 例,女 66 例,平均年龄 6±3 岁。两组儿童年龄、性别比较差异无统计学意义(均P>0.05)。 1.2 DNA 提取
在获得家长或法定监护人同意并签署知情同意书后,抽取两组儿童外周静脉血 2 mL,按照DNA 提取试剂盒(北京康为生物技术公司)使用说明抽提 DNA,并置于 -20℃保存。 1.3 基因型分
析本实验以CCR2基因的热门多态性位点rs1799864 为研究靶点,运用 SNaPshot 基因分型技术(美国应用生物公司ABI)对CCR2基因rs1799864 位点基因型进行检测。 1.4 引物设计合成
根据 SNP 位点序列信息,采用 Primer Premier 5.0 软 件 设 计 并 合 成 CCR2 基 因 rs1799864 位点扩增引物和延伸引物,扩增引物序列为:上 游 5'-ACGGTGCTCCCTGTCATAA-3',下 游5'-CATTCCCAAAGACCCACTCATT-3';延伸引物序列 为:5'-TTTTTTTTTTAGGGGAATTTTAAGACTCAA-3'。经过预扩增、预扩增产物纯化、延伸反应、延伸产物纯化,最后在 3730XL 测序仪上检测,将检测得到的原始数据导入分析软件中进行分析。 1.5 统计学分析
采用 SPSS 17.0 统计软件对数据进行统计学比较分析。应用拟合优度χ2检验判断 rs1799864 位点基因型分布是否符合 Hardy-Weinberg 平衡;计数资料采用百分率(%)表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。 2 结果 2.1 两组基因型和等位基因频率的比较
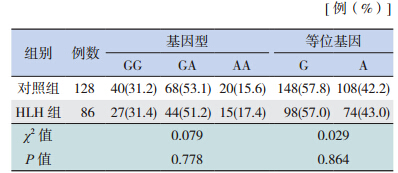
对照组与 HLH 组的 CCR2 基因 rs1799864 位点基因型分布符合 Hardy-Weinberg 平衡(P>0.05)。对两组 rs1799864 位点基因型及等位基因频率进行χ2检验发现,GG、GA、AA 基因型和 G、A 等位基因频率在对照组与 HLH 组间差异均无统计学意义(均P>0.05),见表 1。
| 表1 两组 rs1799864 位点基因型及等位基因频率比较 |
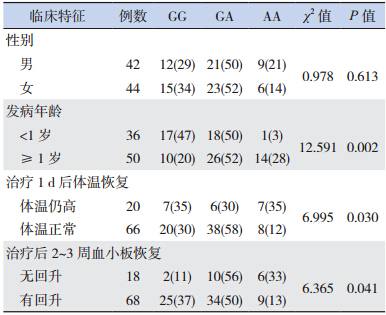
对 HLH 组 86 例患儿 rs1799864 位点基因型分布和临床表现之间的关系进行分析,结果显示不同性别患儿的基因型分布差异无统计学意义(P>0.05);对发病年龄是否 <1 岁、治疗 1 d 后体温是否恢复正常及治疗后 2~3 周血小板是否回升的患儿基因型分布进行比较发现,差异均具有统计学意义(P<0.05)。见表 2。
| 表2 HLH 组不同临床特征患儿 rs1799864 位点基因型分布比较 [例(%)] |
关于 HLH 的具体发病机制,目前多数学者认为穿孔素介导的细胞毒效应通路受损占主要作用,该细胞毒作用是由自然杀伤(natural killer,NK)细胞和 CD8+细胞毒性 T 淋巴细胞(cytotoxic T lymphocytes,CTL)所介导[ 3 ]。此外也有研究在HLH 患者中发现有 B 淋巴细胞功能的受损,提示B 细胞功能障碍也参与了 HLH 的病理生理过程[ 10 ]。而 Sumegi 等[ 4 ] 在儿童 HLH 基因表达谱的研究中发现,一系列与 B 细胞功能调控有关的基因(如CCR2、CD22 及 BLNK 等)呈现下调表达,进一步揭示了 B 细胞功能异常的相关分子机制。在众多表达异常的基因中,下调最为显著的是 CCR2 基因[ 5 ],其在儿童 HLH 发病机制中的作用值得深入研究。
CCR2 分子是 C-C 家族成员之一,由 374 个氨基酸组成,其主要表达于巨噬细胞、内皮细胞以及血管平滑肌细胞等。CCR2 基因位于人类 3 号染色体上的趋化因子受体基因簇,长度约为 8 kb,包含 3 个外显子。既往对于 CCR2 基因的研究多集中在炎症性和自身免疫性疾病,例如血管炎、动脉粥样硬化以及银屑病等[ 11, 12, 13 ]。SNP 是一种最常见的人类可遗传变异,占所有已知多态性的 90% 以上。目前已经发现了人类 CCR2 基因 397 个 SNP位点,其中包括一个位于基因编码区的错义 SNP,即 V64I(rs1799864)。CCR2 基因第 190 位碱基由 G 替换为 A,造成 CCR2 蛋白第 1 跨膜区的第64 位氨基酸缬氨酸(valine)被异亮氨酸(isoleucine)所取代。近年来该 SNP 逐渐成为 CCR2 基因变异与疾病关联研究的热门位点,但结果并非一致,有研究证实 V64I 多态性与慢性肾衰竭、冠状动脉疾病及偏头痛发病有关[ 6, 7, 8 ],但在 V64I 与重症肌无力、帕金森症及阿尔兹海默症的关联研究中未发现相关性[ 14, 15 ]。其原因可能与各项研究的纳入样本量、人群、地域等不同有关。
本研究应用关联研究的方法,针对 CCR2 基因热门的 rs1799864 位点采用 SNaPshot 基因分型方法测定 HLH 儿童样本基因型,结果发现 rs1799864多态性位点的 GG、GA、AA 基因型和 G、A 等位基因频率在健康对照组和 HLH 组间差异无统计学意义,表明 rs1799864 位点与 HLH 患儿的发病易感性无关联。而本研究 HLH 组中发病年龄是否<1 岁、治疗后 1 d 体温是否恢复正常以及治疗后2~3 周血小板是否回升的患儿其 rs1799864 位点基因型分布存在明显差异,故推测 rs1799864 多态性位点虽不能作为预示 HLH 发病的分子标记,但其基因型的不同可能与患儿 HLH 的临床表型及预后有关。
近年来随着对HLH 认识的深入以及HLH-2004 诊疗方案[ 2 ] 的推广应用,HLH 的治疗获得了一定的进展,然而仍有高达 40%~60% 的儿童初始治疗失败,死于 HLH、感染或治疗过程中的并发症[ 16 ]。目前发现的 HLH 早期死亡的危险因素包括:(1)血清胆红素增高;(2)血小板减少;(3)血清铁蛋白增高;(4)脑脊液细胞增多;(5)治疗后血红蛋白不升;(6)治疗后纤维蛋白原不回升;(7)治疗后血小板仍持续低;(8)治疗后仍持续发热[ 17 ]。陆文娴等[ 18 ] 研究发现治疗 1 d 后体温恢复情况和治疗 2~3 周后血小板恢复情况是影响 HLH 预后的两个重要因素。本研究显示在 rs1799864 位点携带 A 等位基因的 HLH患儿其治疗效果较携带 G 等位基因的患儿差,表现为治疗 1 天后体温无明显下降或治疗 2~3 周后血小板仍持续低,说明 A 等位基因可能削弱了 HLH 患儿对治疗的反应性,但其具体作用机制尚不清楚。一方面,众多研究已经证实了 CCR2/CCL2 受体 - 配体复合物在机体免疫炎症反应中的作用[ 19 ]。多态性位点 rs1799864 处于 CCR2 基因的功能结构域,A 等位基因编码的 CCR2 分子尽管在数量上无明显异常,但可能识别和结合其配体CCL2(亦称为 monocyte chemotactic protein 1,MCP-1)的能力不同,推测该位点变异造成 CCR2 分子与 CCL2 的结合位点减少从而降低 CCR2/CCL2 复合物的生物学活性,最终削弱了机体在对抗病原体(如病毒、细菌)时的免疫反应,因此可以认为该位点变异在一定程度上参与了 HLH 的疾病进展过程[ 20 ]。另一方面,CCR2 基因与 B 细胞功能有密切的关系,rs1799864 位点变异也有可能通过影响 CCR2 基因的表达进而导致 B 细胞功能的受损,但由于 B 细胞功能障碍与 HLH 相关的机制目前仍不十分清楚,因此上述推论还需要进一步证明。
综上所述,本研究通过对 CCR2 基因一个热门功能性 SNP:V64I(rs1799864)与儿童 HLH 关联性的分析,未发现 rs1799864 与 HLH 发病风险的关系,但其基因型及携带等位基因的不同有可能影响治疗的反应性,有望成为评估 HLH 患儿预后的基因标记物。当然,本研究还存在一些不足之处。限于实际研究条件,仅选取了 CCR2 基因上的一个非同义 SNP 做了分析,因而无法综合考量该 SNP 与其它 SNPs 之间潜在的相互作用以及它们所构成的单倍体与 HLH 疾病的相关性;且本研究只分析了SNP 基因型与HLH 患儿临床表型的关系,未能从蛋白表达水平和功能层面加以验证;此外,该 SNP 变异的具体作用途径仍需要做进一步深入的探索。
| [1] | Risma K, Jordan MB. Hemophagocytic lymphohistiocytosis: updates and evolving concepts[J]. Curr Opin Pediatr, 2012, 24(1): 9-15. |
| [2] | Henter JI, Horne AC, Aricó M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48(2): 124-131. |
| [3] | Jordan MB, Hildeman D, Kappler J, et a1. An animal model of hemophagoeytic lymphohistiocytosis(HLH): CD8+ T cells and interferon gamma are essential for the disorder[J]. Blood, 2004, 104(3): 735-743. |
| [4] | Sumegi J, Barnes MG, Nestheide SV, et al. Gene expression profiling of peripheral blood mononuclear cells from children with active hemophagocytic lymphohistiocytosis[J]. Blood, 2011, 117(15): e151-e160. |
| [5] | 欧丹艳, 袁媛, 罗建明. 儿童噬血细胞性淋巴组织细胞增生症发病机制的生物信息学研究[J]. 医学研究生学报, 2014, 27(4): 382-386. |
| [6] | Sezgin I, Koksal B, Bagci G, et al. CCR2 polymorphism in chronic renal failure patients requiring long-term hemodialysis[J]. Intern Med, 2011, 50(21): 2457-2461. |
| [7] | Lin HL, Ueng KC, Hsieh YS, et al. Impact of MCP-1 and CCR-2 gene polymorphisms on coronary artery disease susceptibility[J]. Mol Biol Rep, 2012, 39(9): 9023-9030. |
| [8] | Schürks M, Kurth T, Buring JE, et al. A candidate gene association study of 77 polymorphisms in migraine[J]. J Pain, 2009, 10(7): 759-766. |
| [9] | 中华医学会儿科学分会血液学组. 噬血细胞性淋巴组织细胞增生症诊疗建议[J]. 中华儿科杂志, 2012, 50(11): 821-825. |
| [10] | Clark MR, Massenburg D, Zhang M, et al. Molecular mechanisms of B cell antigen receptor traffificking[J]. Ann N Y Acad Sci, 2003, 987: 26-37. |
| [11] | Rittig K, Peter A, Baltz KM, et al. The CCR2 promoter polymorphism T-960A, but not the serum MCP-1 level, is associated with endothelial function in prediabetic individuals[J]. Atherosclerosis, 2008, 198(2): 338-346. |
| [12] | Cha SH, Lee JK, Lee JY, et al. Association of CCR2 polymorphisms with the number of closed coronary artery vessels in coronary artery disease[J]. Clin Chim Acta, 2007, 382(1-2): 129-133. |
| [13] | Soto-Sánchez J, Santos-Juanes J, Coto-Segura P, et al. Genetic variation at the CCR5/CCR2 gene cluster and risk of psoriasis and psoriatic arthritis[J]. Cytokine, 2010, 50(2): 114-116. |
| [14] | Kim HS, Kim DS, Lee EY, et al. CCR2-64Iand CCR5Delta32 polymorphisms in Korean patients with myasthenia gravis[J]. J Clin Neurol, 2007, 3(3): 133-138. |
| [15] | Huerta C, Alvarez V, Mata IF, et al. Chemokines (RANTES and MCP-1) and chemokine-receptors (CCR2 and CCR5) gene polymorphisms in Alzheimer's and Parkinson's disease[J]. Neurosci Lett, 2004, 370(2-3): 151-154. |
| [16] | Jordan MB, Allen CE, Weitzman S, et al. How I treat hemophagocytic lymphohistiocytosis[J]. Blood, 2011, 118(15): 4041-4052. |
| [17] | Trottestam H, Berglöf E, Horne A, et al. Risk factors for early death in children with haemophagocytic lymphohistiocytosis[J]. Acta Paediatr, 2012, 101(3): 313-318. |
| [18] | 陆文娴, 罗建明. 儿童噬血细胞性淋巴组织细胞增生症的预后因素分析[J]. 中国当代儿科杂志, 2012, 14(8): 593-597. |
| [19] | Onufer JJ, Horuk R. Chemokines, chemokine receptors and small-molecule antagonists: recent developments[J]. Trends Pharmacol Sci, 2002, 23(10): 459-467. |
| [20] | Abbadie C, Lindia JA, Cumiskey AM, et al. Impaired neuropathic pain responses in mice lacking the chemokine receptor CCR2[J]. Proc Natl Acad Sci U S A, 2003, 100(13): 7947-7952. |
 2015, Vol. 17
2015, Vol. 17