2. 西部妇幼医学研究院肺血管重构实验室, 四川 成都 610041
肺动脉平滑肌细胞(pulmonaryarterysmoothmusclecell,PASMC)的增殖和迁移是肺血管重构的主要特征,是肺动脉高压(PAH)、动脉粥样硬化等心血管疾病的共同发病基础[1,2,3]。研究表明,3-羟基-3-甲基戊二酰辅酶A还原酶(HMGCOA)抑制剂辛伐他汀能抑制PASMC增殖[4,5],但具体机制尚不清楚;核转录因子kappaB(nucleartranscriptionfactorkappaB,NF-κB)具有促进炎症发生、抗凋亡作用,直接参与细胞周期调控,激活的NF-κB可促进细胞增殖[6,7]。但是,NF-κB是否在辛伐他汀抑制PASMC增殖过程中发挥作用尚不明确。因此,本研究拟通过培养大鼠PASMC,给予血小板源性生长因子(PDGF)刺激增殖,并给予辛伐他汀进行干预,检测PASMC增殖及细胞周期变化,同时观察NF-κB的表达情况,探讨辛伐他汀抑制PASMC增殖中可能的参与因子,为临床治疗逆转肺血管重构提供理论基础。 1 材料与方法 1.1 主要试剂与仪器
4周龄Sprague-Dawley(SD)雄性大鼠6只,体重250~400g,由四川大学华西医学院实验动物中心提供。胎牛血清、M199培养基(中国哈里公司),PDGF-BB、MTT、辛伐他汀、NF-κB抑制剂小白菊内酯(美国Sigma公司),兔抗鼠NF-κBp65多克隆抗体(美国CellSignaling公司),生物素标记的羊抗兔抗体(北京中杉公司);光学显微镜(日本Olympus公司),Leica显微镜(北京杰忠科科技有限公司),Image-Proplus计算机图像分析系统(美国MediaCybernetics公司),流式细胞仪(美国Coulter公司)。 1.2 大鼠PASMC培养及分组
SD大鼠用100g/L水合氯醛腹腔麻醉后,在无菌技术条件下切开胸腔,切取肺动脉,分离中膜,将中膜剪碎并接种到培养瓶中,加入胎牛血清少许,翻转培养瓶,在37℃、5%CO2条件下培养4h让组织贴壁后加入M199培养液(含有100g/L胎牛血清、10万IU/L青霉素和100mg/L链霉素),继续静置培养。PASMC呈特征性“波峰”、“波谷”状态生长,通过光镜和α-SM-actin免疫组化法鉴定证实。将3~5代生长旺盛的PASMC作为实验对象,并根据随机化原则将其分为4组:(1)对照组:仅给予M199基本培养基进行培养;(2)PDGF刺激组:实验前12h在M199基本培养基中加入PDGF(终浓度:10ng/mL[8]);(3)辛伐他汀干预组:实验前12h在M199基本培养基中加入PDGF(终浓度:10ng/mL)和辛伐他汀(10μmol/L[9]);(4)辛伐他汀联合小白菊内酯干预组(联合干预组):实验前12h在M199基本培养基中加入PDGF(终浓度:10ng/mL)、辛伐他汀(10μmol/L)和NF-κB抑制剂小白菊内酯(20μmol/L)。 1.3 MTT比色法检测细胞增殖情况
取对数生长期细胞,用2.5g/L胰酶消化后,加入M199培养基,制成细胞悬液,调整细胞浓度为1×105/mL,接种于96孔培养板中,每孔200μL。同条件继续在培养箱静置培养至每孔细胞约105个,按上述分组给予干预措施,每组6个复孔,并分别在实验开始后3h、6h、12h加入MTT溶液(5g/L)20μL,继续培养4h后,加入150μL二甲基亚砜(DMSO),振荡10min后选择492nm波长在酶标仪上测定各孔光吸收值(A)。1.4 流式细胞术检测细胞周期
按照1.3节中的方法取对数生长期细胞接种于6孔培养板中,每孔1mL,继续培养至细胞长满后,饥饿24h,分别按分组给予干预措施,每组6个样本,24h后终止实验,消化离心后(1000rpm离心5min),经PBS洗涤细胞,沉淀、吹打成单细胞悬液后,用4℃的70%冰乙醇固定,调整细胞浓度为1×106/mL,0.5mL/L碘化丙啶(PI)染色后,用流式细胞仪进行细胞周期测定。 1.5 免疫组织化学法检测NF-κB蛋白的表达
按照1.3节中的方法取对数生长期细胞接种于6孔培养板中,每孔1mL,在6孔板内预先放入已消毒的盖玻片,于37℃、5%CO2条件下让细胞贴壁过夜;分别按分组给予干预措施,每组6个样本,采用链霉素抗生物素蛋白-过氧化酶(SP)法检测细胞爬片,再经苏木素淡染、常规脱水、透明及封片;用OLYMPUS显微镜观察结果并照相,以PBS代替一抗作为阴性对照;在Leica显微镜(×400)下,逐一拍摄切片并录入电脑后,用Image-proplus6.0软件对图像进行分析处理,表达水平用平均光密度值(AOD)表示。 1.6 Real-TimePCR法检测NF-κBmRNA表达
选择NCBI基因数据库中大鼠NF-κBp65cDNA序列(GI:100135665),运用PrimerPremier5.0软件设计PCR扩增引物和探针。扩增NF-κBp65基因的引物合成及TaqMan探针修饰由上海生物工程有限公司合成并经质量检测。扩增NF-κBp65基因的引物:LeftPrimer为5'-TCTGGCGCAGAAGTTAGGT-3',RightPrimer为5'-CCAGAGACCTCATAGTTGT-3',NF-κBp65TaqMan探针的序列为5'-GGACTCAGCCGGAAGGCATT-3',产物的大小为96bp。用Ferments反转录试剂盒将提取的总RNA反转录合成cDNA,用于PCR扩增检测。PCR扩增用TAKARA扩增试剂盒配制反应体系,共30µL,包括模板5µL,热启动Taq酶(5u/µL)0.3µL,10×PCR缓冲液(Mg2+free)3µL,上下游引物(10µmol/L)各1µL,探针(10µmol/L)1µL,25mmol/LdNTP0.36µL,25mmol/LMgCl23µL,灭菌蒸馏水补足体积至30µL。PCR反应条件为:94℃预变性2min;94℃变性20s,60℃退火30s,共扩增45个循环。在延伸时采集荧光,形成荧光定量扩增动力曲线,根据曲线得到达到阈值的循环数(Ct值),用Ct值来表示各样本中NF-κBmRNA表达的情况,相对表达量用2-ΔΔCt法计算。 1.7 统计学处理
采用SPSS16.0统计软件包对数据进行统计学分析。计量资料以均数±标准差(x±s)表示,多组间的比较采用方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。 2 结果 2.1 各组PASMC增殖情况
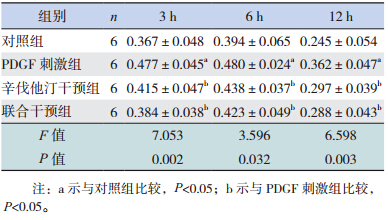
PDGF刺激组在各时间点MTT值均较对照组高(P<0.05);给予辛伐他汀干预及联合小白菊内酯干预后,各时间点MTT值较PDGF刺激组均降低(P<0.05);但是,两干预组之间各时间点MTT值比较差异均无统计学意义(P>0.05),见表 1。
| 表 1 不同时间点各组 PASMC 增殖情况比较 (x±s) |
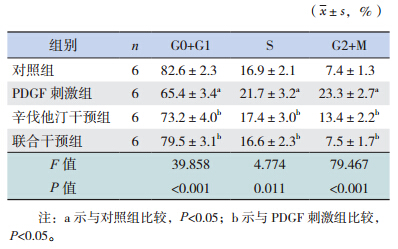
流式细胞术测定各组PASMC细胞周期结果显示,在培养24h后PDGF刺激组的G0+G1期细胞比例较对照组明显减少(P<0.05),S和G2+M期细胞比例较对照组明显增多(P<0.05);给予辛伐他汀及联合小白菊内酯干预后,S和G2+M期细胞比例明显减少,G0+G1期细胞比例明显增多,与PDGF刺激组比较差异均有统计学意义(P<0.05);但是,两干预组之间各细胞周期细胞比例比较差异均无统计学意义(P>0.05),见表 2。
| 表 2 各组 PASMC 培养 24 h 后的细胞周期比例比较 |
各组PASMC免疫组化结果显示,棕黄色为NF-κB蛋白胞浆内表达,蓝色为PASMC细胞核(图1);对各组AOD进行比较,差异有统计学意义(F=70.18,P<0.05);其中PDGF刺激组NF-κB蛋白表达水平(84±8)明显高于对照组(33±6,P<0.05);给予辛伐他汀干预后,NF-κB蛋白表达水平(45±7)较PDGF刺激组明显下降(P<0.05);联合小白菊内酯干预后,其表达(40±6)下降更明显,但是,与辛伐他汀干预组比较差异无统计学意义(P>0.05)。
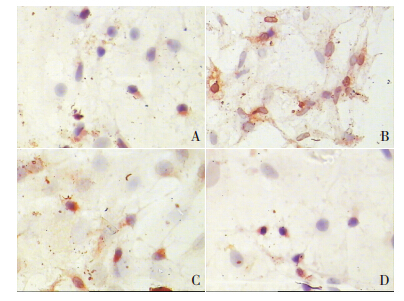 | 图 1 各 组 PASMC 的 NF-κB蛋白表达(SP 法,×400) A: 对照组 PASMC 中 NF-κB 蛋白表达少;B:PDGF刺激组的 NF-κB 蛋白表达较对照组增多;C:辛伐他汀干预组的NF-κB 蛋白表达水平较 PDGF 刺激组明显下降;D:联合干预组的NF-κB 蛋白表达水平较 PDGF 刺激组亦明显下降。NF-κB 蛋白胞浆内阳性表达呈棕黄色,PASMC 细胞核呈蓝色。 |
Real-TimePCR检测各组NF-κBmRNA的表达水平差异有统计学意义(F=5.711,P<0.05);其中PDGF刺激组NF-κBmRNA表达水平(1.50±0.18)明显高于对照组(1.06±0.38,P<0.05);给予辛伐他汀干预后,NF-κBmRNA表达水平(0.95±0.35)较PDGF刺激组显著下降(P<0.05);联合小白菊内酯干预后,其表达(0.76±0.34)下降更明显(P<0.05),但是,与辛伐他汀干预组比较差异无统计学差异(P>0.05)。 3 讨论
肺血管重构是PAH的主要病理特征,包括血管内皮细胞和肺动脉平滑肌细胞(PASMC)异常增殖、小动脉管腔狭窄甚至阻塞等[1]。故调整体内血管舒张和收缩物质的平衡、抑制血管平滑肌细胞增殖和减轻甚至逆转肺血管重构的治疗手段是目前PAH药物治疗的研究热点[2,3]。药物包括前列环素、内皮素受体拮抗剂、磷酸二酯酶抑制剂5型、一氧化氮供体(L-精氨酸)等[10]。3-羟基-3-甲基戊二酰辅酶A还原酶(HMG-COA)抑制剂,即他汀类药物是目前临床广泛应用的调整血脂药物。大规模临床研究已证实,他汀类药物所带来的临床益处已远远超过其血脂调节作用,其还可通过改善血管内皮功能,抑制血管平滑肌细胞增殖和迁移,调节细胞调亡等,改善PAH等疾病的预后[5,11,12,13]。
NF-κB是一组由B细胞核提取物中发现的能与免疫球蛋白κ轻链基因的增强子κB序列特异结合的蛋白因子[14]。在生长因子、细胞因子、内毒素、促肿瘤剂以及癌基因等刺激下,NF-κB被激活,上调下游信号的表达,从而引起增殖失衡、细胞凋亡等变化[15,16]。研究表明,他汀类药物可通过抑制NF-κB的表达从而干预如糖尿病、动脉粥样硬化症等疾病的进程[17,18,19]。但是,在肺血管重构中肺血管平滑肌细胞增殖的病理生理过程,他汀类药物是否可通过对NF-κB作用而抑制PASMC的增殖尚不清楚。
本研究通过辛伐他汀及NF-κB抑制剂小白菊内酯对PASMC的干预发现,在PDGF的刺激作用下,PASMC细胞增殖得到促进,辛伐他汀干预使PASMC细胞增殖受到抑制,联合NF-κB抑制剂小白菊内酯进行干预,抑制作用更加明显。免疫组织化学、Real-TimePCR研究也得出相似的结果,PDGF的刺激使PASMC的NF-κB蛋白和mRNA表达都明显增加,给予辛伐他汀及联合小白菊内酯干预,均使PASMC中的NF-κB蛋白及mRNA表达明显减少,且联合小白菊内酯干预后下降更加明显。因此,本研究结果表明辛伐他汀能抑制PASMC的增殖,抑制细胞周期进程,NF-κB信号因子参与了辛伐他汀对PASMC的增殖抑制,但是否参与调节PAH肺血管重构有待进一步研究。
| [1] | Tuder RM, Stacher E, Robinson J, et al. Pathology of pulmonary hypertension[J]. Clin Chest Med, 2013, 34(4): 639-650. |
| [2] | Villegas LR, Kluck D, Field C, et al. Superoxide dismutase mimetic, MnTE-2-PyP, attenuates chronic hypoxia-induced pulmonary hypertension, pulmonary vascular remodeling, and activation of the NALP3 inflammasome[J]. Antioxid Redox Signal, 2013, 18(14): 1753-1764. |
| [3] | 刘瀚旻. 先天性心血管畸形的肺血管重构:一个历久弥新的话题[J]. 中国当代儿科杂志, 2013, 15(10): 805-809. |
| [4] | Gao C, Xu W, Xiao W, et al. Simvastatin decreases stent-induced in-stent restenosis rate via downregulating the expression of PCNA and upregulating that of p27kip1[J]. J Interv Cardiol, 2013, 26(4): 384-391. |
| [5] | Zhang Z, Zhang M, Li Y, et al. Simvastatin inhibits the additive activation of ERK1/2 and proliferation of rat vascular smooth muscle cells induced by combined mechanical stress and oxLDL through LOX-1 pathway[J]. Cell Signal, 2013, 25(1): 332-340. |
| [6] | Shen RR, Zhou AY, Kim E, et al. TRAF2 is an NF-κB-activating oncogene in epithelial cancers[J]. Oncogene, 2015, 34(2): 209-216. |
| [7] | Jeong IK, Oh da H, Park SJ, et al. Inhibition of NF-κB prevents high glucose-induced proliferation and plasminogen activator inhibitor-1 expression in vascular smooth muscle cells[J]. Exp Mol Med, 2011, 43(12): 684-692. |
| [8] | 罗勤, 高正祥, 曹丽丽, 等. 脾酪氨酸激酶对大鼠肺血管平滑肌细胞增殖的作用[J]. 中国当代儿科杂志, 2010, 12(11): 886-890. |
| [9] | 李峻岭, 姜盛花, 段颖欣, 等. 硫酸吲哚酚对大鼠主动脉平滑肌细胞钙化影响的实验研究[J]. 中华临床医师杂志(电子版), 2013, 7(18): 8335-8338. |
| [10] | 纪晓玲, 郭晓玲. 左心疾病相关性肺动脉高压的诊治进展[J]. 心血管病防治知识(学术版), 2014, (2): 155-157. |
| [11] | Zeng WJ, Xiong CM, Zhao L, et al. Atorvastatin in pulmonary arterial hypertension(APATH) study[J]. Eur Respir J, 2012, 40(1): 67-74. |
| [12] | Zhao G, Yu YM, Kaneki M, et al. Simvastatin protects hepatocytes from apoptosis by suppressing the TNF-α/caspase-3 signaling pathway in mice with burn injury[J]. Ann Surg, 2013, 257(6): 1129-1136. |
| [13] | Kou R, Shiroto T, Sartoretto JL, et al. Suppression of Gαs synthesis by simvastatin treatment of vascular endothelial cells[J]. J Biol Chem, 2012, 287(4): 2643-2651. |
| [14] | DiDonato JA, Mercurio F, Karin M. NF-κB and the link between inflammation and cancer[J]. Immunol Rev, 2012, 246(1): 379-400. |
| [15] | Yang C, Ling H, Zhang M, et al. Oxidative stress mediates chemical hypoxia-induced injury and inflammation by activating NF-κb-COX-2 pathway in HaCaT cells[J]. Mol Cells, 2011, 31(6): 531-538. |
| [16] | Gong J, Xie J, Bedolla R, et al. Combined targeting of STAT3/NF-κB/COX-2/EP4 for effective management of pancreatic cancer[J]. Clin Cancer Res, 2014, 20(5): 1259-1273. |
| [17] | Andreasen AS, Kelly M, Berg RMG, et al. Type 2 diabetes is associated with altered NF-κB DNA binding activity, JNK phosphorylation, and AMPK phosphorylation in skeletal muscle after LPS[J]. PLoS One, 2011, 6(9): e23999. |
| [18] | Baumann B, Salem HH, Boehm BO. Anti-inflammatory therapy in type 1 diabetes[J]. Curr Diab Rep, 2012, 12(5): 499-509. |
| [19] | Fang D, Yang S, Quan W, et al. Atorvastatin suppresses Toll-like receptor 4 expression and NF-κB activation in rabbit atherosclerotic plaques[J]. Eur Rev Med Pharmacol Sci, 2014, 18(2): 242-246.. |
 2015, Vol. 17
2015, Vol. 17