微小核糖核酸(microRNA,miRNA)是广泛存在于各种生物体内的一种短小的内源性非编码蛋白RNA片段,长约20~25个核苷酸的序列,通常在转录后水平调控基因表达。miRNA表达具有同源性、保守性、时序性和组织特异性。大多数动物的miRNA通过与靶序列不完全互补碱基配对来抑制蛋白质的翻译,实现其生物调节作用。癫癎是一类以反复发作的抽搐为主要临床表现的严重的慢性神经系统疾病,是大脑神经元异常高度同步放电的结果[1]。全球约有5000万癫癎患者,我国约有癫癎患者1000万人,每年新发癫癎患者40万例,约3/4的癫癎患者起病于儿童时期[2],构成了巨大的社会经济学负担。目前国内外文献共发现在癫癎患者或动物模型中有差异表达的miRNA有100多种。其中超过20种miRNA在多篇文献中均有报道。这些miRNA可能在神经系统炎症、突触重塑、神经元坏死、凋亡、轴突损伤、树突生长、神经递质及其受体功能障碍、胶质细胞增生、癫癎网络形成等方面起着重要的调节作用。特别是炎症、突触重塑(包括苔藓纤维出芽、树突棘数量及形态的改变等)等导致海马内回返兴奋性环路的形成,造成了癫癎网络的发生。表 1列出了近年报道的与癫癎发生发展密切相关的miRNA,下面就其在癫癎中的研究进展作一综述。
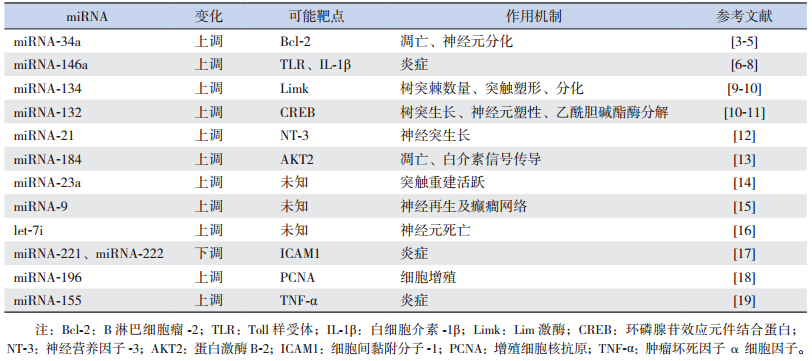
| 表 1 癫癎中 miRNA 的改变及其可能的靶点 |
miRNA-134是一种大脑特异性miRNA,其转录由Mef2介导,调控着神经元的微观结构[20]。在离体实验中,它的表达与树突棘体积相关[20]。具体机制是miRNA-134调控树突的Limk1所致:Limk1磷酸化后促进纤维状肌动蛋白形成,后者可增加树突棘体积,并呈持续作用。miRNA-134通过增加树突棘中球型肌动蛋白来抑制Limk1,进而使得树突棘崩解,这与Limk1敲除小鼠模型的改变一致[21]。树突棘的形成和降解的动态变化被认为是突触重塑的标志,而突触重塑导致兴奋性神经环路形成最终可促进癫癎的反复发生及慢性长期维持。鉴于树突棘体积与突触兴奋强度相关,强烈提示miRNA-134与癫癎相关。这一发现在在体实验中进一步得到证实:Christensen等[22]研究发现miRNA-134的过度表达使皮质层锥体神经元的树突分枝减少。
在各种癫癎模型在体实验中,均检测到miRNA-134水平上升[9,14,23],并且在模型中及癫癎患者海马中也检测到了类似的改变。可见miRNA-134的上调在大脑病理改变中十分常见,因此研究者们通过拮抗剂进一步探究miRNA-134的功能。Jimenez-Mateos等[9]研究发现抑制miRNA-134后大鼠的癫癎发作减少了90%以上,海马的损伤也明显减少。在离体实验中,通过拮抗剂证实miRNA-134除了能降低癫癎严重程度之外,还能直接起到神经保护作用。这些研究均证明了对单个miRNA的调控能够降低大脑病理改变。Jimenez-Mateos还对miRNA-134在癫癎慢性期的作用进行了研究发现拮抗剂处理组的大鼠在癫癎持续状态发生后的2周、4周、8周内,癫癎的发作频率明显降低,并通过组织学的研究提示miRNA-134与退行性病变(神经元丧失、胶质细胞增生聚集)有关,从而推测miRNA-134在癫癎发生、发展中起着重要作用。此研究被视为miRNA在癫癎临床应用转化上的里程碑。 2 miRNA-146a
miRNA中第一个发现与炎症相关的是miRNA-146a[6,8]。在正常脑组织,miRNA-146a通常由神经元而非胶质细胞表达,体现了其表达的细胞与组织特异性。它调节着细胞因子信号通路和Toll样受体(TLR)信号通路,与炎症性疾病有着密切关系。炎症反应在癫癎的发生发展中起着重要的作用,是导致癫癎发作后脑组织病理改变(海马内神经元脱失、神经元凋亡、胶质细胞增生、苔藓纤维出芽、海马硬化)的主要原因,而脑组织的这些病理变化又使癫癎呈现反复发作,是癫癎频繁发作和难以根治的主要原因之一。Aronica等[6]研究发现,在大鼠癫癎模型和癫癎患者海马区的miRNA-146a均表达升高;Omran等[8]研究也显示,在儿童颞叶内侧癫癎病变区的炎症因子IL-lβ及miRNA-146a的表达有明显变化,而且其变化情况呈癫癎分期依赖性:在急性期,IL-lβ达峰值,而miRNA-146a则呈最低表达;在潜伏期,结果则完全相反。由此推测,miRNA-146a通过抑制IL-lβ来调控炎症反应,但这与TNF-α和高迁移率族蛋白1(HMGB1)无关[7]。该研究使得IL-1β-miRNA-146a通路成为抗癫癎治疗的新靶点。但须提到的是在这两个研究中,均有海马硬化,因此不知道miRNA-146a是否在非海马硬化的模型或患者中有类似变化。国内学者肖慧媚等[24]研究发现在耐药性癫癎患儿血清中miRNA-146a-5p的表达量明显高于非耐药性癫癎,推测miRNA-146a-5p过度调节炎症反应从而调控耐药性癫癎的发生、发展。癫癎相关在体实验中miRNA-146a的靶基因尚未明确,但离体实验提示可能作用于前炎症蛋白IRAK1/2和TRAF6以及负反馈抑制IL-lβ[7]。 3 miRNA-34a
miRNA中第一个发现与凋亡相关的是miRNA-34a[25],它是p53基因的靶点[26]。据文献报道,miRNA-34a可以调控100多种蛋白表达[27],其表达水平的上调可以直接诱导凋亡、并终止细胞周期。癫癎持续状态后海马神经元会出现凋亡,而miRNA-34a作为一种凋亡相关的miRNA参与、介导了这一凋亡过程,国内外已有数例研究证实了这一点。Hu等[28]第一次在癫癎模型发现miRNA-34a的上调,但其似乎具有模型特异性,在海人酸癫癎模型[3]和颞叶癫癎患者的脑组织中[29]并未发现其明显的改变,这表明miRNA-34a主要于癫癎损伤早期发挥作用。也有学者利用拮抗剂来验证miRNA-34a的作用,但结果却不太一致。例如Sano等[29]发现尽管miRNA-34a可以激活caspase-3,但对于癫癎导致的神经元死亡并无明显作用。而Hu等[30]发现miRNA-34a可以激活caspase-3,而且可以通过miRNA-34aantagomiRNA抑制miRNA-34a—bcl-2—caspase-3通路,减少海马CA1区和CA3区神经元死亡,促进神经元存活。此外,Aranha等[31]在研究中发现凋亡相关的miRNA-34a不仅具有促凋亡作用,还与神经元分化等过程相关。 4 miRNA-132
miRNA-132属于miRNA-212/132家族,并且靶向作用于乙酰胆碱酯酶而起到拟胆碱作用、增加兴奋性、增强海马功能及抗炎作用[32,33]。同时,miRNA-132被发现与树突生成和形态学有关[34,35],它的缺失与树突的长度及分枝减少有关[10]。miRNA-132第一个被证实的靶基因是皮质神经元中的p250RhoGAP[35]。通过miRNA132-p250GAP通路,诱导神经元生长及调控未成熟皮质和海马神经元的树突形态。cAMP反应元件结合蛋白(CREB)控制着miRNA-132的转录[36],而且通过miRNA促进海马神经元的生长与成熟[10]。Nudelman等[11]研究发现miRNA-132在匹罗卡品癫癎模型中明显升高,调控着神经元塑性。Jimenez-Mateos等[23]发现抑制miRNA-132的过度表达可以减少癫癎持续状态后的神经元损伤。MeCP2可能是miRNA-132的另外一个靶点,前者的缺失可以促进认知损伤、兴奋性增加及癫癎的发生[37]。到目前为止,癫癎在体实验中miRNA-132的靶基因尚未明确。 5 miRNA-184
miRNA-184在干细胞的增殖和生长中起重要的作用。它是一个高度保守的单拷贝基因,可以作用于非常多的靶mRNA。成熟的miRNA-184在脑内局限于人体侧脑室室管膜下和海马齿状回这两个持续神经元形成的区域内,并且受甲基化CPG结合蛋白的调控[38],它与甲基化CPG结合蛋白1和Numbl形成一个调控初级神经干细胞的增殖和分化平衡的网络。miRNA-184既可诱导凋亡,又可抑制凋亡,如在神经母细胞瘤中高表达的miRNA-184可诱导大量瘤细胞凋亡和G1期停滞[39];另有研究发现miRNA-184也主要表达于海马CA3区和CA1区的椎体神经元内,而且具有抑制神经元凋亡的作用[13],在癫癎患者的海马神经元内高表达的miRNA-184可能通过抑制AKT2的表达来抑制神经元凋亡从而发挥神经保护作用[13]。国内学者杨武芬等[40]报道,miRNA-184在癫癎患者脑脊液中的表达有显著升高且与癫癎脑组织内的变化一致,推测miRNA-184在癫癎发生发展过程中可能通过Akt2抑制神经元凋亡起到神经元保护作用。McKiernan等[13]也通过拮抗剂研究发现miRNA-184在癫癎模型中可以促进神经元细胞的存活。 6 miRNA-21
miRNA-21在多种脑损伤模型中均表达上升,如卒中、外伤、癫癎持续状态模型,其在肿瘤性疾病中也有广泛的表达[41]。Risbud等[12]和Elmér等[42]在离体海马神经元癫癎持续状态模型中发现miRNA-21升高,同时神经营养因子-3(NT-3)下降,NT-3的缺失可以减少神经细胞存活,神经突生长及抑制癫癎的发生,因此推测存在miRNA-21—NT-3通路。此外,Peng等[43]研究发现miRNA-21与miRNA-146a一样,在颞叶癫癎模型各期的表达呈动态变化,但其趋势与miRNA-146a相反:在急性期,miRNA-21明显升高,推测其在癫癎形成早期发挥作用;而在潜伏期,miRNA-21则下降,具体作用需进一步研究。 7 miRNA-23a
Song等[14]研究发现,匹罗卡品所致颞叶癫癎大鼠模型的癫癎持续状态后24h海马中的miRNA-23a表达量上升,同期大鼠海马中的突触重建活跃。miRNA-23a在胶质瘤Ⅱ、Ⅲ级中表达逐渐上调,以在胶质瘤Ⅲ级中表达水平最高,由此表明miRNA-23参与调控神经胶质细胞的增生分化。大量研究表明耐药性癫癎耐药机制与胶质细胞增生、突触重建密切相关。肖慧媚等[24]研究发现miRNA-23a-3p可能是通过调节神经胶质细胞的增生以及突触重建调控着耐药性癫癎的形成。 8 miRNA-9
与miRNA-124a类似,miRNA-9是一种神经系统特异性的miRNA,在脑组织中丰富表达,在海马再生过程中,具有促进神经再生的作用。但在癫癎后海马区中miRNA-9具有表达水平的改变,可能促进海马区内的神经再生及异常网络形成,进而加速癫癎的发展[15]。胡凯[15]研究发现癫癎持续状态后1、7、14dmiRNA-9均表达升高,在癫癎持续状态后14d达到高峰,在癫癎持续状态后2个月表达水平明显回落、与正常对照组不具有明显差异。miRNA-9同时还具有调控神经祖细胞行为学的作用,其表达上调在神经元分化和迁徙过程中具有重要意义[44]。但miRNA-9是否与癫癎的发生、发展有关,是否能够将miRNA-9作为癫癎治疗靶点尚待进一步深入研究和探讨。 9 其他miRNA
目前的一个研究热点是对大脑中miRNA的直接靶点的研究,如Toll样受体(TLR)。TLR4在大鼠癫癎模型中表达上调[45],其配体来源于可引起癫癎的损伤神经元释放的HMGB1,最新的研究表明TLR4作为miRNA的靶基因,直接受其调控,其中包括let-7i[16]。miRNA-155可能通过TLR靶作用于TNF-α而导致炎症的发生,进而与颞叶癫癎的发生有关[19]。miRNA-196b与胶质瘤相关的癫癎有关,可作为胶质瘤相关癫癎发病率的生物标记,且对术前无癫癎发作病人的预后有提示作用,极有可能成为相关的治疗靶点[18]。 10 总结与展望
miRNA的发现与深入研究,犹如一道曙光照进了儿童神经系统疾病,如缺氧缺血性脑损伤、神经管缺失、神经发育与神经精神疾病、中枢神经系统肿瘤、神经肌肉疾病、神经系统感染等,miRNA在其发生发展中均扮演了重要的角色[46]。近年来,miRNA在癫癎发生、发展中作用机制的研究如雨后春笋般地涌现出来。生理情况下,miRNA参与了神经保护、树突棘形成、突触联系、神经干细胞分化、神经系统发生和发育和等信号通路的基因表达调控。病理情况下,miRNA可能在神经系统炎症、神经元坏死、凋亡、海马区神经再生、海马区新生颗粒细胞异位迁徙、新生颗粒细胞树突形态发育异常、轴突损伤、突触重塑、苔藓纤维出芽、神经递质及其受体功能障碍、离子通道基因改变、胶质细胞增生等方面起着重要的调节作用,进而在癫癎发生、发展中扮演着重要角色。进一步可以通过生物信息学分析方法,如功能富集分析(geneontologyanalysis)及靶基因信号转导通路富集分析(KEGGpathawayanalysis)明确miRNA在癫癎中的可能机制[47]。
miRNA可以从血清、脑脊液中轻松获得,而且十分稳定,脑脊液中的表达情况与外周血基本一致,而且不同的疾病(癫癎、外伤、卒中、出血等)miRNA的表达谱也不同。因此,miRNA作为新的癫癎的生物标记物有着不错的前景。随着miRNA拮抗剂与激动剂的发展,使得miRNA成为癫癎新的治疗靶点成为可能。但目前尚处入实验阶段,尚未广泛应用于临床,且存在着诸多有待解决的问题,如由于拮抗剂无法通过完整的血脑屏障,目前主要仍采用侧脑室内注射给药,这很大程度制约了拮抗剂在神经系统疾病治疗的推广。虽有研究表明癫癎持续状态或慢性癫癎患者的血脑屏障受损后可允许拮抗剂透过其到达靶组织,但具体透过情况、脑组织聚集浓度及治疗效果等都有待进一步的研究。
综上所述,miRNA的出现为我们开启了一个全新的研究方向和思路,拓展了我们对于癫癎发生机制的基因调控的认识,但是这些认识还只处于初级阶段。目前大部分关于miRNA在细胞和动物中的作用和机制的研究还处于离体水平,仍需要进一步对miRNA的潜在靶点及其对癫癎的诊断和治疗影响进行探讨。相信在不久的将来,miRNA极有可能成为癫癎新的生物标记和治疗靶点,在癫癎的诊疗中发挥更大的作用。目前需要进一步对miRNA的潜在靶点及其对神经系统疾病的诊断和治疗进行探讨。
| [1] | Chang BS, Lowenstein DH. Epilepsy[J]. N Engl J Med, 2003, 349(13): 1257-1266. |
| [2] | Omran A, Elimam D, Yin F. MicroRNAs: new insights into chronic childhood diseases[J]. Biomed Res Int, 2013, 2013: 291826. |
| [3] | Sano T, Reynolds J, Jimenez-Mateos EM, et al. MicroRNA-34a upregulation during seizure-induced neuronal death[J]. Cell Death Dis, 2012, 3(3): e287. |
| [4] | Tivnan A, Tracey L, Buckley PG, et al. MicroRNA-34a is a potent tumor suppressor molecule in vivo in neuroblastoma[J]. BMC Cancer, 2011, 11(1): 33. |
| [5] | Henshall DC. MicroRNAs in the pathophysiology and treatment of status epilepticus[J]. Front Mol Neurosci, 2013, 6: 37. |
| [6] | Aronica E, Fluiter K, Iyer A, et al. Expression pattern of miR-146a, an inflammation-associated microRNA, in experimental and human temporal lobe epilepsy[J]. Eur J Neurosci, 2010, 31(6): 1100-1107. |
| [7] | Iyer A, Zurolo E, Prabowo A, et al. MicroRNA-146a: a key regulator of astrocyte-mediated inflammatory response[J]. PloS One, 2012, 7(9): e44789. |
| [8] | Omran A, Peng J, Zhang C, et al. Interleukin-1beta and microRNA-146a in an immature rat model and children with mesial temporal lobe epilepsy[J]. Epilepsia, 2012, 53(7): 1215-1224. |
| [9] | Jimenez-Mateos EM, Engel T, Merino-Serrais P, et al. Silencing microRNA-134 produces neuroprotective and prolonged seizure-suppressive effects[J]. Nat Med, 2012, 18(7): 1087-1094. |
| [10] | Magill ST, Cambronne XA, Luikart BW, et al. microRNA-132 regulates dendritic growth and arborization of newborn neurons in the adult hippocampus[J]. Proc Natl Acad Sci U S A, 2010, 107(47): 20382-20387. |
| [11] | Nudelman AS, DiRocco DP, Lambert TJ, et al. Neuronal activity rapidly induces transcription of the CREB-regulated microRNA-132, in vivo[J]. Hippocampus, 2010, 20(4): 492-498. |
| [12] | Risbud RM, Lee C, Porter BE. Neurotrophin-3 mRNA a putative target of miR21 following status epilepticus[J]. Brain Res, 2011, 1424: 53-59. |
| [13] | McKiernan RC, Jimenez-Mateos EM, Sano T, et al. Expression profiling the microRNA response to epileptic preconditioning identifies miR-184 as a modulator of seizure-induced neuronal death[J]. Exp Neurol, 2012, 237(2): 346-354. |
| [14] | Song Yj, Tian Xb, Zhang S, et al. Temporal lobe epilepsy induces differential expression of hippocampal miRNAs including let-7e and miR-23a/b[J]. Brain Res, 2011, 1387: 134-140. |
| [15] | 胡凯. 癫癎大鼠海马miRNAs表达谱和 miR-34a与-9在癫癎发生中动态变化的研究[D]. 中南大学学位论文, 2012. |
| [16] | Chen XM, Splinter PL, O'Hara SP, et al. A cellular micro-RNA, let-7i, regulates Toll-like receptor 4 expression and contributes to cholangiocyte immune responses against Cryptosporidium parvum infection[J]. J Biol Chem, 2007, 282(39): 28929-28938. |
| [17] | Kan AA, van Erp S, Derijck AA, et al. Genome-wide microRNA profiling of human temporal lobe epilepsy identifies modulators of the immune response[J]. Cell Mol Life Sci, 2012, 69(18): 3127-3145. |
| [18] | You G, Yan W, Zhang W, et al. Significance of miR-196b in tumor-related epilepsy of patients with gliomas[J]. PloS One, 2012, 7(9): e46218. |
| [19] | Ashhab MU, Omran A, Kong H, et al. Expressions of tumor necrosis factor alpha and microRNA-155 in immature rat model of status epilepticus and children with mesial temporal lobe epilepsy[J]. J Mol Neurosci, 2013, 51(3): 950-958. |
| [20] | Schratt GM, Tuebing F, Nigh EA, et al. A brain-specific microRNA regulates dendritic spine development[J]. Nature, 2006, 439(7074): 283-289. |
| [21] | Meng Y, Zhang Y, Tregoubov V, et al. Abnormal spine morphology and enhanced LTP in LIMK-1 knockout mice[J]. Neuron, 2002, 35(1): 121-133. |
| [22] | Christensen M, Larsen LA, Kauppinen S, et al. Recombinant adeno-associated virus-mediated microRNA delivery into the postnatal mouse brain reveals a role for miR-134 in dendritogenesis in vivo[J]. Front Neural Circuit, 2009, 3: 16. |
| [23] | Jimenez-Mateos EM, Bray I, Sanz-Rodriguez A, et al. miRNA expression profile after status epilepticus and hippocampal neuroprotection by targeting miR-132[J]. Am J Pathol, 2011, 179(5): 2519-2532. |
| [24] | 肖慧媚, 廖建湘, 蒋莉. 微小核糖核酸miR-146a-5p, miR-23a-3p 在儿童耐药性癫癎血清中的表达[J]. 中国神经精神疾病杂志, 2013, 39(8): 500-503. |
| [25] | Hermeking H. The miR-34 family in cancer and apoptosis[J]. Cell Death Differ, 2010, 17(2): 193-199. |
| [26] | Tarasov V, Jung P, Verdoodt B, et al. Differential regulation of microRNAs by p53 revealed by massively parallel sequencing[J]. Cell Cycle, 2007, 6(13): 1586-1593. |
| [27] | Kaller M, Liffers ST, Oeljeklaus S, et al. Genome-wide characterization of miR-34a induced changes in protein and mRNA expression by a combined pulsed SILAC and microarray analysis[J]. Mol Cell Proteomics, 2011, 10(8): M111. 010462. |
| [28] | Hu K, Zhang C, Long L, et al. Expression profile of microRNAs in rat hippocampus following lithium-pilocarpine-induced status epilepticus[J]. Neurosci Lett, 2011, 488(3): 252-257. |
| [29] | Sano T, Reynolds JP, Jimenez-Mateos EM, et al. MicroRNA-34a upregulation during seizure-induced neuronal death[J]. Cell Death Dis, 2012, 3: e287. |
| [30] | Hu K, Xie YY, Zhang C, et al. MicroRNA expression profile of the hippocampus in a rat model of temporal lobe epilepsy and miR-34a-targeted neuroprotection against hippocampal neurone cell apoptosis post-status epilepticus[J]. BMC Neurosci, 2012, 13(1): 115. |
| [31] | Aranha MM, Santos DM, Xavier JM, et al. Apoptosis-associated microRNAs are modulated in mouse, rat and human neural differentiation[J]. BMC Genomics, 2010, 11(1): 514. |
| [32] | Shaked I, Meerson A, Wolf Y, et al. MicroRNA-132 potentiates cholinergic anti-inflammatory signaling by targeting acetylcholinesterase[J]. Immunity, 2009, 31(6): 965-973. |
| [33] | Shaltiel G, Hanan M, Wolf Y, et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target[J]. Brain Struct Funct, 2013, 218(1): 59-72. |
| [34] | Vo N, Klein ME, Varlamova O, et al. A cAMP-response element binding protein-induced microRNA regulates neuronal morphogenesis[J]. Proc Natl Acad Sci U S A, 2005, 102(45): 16426-16431. |
| [35] | Wayman GA, Davare M, Ando H, et al. An activity-regulated microRNA controls dendritic plasticity by down-regulating p250GAP[J]. Proc Natl Acad Sci U S A, 2008, 105(26): 9093-9098. |
| [36] | Wanet A, Tacheny A, Arnould T, et al. miR-212/132 expression and functions: within and beyond the neuronal compartment[J]. Nucleic Acids Res, 2012, 40(11): 4742-4753. |
| [37] | Lusardi TA, Farr CD, Faulkner CL, et al. Ischemic preconditioning regulates expression of microRNAs and a predicted target, MeCP2, in mouse cortex[J]. J Cereb Blood Flow Metab, 2010, 30(4): 744-756. |
| [38] | Nomura T, Kimura M, Horii T, et al. MeCP2-dependent repression of an imprinted miR-184 released by depolarization[J]. Hum Mol Genet, 2008, 17(8): 1192-1199. |
| [39] | Chen Y, Stallings RL. Differential patterns of microRNA expression in neuroblastoma are correlated with prognosis, differentiation, and apoptosis[J]. Cancer Res, 2007, 67(3): 976-983. |
| [40] | 杨武芬, 刘华, 郑颖, 等. 癫癎患者脑脊液和血清中miRNA-184的表达[J]. 中风与神经疾病杂志, 2014, 31(7): 615-618. |
| [41] | Gabriely G, Wurdinger T, Kesari S, et al. MicroRNA 21 promotes glioma invasion by targeting matrix metalloproteinase regulators[J]. Mol Cell Biol, 2008, 28(17): 5369-5380. |
| [42] | Elmér E, Kokaia M, Ernfors P, et al. Suppressed kindling epileptogenesis and perturbed BDNF and TrkB gene regulation in NT-3 mutant mice[J]. Exp Neurol, 1997, 145(1): 93-103. |
| [43] | Peng J, Omran A, Ashhab MU, et al. Expression patterns of miR-124, miR-134, miR-132, and miR-21 in an immature rat model and children with mesial temporal lobe epilepsy[J]. J Mol Neurosci, 2013, 50(2): 291-297. |
| [44] | Uchida N. MicroRNA-9 controls a migratory mechanism in human neural progenitor cells[J]. Cell Stem Cell, 2010, 6(4): 294-296. |
| [45] | Maroso M, Balosso S, Ravizza T, et al. Toll-like receptor 4 and high-mobility group box-1 are involved in ictogenesis and can be targeted to reduce seizures[J]. Nat Med, 2010, 16(4): 413-419. |
| [46] | Omran A, Elimam D, Shalaby S, et al. MicroRNAs: a light into the "black box" of neuropediatric diseases?[J]. Neuromol Med, 2012, 14(4): 244-261. |
| [47] | 杨洋, 阚清, 张盼, 等. MiRNA-126*靶基因预测及其相关信号通路的生物信息学分析[J]. 中国当代儿科杂志, 2013, 15(3): 227-232. |
 2015, Vol. 17
2015, Vol. 17