2. 常州市妇幼保健院, 江苏 常州 213000;
3. 镇江市妇幼保健院, 江苏 镇江 212001
据统计,目前我国早产儿出生率约为8.1%[1], 其发生原因部分与宫内感染有关,宫内感染可引 起胎儿炎症反应综合征(fetal inflammatory response syndrome,FIRS),导致多脏器损伤[2, 3]。研究 报道,有绒毛膜羊膜炎暴露的早产儿,其罹患 严重的脑室周围- 脑室内出血(periventricularintraventricular hemorrhage,PVH-IVH)或脑室周围 白质软化(periventricular leukomalacia,PVL)等脑 损伤的风险会明显增加[4, 5]。孕母绒毛膜羊膜炎可 引起FIRS,FIRS 是胎儿免疫系统活化释放大量致 炎因子(IL-6、IL-1、IL-8、TNF-α 等)而导致的 一种亚临床状态,这些致炎因子可干扰胎儿大脑 细胞因子的正常表达,导致早产儿脑损伤[6]。目前 联合胎盘炎症及FIRS 研究早产儿脑损伤的报道较 少,本研究基于胎盘病理检查及相关细胞因子检 测,探讨胎盘炎症及FIRS 与早产儿脑损伤的关系, 为早产儿脑损伤的预防及早期监测提供临床依据。 1 资料与方法 1.1 一般资料
选取2012 年8 月至2013 年10 月在江苏大学 附属医院、常州市妇幼保健院、镇江市妇幼保健 院产科分娩的胎龄<34 周伴有胎膜早破(premature rupture of the membranes,PROM)的单胎早产儿为 研究对象。排除以下病例:(1)母亲有合并症, 如妊娠期糖尿病、妊娠高血压综合征、胎盘早剥、 前置胎盘及妊娠合并心脏病等;(2)胎儿有遗传 代谢疾病、神经系统畸形、围生期后感染性疾病 和其它系统畸形。 1.2 胎盘组织病理检查
胎盘及胎膜于娩出后以胎盘破口为中心取 4 cm×4 cm 胎膜组织并制成胎膜卷,在胎盘中心、 中间带及边缘多点取材。要同时包括羊膜、绒毛 膜板、绒毛及蜕膜。标本经10%甲醛固定,石蜡 包埋切片,苏木精- 伊红染色,切片由病理科高 年资医生专人负责阅片,并对其在临床信息方面 施盲。 1.3 脐带血细胞因子检测
胎儿出生断脐后从胎盘端行脐静脉穿刺抽 取脐血3 mL,静置10 min 后离心(2 000 r/min) 10 min,留取血清,保存于-70℃待检,用液相芯 片分析仪检测白细胞介素-6(IL-6)、白细胞介素-8 (IL-8)、肿瘤坏死因子-α(TNF-α)、粒细胞集 落刺激因子(G-CSF)(试剂盒购自美国默克密理 博公司),操作方法严格按照试剂盒说明进行。 1.4 胎盘炎症分级及分期诊断标准
以胎盘组织学绒毛膜羊膜炎(histological chorioamnionitis,HCA)为主,即母体中性粒细胞 浸润到羊膜、绒毛膜及蜕膜。
根据中性粒细胞浸润的数量分为三级代表炎症 程度:1 级:1~9 个/20×;2 级:10~19 个/20×; 3 级:≥ 20 个/20×。
炎症分期:1 期:中性粒细胞浸润较少、散在, 几乎全部局限于绒毛膜间隙;2 期:中性粒细胞浸 润增多,并延伸至绒毛膜组织内绒毛膜板,但未 进入羊膜;3 期:中性粒细胞浸润到羊膜上皮细胞, 分期代表病程进展情况[7]。 1.5 FIRS 诊断标准
(1)新生儿脐带血IL-6 >11 pg/mL;(2)胎 盘病理表现为绒毛膜羊膜炎[8]。根据胎盘病理及 脐带血IL-6 水平,将所有病例分为HCA-FIRS-、 HCA+FIRS- 及HCA+FIRS+ 等3 组。 1.6 早产儿脑损伤影像学检查
所有早产儿生后3 d 内行首次头颅超声检查, 后隔周复查1 次,直至出院。对头颅超声未见异常, 但疑有颅内病变者行头颅MRI 或CT 检查,确诊 是否存在脑损伤。早产儿脑损伤可分为:(1)颅 内出血:包括PVH-IVH、蛛网膜下腔、小脑、基 底核及桥脑等出血;(2)PVL;(3)其它如脑梗 塞等[9]。有上述改变之一者均纳入脑损伤组。 1.7 统计学分析
采用SPSS 16.0 统计软件对数据进行处理,资 料以均数± 标准差(x±s)或率(%)或例数表示, 组间比较采用方差分析或χ2 检验。胎盘炎症分级、 分期与早产儿脑损伤风险的关系采用logistic 回归 分析,P<0.05 为差异有统计学意义。 2 结果 2.1 一般情况
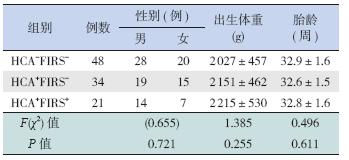
本研究纳入早产儿共103 例,其中男61 例, 女42 例,平均出生体重2 106±476 g,平均胎龄 32.8±1.6 周。HCA 55 例(53.4%),FIRS 21 例(20.4%)。其中HCA-FIRS- 组48 例、HCA+FIRS- 组34 例、HCA+FIRS+ 组21 例。3 组间的性别、出 生体重、胎龄差异无统计学意义(P>0.05),见表 1。
| 表 1 患儿一般临床资料 (x±s) |
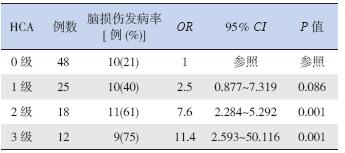
罹患脑损伤的早产儿40 例(38.8%),其中 颅内出血23 例,PVL 15 例,脑梗塞2 例。HCA- FIRS-、HCA+FIRS-、HCA+FIRS+ 组脑损伤发生率 分别为21%(10/48)、41%(14/34)和76%(16/21), 3 组间脑损伤发生率差异有统计学意义(χ2=18.964, P<0.01),其中HCA+FIRS+ 组高于HCA+FIRS- 组 和HCA-FIRS- 组,HCA+FIRS- 组高于HCA-FIRS- 组(P<0.05)。 2.3 早产儿脑损伤与胎盘炎症分级及分期的关系
Logistic 回归分析显示:胎盘炎症2 级和3 级是 早产儿脑损伤的危险因素;胎盘炎症的2 期和3 期 也是早产儿脑损伤的危险因素。见图 1,表 2~3。
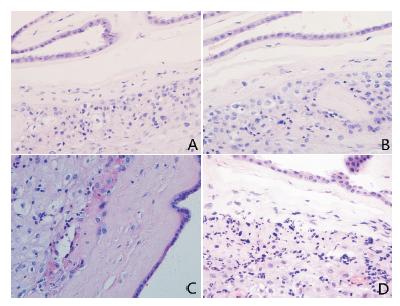 |
图 1 胎盘组织病理切片的炎症分级及分期(苏木精- 伊红染色,× 200) A:HCA+ 0 级、0 期,正常绒毛膜羊膜组 织;B:HCA+1 级、1 期,少量中性粒细胞浸润到绒毛及羊膜下层; C:HCA+2 级、2 期,中等量的中性粒细胞浸润到绒毛及羊膜下层; D:HCA+3 级、3 期,大量中性粒细胞浸润到绒毛及羊膜的基底膜, 有部分羊膜上皮细胞坏死脱落。 |
| 表 2 胎盘炎症分级与早产儿脑损伤风险的分析 |
| 表 3 胎盘炎症分期与早产儿脑损伤风险的分析 |
HCA+FIRS-、HCA+FIRS+ 组脐血细胞因子 IL-8、TNF-α 和G-CSF 水平明显高于HCA-FIRS- 组,且HCA+FIRS+ 组上述细胞因子水平明显高于 HCA+FIRS- 组,差异均有统计学意义(P<0.05), 见表 4。
| 表 4 胎盘炎症及FIRS 与脐血IL-8、G-CSF、TNF-α 含 量的关系 (x±s,pg/mL) |
PROM 是产科常见并发症,也是早产最常见 的原因[10]。约30% 的PROM 妇女被发现羊膜腔 有微生物侵入,至少50% 的PROM 病人在分娩时 有感染的组织学征象[11]。本研究发现,PROM 后 HCA 发生率为53.4%,且这部分早产儿脑损伤发生率较未合并绒毛膜羊膜炎者明显增高,说明母 亲PROM 后合并绒毛膜羊膜炎是早产儿脑损伤的 高危因素。Zanardo 等[4] 报道,孕母罹患绒毛膜羊 膜炎的早产儿脑室内出血发生率可达16.1%,且胎 盘炎症及炎症的3 级及3 期可使脑室内出血的风 险高3.2 倍。本研究发现,胎盘2、3 级炎症及2、 3 期炎症为早产儿脑损伤的危险因素,与文献报道 一致。提示胎盘炎症程度、进展情况与早产儿脑 损伤发病风险密切相关,胎盘炎症分级及分期越 高,脑损伤发病风险越高。当胎盘组织炎症反应 持续进展及炎症反应强度增加时,可导致严重的 羊膜炎及FIRS。目前,宫内感染导致早产儿脑损 伤的具体机制尚不十分清楚,可能与干扰胎盘血 液循环及引起胎儿全身炎症反应有关。研究发现, 发生绒毛膜羊膜炎时,胎盘血流减少,胎儿及新 生儿脑血流明显下降,早产儿脑血管自主调节功 能发育不完善,可引起缺血性脑损伤[12]。Brochu 等[13] 报道,宫内感染后血流动力学障碍可能和大 量前炎症细胞因子释放有关。这些前炎症细胞因 子可通过影响小胶质细胞、少突胶质细胞、星形 细胞和髓鞘形成,诱导其它细胞因子产生细胞损 害、介导一氧化氮的神经毒性和兴奋性氨基酸的 细胞毒性作用等多种途径最终导致脑损伤[14, 15, 16]。
宫内感染可引起FIRS,这种反应受前炎症 细胞因子、单核巨噬细胞产生的小分子糖蛋白调 节。Gomez 等[17] 发现,胎儿脐血IL-6 含量是新生 儿发生严重并发症的独立危险因素,并首次定义 FIRS,以脐血IL-6 > 11 pg/mL 作为FIRS 参考标准, 而绒毛膜羊膜炎是FIRS 的组织病理学标志[18]。本 研究联合胎盘炎症及FIRS 发现,HCA+FIRS- 组和 HCA+FIRS+ 组早产儿脑损伤发病率较HCA-FIRS- 组明显增高,HCA+FIRS+ 组早产儿脑损伤发生率 HCA+FIRS- 组明显增加,进一步说明宫内感染后 FIRS是早产儿脑损伤发生的重要病理生理学基础。 Salas 等[19] 发现,严重的胎儿炎症反应和早产儿神 经发育障碍及死亡有密切联系。
胎儿发生宫内感染时,病原微生物被相应受 体识别,并激活天然免疫系统,诱导一系列炎症级 联反应发生,产生IL-1β、IL-6、IL-8、TNF-α、G-CSF 等大量炎症细胞因子。本研究发现,与HCA-FIRS- 组相比,HCA+FIRS- 组脐血IL-8、TNF-α 及G-CSF 水平明显升高,提示孕母绒毛膜羊膜炎时,母体 免疫系统活化,炎性细胞因子水平增加可预测宫 内感染。与HCA+FIRS- 组相比,HCA+FIRS+ 组脐 血IL-8、TNF-α 及G-CSF 水平明显升高,提示宫 内感染胎盘炎症反应可进一步诱导FIRS,炎性细 胞因子进一步增加。Hecht 等[7] 发现脐血细胞因子 水平与胎儿炎症反应的严重程度呈线性关系,提 示胎儿炎症反应越重,则脐血炎性细胞因子浓度 升高越明显。监测炎性细胞因子水平可预测胎儿 炎症反应程度,但胎儿全身炎症反应后,炎性细 胞因子如何通过血脑屏障,如何引起发育中的大 脑炎症反应,导致脑损伤,确切机制尚不完全清 楚。动物实验发现,羊膜内注入脂多糖(LPS)后 48~96 h,在脑室周围及皮层下白质、室周损伤的 血管等组织中,炎性细胞因子mRNA 表达量明显 增加,脑白质中炎性细胞增加,脑损伤的发生率 及严重程度较对照组明显增加,说明炎性细胞因 子在宫内感染后早产儿脑损伤中起重要介导作用, 测定脐血炎性细胞因子水平可作为早产儿脑损伤 的早期预测方法之一[20]。
综上,本研究结果提示胎盘炎症合并FIRS 与 早产儿脑损伤密切相关,且胎盘炎症程度越重、 进展越快,早产儿脑损伤发病风险越高。脐血中 IL-8、TNF-α 及G-CSF 可能在宫内感染合并FIRS 后早产儿脑损伤发生的过程中起重要的介导作用。 因此,对PROM 的孕产妇行胎盘病理学检查,并 对其炎症程度分级、分期,同时结合脐血IL-8、 TNF-α 及G-CSF 等细胞因子检测,能早期、快速、 准确诊断宫内感染及FIRS 的存在,并为早产儿脑 损伤的早期监测提供依据。
| [1] | 李娟, 王庆红, 吴红敏, 等. 2005 年中国城市产科新生儿出 生状况调查[J]. 中国当代儿科杂志, 2012, 14(1): 7-10. |
| [2] | Vrachnis N, Vitoratos N, Iliodromiti Z, et al. Intrauterine inflammation and preterm delivery[J]. Ann N Y Acad Sci, 2010, 1205(1): 118-122. |
| [3] | Hofer N, Kothari R, Morris N, et al. The fetal inflammatory response syndrome is a risk factor for morbidity in preterm neonates[J]. Am J Obstet Gynecol, 2013, 209(6): 542. |
| [4] | Zanardo V, Vedovato S, Suppiej A, et al. Histological inflammatory responses in the placenta and early neonatal brain injury[J]. Pediatr Dev Pathol, 2008, 11(5): 350-354. |
| [5] | Leviton A, Allred EN, Kuban KCK, et al. Microbiologic and histologic characteristics of the extremely preterm infant's placenta predict white matter damage and later cerebral palsy. the ELGAN study[J]. Pediatr Res, 2010, 67(1): 95-101. |
| [6] | Meyer U, Feldon J, Yee BK. A review of the fetal brain cytokine imbalance hypothesis of schizophrenia[J]. Schizophr Bull, 2009, 35(5): 959-972. |
| [7] | Hecht JL, Fichorova RN, Tang VF, et al. The relationship between neonatal blood protein profiles and placenta histologic characteristics in extremely low gestation age newborns[J]. Pediatr Res, 2011, 69(1): 68-73. |
| [8] | 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第4 版. 北京: 人民卫生出版社, 2011: 39-40. |
| [9] | 刘敬, 杨于嘉, 封志纯.“ 早产儿脑损伤诊断与防治专家共识” 解读[J]. 中国当代儿科杂志, 2012, 14(12): 885-887. |
| [10] | Hansen-Pupp I, Hallin AL, Hellström-Westas L, et al. Inflammation at birth is associated with subnormal development in very preterm infants[J]. Pediatr Res, 2008, 64(2): 183-188. |
| [11] | Magee B, Smith G. Histological chorioamnionitis associated with preterm prelabour rupture of membranes at kingston general hospital: a practice audit[J]. J Obstet Gynaecol Can, 2013, 35(12): 1083-1089. |
| [12] | Fukuda S, Yokoi K, Kitajima K, et al. Influence of premature rupture of membrane on the cerebral blood flow in low-birthweight infant after the delivery[J]. Brain Dev, 2010, 32(8): 631- 635. |
| [13] | Brochu ME, Girard S, Lavoie K, et al. Developmental regulation of the neuroinflammatory responses to LPS and/or hypoxiaischemia between preterm and term neonates: an experimental study[J]. J Neuroinflammation, 2011, 8(8): 55. |
| [14] | Campbell LR, Pang Y, Ojeda NB, et al. Intracerebral lipopolysaccharide induces neuroinflammatory change and augmented brain injury in growth-restricted neonatal rats[J]. Pediatr Res, 2012, 71(6): 645-652. |
| [15] | Khwaja O, Volpe JJ. Pathogenesis of cerebral white matter injury of prematurity[J]. Arch Dis Child Fteal Neonatal Ed, 2008, 93(2): 153-161. |
| [16] | Kaur C, Rathnasamy G, Ling EA. Roles of activated microglia in hypoxia induced neuroinfammation in the developing brain and the retina[J]. J Neuroimmune Pharmacol, 2013, 8(1): 66-78. |
| [17] | Gomez R, Romero R, Ghezzi F, et al. The fetal inflammatory response syndrome[J]. Am J Obstet Gynecol, 1998, 179(1): 194- 202. |
| [18] | Pacora P, Chaiworapongsa T, Maymon E, et al. Funisitis and chorionic vasculitis: the histological counterpart of the fetal inflammatory response syndrome[J]. J Matern Fetal Neonatal Med, 2002, 11(1): 18-25. |
| [19] | Salas AA, Faye-Petersen OM, Sims B, et al. Histological characteristics of the fetal inflammatory response associated with neurodevelopmental impairment and death in extremely preterm infants[J]. J Pediatr, 2013, 163(3): 652-657. |
| [20] | Polglase GR, Nitsos I, Baburamani AA, et al. Inflammation in utero exacerbates ventilation-induced brain injury in preterm lambs[J]. J Appl Physiol, 2012, 112(3): 481-489. |
 2015, Vol. 17
2015, Vol. 17