原发性肾病综合征(primary nephrotic syndrome,PNS)是儿童最常见的肾小球疾病之一, 微小病变(minimal change disease,MCD) 是PNS 最常见的病理类型,约占PNS 的15%~25%[1, 2, 3]。 MCD 的病理改变特点:在光学显微镜下基本正常, 电镜下肾小球脏层上皮细胞足突广泛融合[4]。大部 分MCD 患儿对糖皮质激素治疗反应良好,少部分 (12%~30%)患儿对激素抵抗、频繁复发,导致 病情迁延不愈[4]。为什么有着同样临床诊断、病理 类型相同的患儿会有着不同的临床转归?
目前关于IgM 肾病的文献报道较多,研究得 较为深入。有人在临床工作中发现,部分MCD 型 PNS 患儿肾小球系膜区有微量IgM(IgM 荧光染色 强度为“+” 或“+/-”)沉积,但没有达到IgM 肾病的诊断标准[1, 5, 6, 7],这部分患儿的临床特点、 对糖皮质激素治疗的反应与无免疫复合物沉积的 MCD 型PNS 患儿是否有差别?本研究假设微量 IgM 在肾脏的沉积可能会影响MCD 型PNS 患儿的 临床转归。因此本研究以肾组织微量IgM 沉积的 MCD 型PNS 患儿为研究对象,以无免疫球蛋白沉 积的MCD 型PNS 患儿为对照组,探讨患儿的临床 特点及肾组织微量IgM 沉积对糖皮质激素、免疫 抑制剂治疗的反应,以指导临床实践。 1 资料与方法 1.1 研究对象及分组
临床诊断为PNS(2009 年4 月以前的病例按 照文献[8] 的诊断标准,以下称旧指南;2009 年4 月以后的病例按照文献[9] 的诊断标准,以下称新 指南)、病理诊断为MCD[10]、病例资料完整并满 足下列条件者入选该研究:(1)年龄6 个月至 14 岁;(2)2005 年6 月至2012 年6 月在湖南省 儿童医院肾内科住院;(3)随访时间≥ 1 年; (4)排除IgM 肾病以及其他除微量IgM 沉积外还 有其他免疫复合物沉积。微量IgM 沉积是指IgM 免疫荧光染色强度为“+”或“+/-”,即低倍镜 下隐约可见,高倍镜下可见[11, 12];(5)排除紫癜 性肾炎、狼疮性肾炎及肝炎相关性肾炎等继发性 肾病综合征;(6)排除先天性肾脏疾病。
符合入选标准的患儿共187 例,其中男141 例, 女46 例,年龄1~14 岁,平均4.3±1.3 岁。根据 免疫病理结果将患儿分为两组:对照组和研究组。 对照组为免疫荧光染色阴性患儿,研究组为免疫 荧光染色微量IgM 沉积患儿。对照组106 例,其 中男85 例,女21 例,年龄4.3±1.4 岁;研究组 81 例,其中男56 例,女25 例,年龄 4.3±2.1 岁。 两组患儿年龄、性别构成比差异无统计学意义 (P>0.05)。对照组病程中位数为24(P25~P75: 17~36)个月,研究组为29(P25~P75:18~37)个 月,两组比较差异无统计学意义(U=1085.50, P>0.05)。 1.2 糖皮质激素治疗及疗效判定
所有病例病初均口服足量泼尼松治疗 [2 mg/(kg · d)],晨起顿服,最大剂量≤ 60 mg/d, 4~8 周后逐渐减量。糖皮质激素敏感病例泼尼松减 量方案如下:先分次口服,尿蛋白转阴后改为每 晨顿服,疗程6 周,如尿蛋白持续阴性,然后每 2~4 周减量2.5~5 mg 维持;至0.5~1 mg/kg 时维持 3 个月,以后每2 周减量2.5~5 mg 直至停药。而 对于糖皮质激素耐药的病例,4 周末泼尼松逐渐减 量并联用免疫抑制剂,泼尼松每2 周减5 mg,至 0.5~1 mg/kg 时维持3 个月,改为隔日顿服,以后 每2~4 周减量2.5~5 mg 直至停药。
糖皮质激素敏感及耐药的判定:2009 年4 月 以前诊断的病例按照旧指南[8];2009 年4 月以后 诊断的病例按照新指南[9]。半年内复发≥ 2 次,或 1 年内复发≥ 3 次为频复发;单次复发是指在治疗 和随访中,仅复发一次;多次复发指在治疗和随 访的病程中,复发多次,但没有达到频复发标准。 1.3 免疫抑制剂治疗及疗效判定
糖皮质激素耐药或频复发的病例联用吗替麦 考酚酯(MMF)治疗,剂量为20~30 mg/(kg · d), 分两次口服,总疗程为3~24 个月,最大剂量不超 过1 g。对MMF 耐药者改用环孢素A(CsA), CsA 的起始剂量3~5 mg/(kg · d),分两次空腹口服, 维持血药谷浓度80~150 μg/L,疗程为6~12 个月。 他克莫司剂量0.10~0.15 mg/(kg · d),分两次口服, 维持血药谷浓度5~10 μg/L,总疗程为6~24 个月。 口服MMF、CsA 或他克莫司3 个月内尿蛋白转阴, 判为敏感;3 个月内蛋白尿未转阴判为耐药。 1.4 统计学分析
采用SPSS 18.0 统计软件进行统计学分析。正 态分布的计量资料以均数± 标准差(x±s)表示,两组间比较采用成组t 检验;偏态分布计量资料以 中位数和四分位距 [P50(P25~P75)] 描述,组间比 较采用非参数检验(Mann-Whitney U检验);两 组间率的比较采用χ2 检验或Fisher 精确概率法。 P<0.05 为差异有统计学意义。 2 结果 2.1 研究组和对照组临床特征的比较
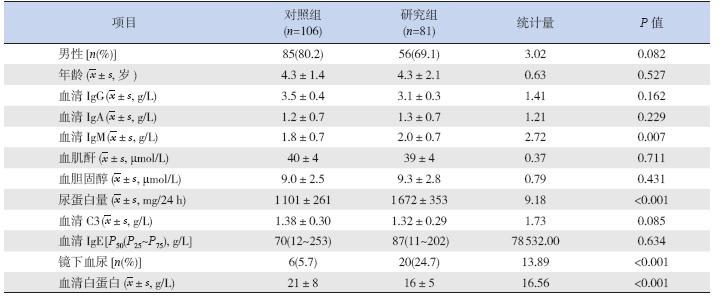
研究组和对照组患儿入院时血胆固醇、血肌 酐、血清IgG、IgA、IgE、补体C3 水平两组间比 较差异无统计学意义(表 1)。研究组患儿血清 IgM 水平和24 h 尿蛋白量显著高于对照组,而血 清白蛋白水平显著低于对照组(表 1)。研究组镜 下血尿发生率显著高于对照组(表 1)。研究组1 例患儿发生高血压,对照组无高血压病例。对照组、 研究组伴急性肾损伤的病例分别为2 例和1 例。
| 表 1 研究组和对照组患儿临床资料的比较 |
187 例患儿中,共35 例(18.7%)患儿对糖 皮质激素耐药,其中研究组、对照组糖皮质激素 耐药发生率分别为27.2%(22 例)、12.3%(13 例), 两组比较差异有统计学意义(χ2=5.124,P<0.05)。 两组患儿在随访期间内,研究组单次复发率和多次 复发率与对照组比较差异无统计学意义(P>0.05), 而频复发率显著高于对照组(P<0.05)(表 2)。
| 表 2 研究组和对照组患儿对激素治疗反应的比较 [n(%)] |
将糖皮质激素耐药的病例联用MMF 治疗,其 中研究组19 例,对照组13 例。研究组和对照组完 全缓解率分别为68%(13/19)、62%(8/13),两 组比较差异无统计学意义(χ2=0.034,P>0.05)。 对MMF 耐药的病例停用MMF 改用其他免疫抑制 剂继续治疗,其中研究组6 例、对照组4 例联用 环孢素A 治疗,研究组、对照组完全缓解率分别 为67%(3/4)、75%(4/6),两组比较差异无统 计学意义(P>0.05)。另外,对照组对MMF 耐药 病例中,其中1 例联用他克莫司治疗后完全缓解。
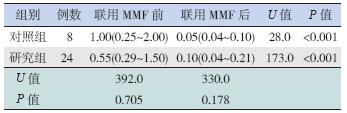
将研究组、对照组频复发病例联用MMF 治疗, 研究组27 例,对照组11 例。由于依从性差而自行 停服MMF 治疗的研究组3 例、对照组2 例而未被 纳入,此外,对照组中1 例联用环孢素A 治疗的 病例也未被纳入。随访观察发现,联用MMF 治疗 前或后研究组与对照组每月复发次数比较差异均 无统计学意义(P>0.05);两组联用MMF 治疗后 平均每月复发次数较治疗前均显著降低(P<0.05) (表 3)。
| 表 3 研究组和对照组频复发患儿联用MMF 治疗前后复 发频率的比较 [P50(P25~P75),次/ 月] |
于2013 年6 月30 日结束随访,随访时间为 1~8 年。随访期间两组均无病例因慢性肾功能衰竭 而死亡;研究组1 例、对照组2 例患儿死于重度 感染;两组患儿的肾功能均在正常范围内。研究组、 对照组中分别有90.1%(73/81)和97.2%(103/106) 的病例达到完全缓解,两组之间完全缓解率的比 较差异无统计学意义(χ2=2.943,P>0.05)。研究 组和对照组分别有40 例(49.4%)和83 例(78.3%) 患儿已完全停止糖皮质激素治疗,卡方检验显示, 研究组完全停止糖皮质激素治疗比例低于对照组 (χ2=17.058,P<0.05)。 3 讨论
在既往的研究中,肾小球系膜区IgM 沉积在 MCD 中的作用是充满争议的,有研究认为IgM 沉 积对糖皮质激素、免疫抑制剂的治疗反应无明显 影响[13],而有的研究则认为治疗反应差[14]。而且 目前对系膜区IgM 沉积荧光染色强度为≥“2+” 的研究较多,但是对于肾小球系膜区微量IgM 沉 积,但没有达到IgM 肾病的诊断标准的这部分病 例的临床特点、对糖皮质激素及免疫抑制剂的反 应的研究较少。本研究为了排除其他免疫复合物 在肾脏沉积而影响微量IgM 沉积与临床关系的研 究结果,因此,选择研究病例均为微小病变,且 经肾病理检查确定为系膜区仅为微量IgM 沉积者 才纳入本次研究中。本研究收集了2009 年4 月前 后的病例,即新指南出台前后的病例,通过统计 分析发现2009 年4 月前与2009 年4 月后病例数 构成比的比较无显著差异,排除了因选用不同标 准后对结果造成的偏倚。本研究通过回顾性分析 187 例MCD 型PNS 患儿的临床及随访资料,发现 18.7% 的患儿对糖皮质激素耐药,与国内外其他的 研究结果基本一致[15, 16]。进一步分析微量IgM 沉 积与无微量IgM 沉积对糖皮质激素治疗反应有何 区别,本研究结果显示肾组织中微量IgM 沉积的 MCD 型PNS 患儿糖皮质激素耐药率显著高于对照 组。Zeis 等[17] 在对352 例肾病综合征患儿的研究中, 其中121 例诊断为糖皮质激素依赖或耐药并进行 了肾活检,其中20 例系膜区主要以IgM 沉积为主, 并诊断为微小病变肾病综合征,IgM 沉积组糖皮质 激素耐药的发生率约为30%。虽然该研究结果与 本研究一致,但是该研究并没有排除其余免疫复 合物在肾脏的沉积,如IgA、C3、IgG 等,这些免 疫复合物在目前的研究中表明同样会影响疾病对 糖皮质激素的治疗反应,甚至某些免疫复合物发 生共同作用,加重临床表现[12]。
本研究还分析了两组病例的单次复发率、多 次复发率及频复发率,发现两组病例间单次复发 率及多次复发率的比较并无显著差异,但IgM 沉 积组频复发率显著高于对照组;且在1~8 年的随 访中还发现,IgM 沉积组完全停止了糖皮质激素 治疗的比例低于对照组。近期Swartz 等[13] 在对55 例糖皮质激素依赖或耐药的微小病变肾病综合征 的病例研究发现,23 例(41.8%)患儿系膜区有 IgM 免疫沉积,并表明IgM 的沉积可能是重症微小 病变肾病综合征的一个标志物。在Arias 等[18] 的 研究中同样证明了这一点。因此,本研究提示微 量IgM 在MCD 型PNS 患儿的糖皮质激素治疗中起 着不可忽视的作用,有可能是影响MCD 型PNS 患 儿预后的重要因素之一。
本研究随访观察微量IgM 沉积组和对照组联 用MMF 治疗的糖皮质激素耐药病例,发现两组病 例的完全缓解率均在60% 以上,且两组之间的缓 解率无显著差异。微量IgM 沉积组和对照组频复 发病例联用MMF 治疗后,复发频率较联用前均明 显降低。以上结果表明了系膜区微量IgM 沉积对 免疫抑制剂的治疗影响不大。MMF 是一种免疫抑 制药,是霉酚酸酯类的衍生物。Li 等[19] 对24 例小于2 岁儿童糖皮质激素耐药肾病综合征中联用 MMF 治疗,发现高达62.5% 的病例完全缓解,而 且其不良反应比较轻,仅3 例患儿有轻度的外周 白细胞轻微下降。
本研究还发现,微量IgM 沉积组血清IgG、 IgA、IgE、补体C3 等水平与对照组比较无明显差 异,但血清IgM 水平显著高于对照组,这可能与 系膜区IgM 沉积有关。有研究报道,血清中IgM 通过系膜细胞间隙时,系膜区T 淋巴细胞功能出 现异常或者其免疫复合物的清除能力下降可导致 IgM 的沉积,进而活化系膜细胞和导致细胞增殖, 从而导致肾脏组织的病理改变[14]。本研究还显示, 微量IgM 沉积组患儿的24 h 尿蛋白量明显高于对 照组,血尿的发生率也明显高于对照组,而血清 白蛋白水平明显低于对照组,提示系膜区的微量 IgM 沉积在肾脏病理中起重要的作用。
综上所述,肾脏微量IgM 沉积的MCD 型PNS 患儿的糖皮质激素耐药及频复发率较高,可能是 影响MCD 型PNS 患儿预后的重要因素之一,但联 用MMF 可能是较好的治疗方案。
| [1] | 党西强, 易著文, 何小解, 等. 1316 例小儿肾脏病临床与病 理分布特点[J]. 中国当代儿科杂志, 2007, 9(2): 117-121. |
| [2] | 曾华松, 高岩, 徐家喻, 等. 小儿肾病综合征肾脏病理与脂 质紊乱的关系[J]. 中国当代儿科杂志, 2001, 3(2): 151-153. |
| [3] | 马祖祥, 易著文, 赵维玲, 等. 原发性肾病综合征患儿肾组 织中p18 的表达及意义( 英文)[J]. 中国当代儿科杂志, 2004, 6(5): 373-377. |
| [4] | Report of the International Study of Kidney Disease in Children. Minimal change nephrotic syndrome in children: deaths during the first 5 to 15 years' observation[J]. Pediatrics, 1984, 73(4): 497-501. |
| [5] | 朱碧溱, 丁洁. IgM 肾病[J]. 临床儿科杂志, 2012, 30(4): 389-392. |
| [6] | 郑莉萍, 王华, 张建江, 等. 34 例儿童IgM 肾病临床与病理 分析[J]. 中国当代儿科杂志, 2010, 12(5): 338-340. |
| [7] | 李先法, 朱彩凤, 朱斌, 等. 原发性局灶节段性肾小球硬化 伴IgM 沉积患者的临床特征及预后分析[J]. 中华肾脏病杂志, 2013, 29(10): 737-742. |
| [8] | 中华医学会儿科学分会肾脏病学组. 小儿肾小球疾病的临床 分类、诊断及治疗[J]. 中华儿科杂志, 2001, 39(12): 746-749. |
| [9] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治 循证指南( 一): 激素敏感、复发/依赖肾病综合征诊治循证 指南( 试行)[J]. 中华儿科杂志, 2009, 47(3): 167-170. |
| [10] | Saha TC, Singh H. Minimal change disease: a review[J]. South Med J, 2006, 99(11): 1264-1270. |
| [11] | Welch TR, McAdams J. Immunoglobulin M and C1q mesangial labeling in IgA nephropathy[J]. Am J Kidney Dis, 1998, 32(4): 589-592. |
| [12] | Kanemoto K, Ito H, Anzai M, et al. Clinical significance of IgM and C1q deposition in the mesangium in pediatric idiopathic nephrotic syndrome[J]. J Nephrol, 2013, 26(2): 306-314. |
| [13] | Swartz SJ, Eldin KW, Hicks MJ, et al. Minimal change disease with IgM+ immunofluorescence: a subtype of nephrotic syndrome[J]. Pediatr Nephrol, 2009, 24(6): 1187-1192. |
| [14] | Maruyama M, Toyoda M, Umezono T, et al. Clinical significance of IgM deposition in the mesangium and mesangial hypercellularity in adult minimal change nephrotic syndrome[J]. Nihon Jinzo Gakkai Shi, 2006, 48(1): 14-21. |
| [15] | 任献国, 刘光陵, 夏正坤, 等. 儿童微小病变性肾病综合征 临床分析[J]. 中国全科医学, 2011, 14(26): 3025-3027. |
| [16] | Banaszak B, Banaszak P. The increasing incidence of initial steroid resistance in childhood nephrotic syndrome[J]. Pediatr Nephrol, 2012, 27(6): 927-932. |
| [17] | Zeis PM, Kavazarakis E, Nakopoulou L, et al. Glomerulopathy with mesangial IgM deposits: long-term follow up of 64 children[J]. Pediatr Int, 2001, 43(3): 287-292. |
| [18] | Arias LF, Prada MC, Vélez-Echeverri C, et al. IgM nephropathy in children: clinicopathologic analysis[J]. Nefrologia, 2013, 33(4): 532-538. |
| [19] | Li Z, Duan C, He J, et al. Cyclopentolate mofetil therapy for children with steroid-resistant nephrotic syndrome[J]. Pediatr Nephrol, 2010, 25(5): 883-888. |
 2015, Vol. 17
2015, Vol. 17