2. 天津市儿童医院肾内科, 天津 300074
原发性肾病综合征(PNS)是儿童时期最常见 的肾小球疾病,其在儿童中的患病率约为10 万分 之16 [1]。肾上腺糖皮质激素是目前公认治疗PNS 的主要药物,根据正规足量激素治疗4 周反应, 将PNS 分为激素敏感型肾病综合征(SSNS)和激 素耐药型肾病综合征(SRNS)[2]。大部分患儿对 激素治疗表现为敏感,但仍有部分患儿复发,其 中有45%~50% 的病人为频复发或激素依赖[3];约 20% 的患儿表现为激素耐药,其中约60%SRNS 患 儿发展为局灶性节段性肾小球硬化(FSGS),而 FSGS 患儿会逐渐演变为终末期肾病[4]。SRNS 和 SSNS 在激素治疗前有相似的临床表现,没有特异 的实验室或者临床指标可以用来区分这两种分型, 肾活检虽对了解肾脏病理改变、预测激素反应性及 评估预后具有重要意义,但因其有创性,难以在儿 科临床工作中普及。近年来,国内外蛋白质组学 研究鉴定出多种SRNS 与SSNS 的差异性表达蛋白 质,如α1 抗胰蛋白酶(AAT)、转铁蛋白、结合 珠蛋白(HP)、细胞角蛋白9 等,提示这些差异 表达的蛋白质可能为预测SRNS 的生物标志物[5]。 HP 和AAT 都属于急性期反应蛋白,在PNS 患儿 的病理生理过程中,HP 和AAT 可能会出现反应性 增高,本研究拟选取HP 和AAT 为研究指标,通 过检测血、尿中的HP、AAT 水平预测PNS 患儿对 激素治疗的反应。 1 资料与方法 1.1 研究对象
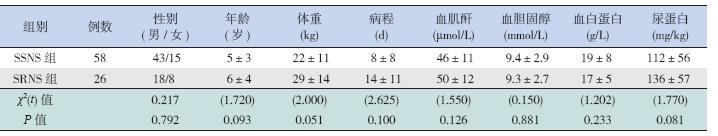
选取2012 年9 月至2014 年1 月于本院诊断 并治疗的84 例PNS 患儿为研究对象,所有患儿均 为初发的PNS 患儿或停用糖皮质激素6 个月以上 的复发PNS 患儿,且临床诊断均符合2009 年中华 医学会儿科学分会肾脏病学组制订的《儿童常见 肾脏疾病诊治循证指南》标准[6];排除观察期间出 现严重感染、不能坚持正规激素治疗、使用过免 疫抑制剂及出现肾功能下降的患儿。经足量激素 治疗4 周后根据激素治疗反应将84 例PNS 患儿分 为SRNS 组(尿蛋白仍阳性)和SSNS 组(尿蛋白 转阴)。SSNS 组58 例,其中男43 例,女15 例, 年龄0.4~14 岁,平均年龄5±3 岁;SRNS 组26 例, 其中男18 例,女8 例,年龄1~13 岁,平均年龄 6±4 岁。另选取同期于本院体检中心体检的健康 儿童40 例为对照组,其中男29 例,女11 例,年 龄0.2~13 岁,平均年龄5±4 岁。本研究经医院伦 理委员会批准,受试者家属均知情同意。 1.2 标本收集与检测
所有患儿均于应用激素治疗前、治疗1 周及 4 周分别留取血、尿标本。采集PNS 患儿空腹静 脉血2 mL,静置60 min,3 000 rpm 离心5 min 分 离血清;在取血的同一日,留取新鲜晨起清洁中 段尿20 mL,4℃下以3 000 rpm 离心20 min,收集 上清液,血清及尿液均放置在-80℃超低温冰箱中 备用。因单次尿排泄量受到肾功能、尿量和尿液 浓缩情况等多种因素影响,故本研究采用尿肌酐 (Cr)排出量来校正单次尿HP、AAT 水平。收集 所有患儿的年龄、性别、体重、入院时病程等临 床指标;以及激素使用前的血胆固醇、血肌酐、 白蛋白、24 h 尿蛋白定量等生化指标。采用酶联 免疫吸附试验(enzyme-linked immuno sorbent assay, ELISA)测定血清、尿液中HP 和AAT 的浓度, ELISA 试剂盒由上海恒远生物科技有限公司提供。 1.3 统计学分析
采用SPSS 19.0 统计软件包对数据进行统计学 分析,正态分布计量资料采用均数± 标准差(x±s) 表示,两组间比较采用独立样本t 检验;非正态分 布计量资料使用中位数(四分位间距)[P50(P25,P75)] 表示,两组间比较采用Mann-Whitney U 检验, 多组间比较采用 Kruskal-Wallis H检验,组间两 两比较采用 Nemenyi 秩和检验。计数资料采用例 数表示,两组间比较采用χ2 检验。采用受试者工 作特征曲线(receiver operating characteristic curve, ROC 曲线)评价HP 和AAT 对激素治疗PNS 疗效 的预测价值。P<0.05 为差异有统计学意义。 2 结果 2.1 PNS 患儿治疗前临床及生化指标分析
SSNS、SRNS 组患儿年龄、性别、体重以 及在入院时病程、血胆固醇、血肌酐、血白蛋 白、尿蛋白量之间比较差异均无统计学意义(均 P>0.05),见表 1。
| 表 1 SSNS 与SRNS 患儿治疗前临床及生化指标比较 [例或(x±s)] |
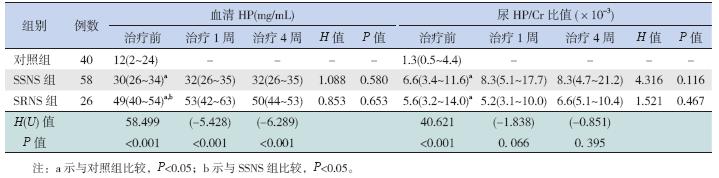
SSNS 组与SRNS 组治疗前血清HP 水平均显 著高于对照组(P<0.05);SRNS 组血清HP 水平 在治疗前、治疗1 周及治疗4 周时均较SSNS 组显 著升高,差异有统计学意义(P<0.05);但治疗前、 治疗1 周及治疗4 周时血清HP 水平分别在SSNS 及SRNS 组内比较差异均无统计学意义(P>0.05)。 见表 2。
| 表 2 各组不同时间血清HP 水平及尿HP/Cr 比值的比较 [P50(P25,P75)] |
SSNS 组及SRNS 组治疗前尿HP/Cr 比值均高 于对照组(P<0.05);但在治疗前、治疗1 周及治 疗4 周时尿HP/Cr 比值在SSNS 及SRNS 组间比较 差异均无统计学意义(P>0.05);且治疗前、治 疗1 周及治疗4 周时尿HP/Cr 比值分别在SSNS 及 SRNS 组内比较差异亦均无统计学意义(P>0.05)。 见表 2。 2.4 各组不同时间血清AAT 浓度比较
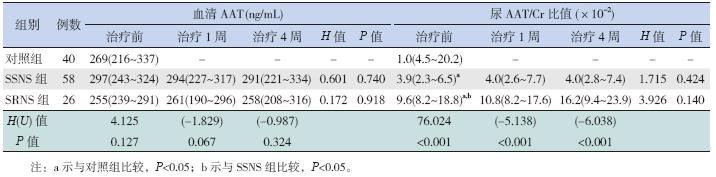
治疗前血清AAT 水平在对照组、SRNS 组和 SSNS 组比较差异无统计学意义(P>0.05);在治 疗前、治疗1 周及治疗4 周时血清AAT 水平分别 在SRNS 和SSNS 组间及组内比较差异均无统计学 意义(P>0.05)。见表 3。
| 表 3 各组不同时间血清AAT 水平及尿AAT/Cr 比值的比较 [P50(P25,P75)] |
SSNS 组与SRNS 组治疗前尿AAT/Cr 比值均 显著高于对照组(P<0.05);SRNS 组尿AAT/Cr 比值在治疗前、治疗1 周及治疗4 周时均较SSNS 组显著升高(P<0.05);但治疗前、治疗1 周及治 疗4 周时尿AAT/Cr 比值分别在SSNS 及SRNS 组 内比较差异均无统计学意义(P>0.05)。见表 3。 2.6 血清HP 及尿AAT/Cr 比值的诊断价值
以SSNS 及SRNS 组血清HP 浓度做ROC 曲线 分析,结果显示曲线下面积(AUC)为0.904,当 血清HP 截点值为37.935 mg/mL 时,预测激素治疗 儿童PNS 疗效的效能最高,其敏感度为92.3%, 特异度为86.2%,Youden 指数为78.5%(图 1); 以两组尿AAT/Cr 比值做ROC 曲线分析,结果显 示AUC 为0.899,当尿AAT/Cr 截点值为0.0696 时,预测效能最高,其敏感度为100%,特异度为 79.3%,Youden 指数79.3%( 图 1)。以血清HP 浓度联合尿AAT/Cr 比值作ROC 曲线分析,结果 显示AUC 为0.971,敏感度为92.3%,特异度为 96.6%,Youden 指数88.9%,具有更好的预测效能 (图 2)。
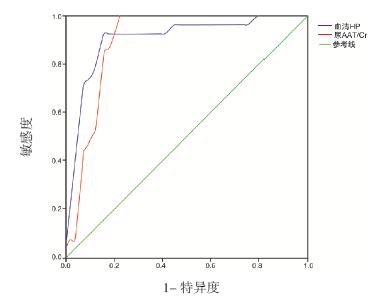 |
图 1 血清HP 水平及尿AAT/Cr 比值预测激素治疗效果的ROC 曲线分析 |
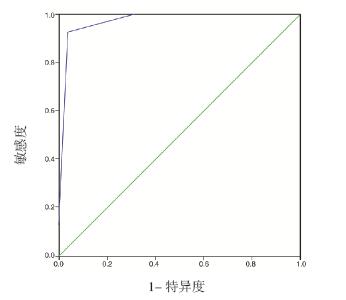 |
图 2 血清HP 水平联合尿AAT/Cr 比值预测激素治疗效果的ROC 曲线分析 |
SRNS 患儿持续存在的尿蛋白,不仅使体内蛋 白质丢失;同时大量蛋白尿还作为一种独立的致 病因素,能诱导肾小管间质纤维化,加重肾脏病变。 迄今,尚缺乏早期诊断SRNS 的特异性生物标志物。 近年来,国内外蛋白质组学研究鉴定出多种SRNS 与SSNS 的差异性表达的蛋白质,如AAT、转铁蛋 白、HP、细胞角蛋白9 等[5]。本研究选取HP 和 AAT 为研究对象,探讨其能否成为早期诊断SRNS 的生物标志物。本研究标本分别是取自于激素治 疗前以及激素治疗1 周、4 周,这样既可以避免药 物治疗干扰,又可以动态监测生物标志物与激素 治疗反应的关系。本研究提示血清HP 浓度和尿 AAT/Cr 比值在SRNS 组明显升高,同时应用ROC 曲线分析来评价其诊断SRNS 的效能。
HP 又称触珠蛋白,在炎症刺激如感染、自身 免疫反应等时,血清中HP 水平会升高[7]。HP 主 要由肝脏合成,在脂肪组织、皮肤、肺、肾脏也 有低度表达。HP 在参与宿主抗感染及损伤组织的 修复中起着重要的作用,还对淋巴细胞功能有抑 制作用,能调节Th1/Th2 平衡[8]。HP 表达的改变 很可能是局部炎症后急性相蛋白的反应性变化以 及免疫作用。免疫失衡,比如T 细胞功能紊乱, 2 型细胞因子上调,都可以导致微小病变型肾病综 合征和局灶节段性肾小球硬化,而免疫失衡就可 以引起血清HP 升高。据报道,在肾小球疾病如肾 小球肾炎、膜性肾病、IgA 肾病中,血清HP 水平 明显升高[9]。推测免疫因素导致SRNS 和SSNS 不 同的病理生理过程,SRNS 较SSNS 患儿血清HP 明显升高。在本研究中PNS 患者尿HP 水平比对 照组明显升高,但是在SRNS 和SSNS 之间没有发 现差异,有研究表明糖尿病肾病患者早期肾功能 下降时尿中HP 增加,考虑与肾小球通透性增加, 使血清中的HP 漏入尿液以及肾小管损伤有关[10], 本研究所有研究对象肾功能均正常,考虑在肾功 能正常时SSNS 和SRNS 具有相似的尿HP 排泄[9], 因此,仅血清HP 升高提示PNS 患儿激素耐药可能, 而尿HP 不适用于做预测SRNS 的生物标志物,且 当血清HP 高于37.935 mg/mL 时,提示可能激素 耐药(AUC 为0.904,敏感度为92.3%,特异度为 86.2%)。
AAT 亦是一种急性时相炎症反应蛋白,是人 类血浆中最丰富的蛋白酶抑制剂,主要由肝细胞 分泌,肝外组织如肠、肾、脾等也能产生少量的 AAT [11]。Hidvegi 等[12] 发现在细胞内反应途径中, z 变异的AAT 能够活化NF-κB,NF-κB 广泛存在于 人体各种组织细胞中,包括免疫细胞、肾小球系 膜细胞及肾小管上皮细胞等,许多诱导剂能使培 养的肾细胞中NF-κB 激活,调节多种促炎因子的 转录。本研究中发现肾病综合征患者尿AAT/Cr 比 值明显升高,SRNS 患者升高尤为显著,目前原因 尚不明确。文献报道血清和尿的蛋白组学分析表 明蛋白水解活性增加,发现大量的白蛋白和AAT 片段,考虑在对于非特异性刺激物应答过程中, 由血多形性有核白细胞引起的氧化应激,并激发 足细胞结构改变[13]。也有研究表明AAT 通过发挥 其抑制中性粒细胞抗炎、抗凋亡作用,在肾小管 损伤后,肾小管上皮细胞反应性的表达AAT[14], Carlson 等[15] 和Liew[16] 均报道用免疫组化方法在 肾小管上皮细胞检测到AAT。国内的研究从蛋白 质和mRNA 水平证实了肾小管上皮细胞可表达 AAT,肾小管上皮细胞表达AAT 的意义是否与肾 病综合征激素耐药相关仍为研究热点问题[17]。本 研究提示尿AAT/Cr 比值可能成为预测SRNS 的生 物标志物,当尿AAT/Cr 比值大于0.0696 时,提示 可能激素耐药(AUC 为0.899,敏感度为100%, 特异度为79.3%),本研究血清AAT 的浓度在三 组之间没有差异,推测大量蛋白尿等损伤因素引 起足细胞改变以及肾小管损伤,氧化应激反应主 要发生在肾小管及肾小球,而不是血液系统,故 血清中AAT 无明显升高。
总之,血清HP 浓度及尿AAT/Cr 比值升高在 PNS 患儿发病初期提示可能激素耐药,其可用来 预测激素的疗效。推测血清HP 浓度及尿AAT/Cr 比值升高与免疫因素及肾小球、肾小管损伤有关。 SRNS 血清和尿液中的生物标志物,可能为SRNS 患儿耐药机制在蛋白质水平的反应产物,联合检 测上述两种生物标志物预测效能更佳(AUC 为 0.971,敏感度为92.3%,特异度为96.6%),但上 述研究成果有待进行大规模、多中心队列研究, 从分子机制进一步证明血清HP 和尿AAT/Cr 比值 作为激素耐药的生物学标志物的可行性。
| [1] | MacHardy N, Miles PV, Massengill SF, et al. Management patterns of childhood-onset nephrotic syndrome[J]. Pediatr Nephrol, 2009, 24(11): 2193-2201. |
| [2] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治 循证指南(试行)(三):激素耐药型肾病综合征诊治指南[J]. 中华儿科杂志, 2010, 48(1): 72-75. |
| [3] | 夏华, 何庆南, 李晓燕, 等. 中性粒细胞明胶酶相关脂质转 运蛋白在儿童原发性肾病综合征尿液中的表达及意义[J]. 中 国当代儿科杂志, 2013, 15(7): 541-545. |
| [4] | Cochat P, Fargue S, Mestrallet G, et al. Disease recurrence in paediatric renal transplantation[J]. Pediatr Nephrol, 2009, 24(11): 2097-2108. |
| [5] | 王荧荧. 预测儿童原发性肾病综合征激素疗效的尿液标志物 研究[D]. 南京医科大学学位论文, 2012. |
| [6] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治 循证指南(一):激素敏感、复发/依赖肾病综合征诊治循 证指南(试行)[J]. 中华儿科杂志, 2009, 47(3): 167-170. |
| [7] | Strandhave C, Krarup H, Christensen JH, et al. Haptoglobin genotype and risk markers of cardiovascular disease in patients with chronic kidney disease[J]. Int J Nephrol, 2013, 2013: 650847. |
| [8] | 郑能慆, 吴卫平. 多发性硬化的血清蛋白质组学研究[J]. 中 国神经精神疾病杂志, 2011, 37(1): 46-48. |
| [9] | Wen Q, Huang LT, Luo N, et al. Proteomic profiling identifies haptoglobin as a potential serum biomarker for steroid-resistant nephrotic syndrome[J]. Am J Nephrol, 2012, 36(2): 105-113. |
| [10] | Bhensdadia NM, Hunt KJ, Lopes-Virella MF, et al. Urine haptoglobin levels predict early renal functional decline in patients with type 2 diabetes[J]. Kidney Int, 2013, 83(6): 1136-1143. |
| [11] | Magistroni R, Ligabue G, Lupo V, et al. Proteomic analysis of urine from proteinuric patients shows a proteolitic activity directed against albumin[J]. Nephrol Dial Transplant, 2009, 24(5): 1672-1681. |
| [12] | Hidvegi T, Schmidt BZ, Hale P, et al. Accumulation of mutant alpha1-antitrypsin Z in the endoplasmic reticulum activates caspases-4 and -12, NF kappaB, and BAP31 but not the unfolded protein response[J]. J Biol Chem, 2005, 280(47): 39002-39015. |
| [13] | Candiano G, Musante L, Petretto A, et al. Proteomics of plasma and urine in primary nephrotic syndrome in children[J]. Contrib Nephrol, 2008, 160: 17-28. |
| [14] | Graterol F, Navarro-Muñoz M, Ibernon M, et al. Poor histological lesions in IgA nephropathy may be reflected in blood and urine peptide profiling[J]. BMC Nephrol, 2013, 14(1): 82. |
| [15] | Carlson JA, Rogers BB, Sifers RN, et al. Multiple tissues express alpha 1-antitrypsin in transgenic mice and man[J]. J Clin Inves, 1988, 82(1): 26. |
| [16] | Liew CT. Alpha-1-antitrypsin in the renal tubular epithelium in patientswith orwithoutalpha-1-antitrypsin deficiency[J]. Changgeng Yi Xue Za Zhi, 1990, 13(1): 1-9. |
| [17] | 唐功耀, 谌贻璞, 张媺, 等. 人肾脏近曲小管上皮细胞表 达α1 抗胰蛋白酶的研究[J]. 中华医学杂志, 2006, 86(22): 1540-1544. |
 2015, Vol. 17
2015, Vol. 17