2. 广州市第一人民医院儿科, 广东 广州 510180
儿童原发性肾病综合征(primary nephrotic syndrome,PNS)是一种常见的儿科肾脏疾病,是 由于多种病因造成肾小球基底膜通透性增高,大 量蛋白从尿中丢失的临床综合征,发病机制至今 仍未阐明,环境、遗传、治疗等因素可影响其病 变的进展和预后。近年来研究发现,肾素- 血管 紧张素系统(renin-angiotensin system,RAS)在肾 脏疾病的发生发展中发挥重要作用[1, 2],血管紧张 素- Ⅱ(angiotensin Ⅱ ,Ang Ⅱ) 是RAS 主要效 应激素,不仅参与调节肾小球内血液动力学的变 化,还可引起肾小球系膜细胞增生和细胞外基质 增多,而这些均是导致肾小球硬化的关键因素。 Ang Ⅱ主要由血管紧张素Ⅰ在血管紧张素转换酶 (angiotensin-converting enzyme,ACE) 作用下生成。 血管紧张素转换酶2(angiotensin-converting enzyme 2,ACE2)是新近发现的活性酶[3],是RAS 新成员, 能水解Ang Ⅱ成为血管紧张素1~7(Ang-1~7), 是肾脏重要的保护因子。已有研究发现,ACE 基 因、Ang Ⅱ -1 型受体基因等RAS 相关基因多态性 与儿童PNS 的发病及预后有关[4],然而有关ACE2 基因多态性与儿童PNS 的关系未见报道。本研究 采用聚合酶链反应- 限制性核酸内切酶片段长度 多态性技术分析ACE2 基因A9570G 多态性,探讨 ACE2 基因多态性与儿童PNS 的关系。 1 资料与方法 1.1 研究对象
选择2012 年6 月至2014 年3 月45 例在广 州市第一人民医院和21 例在广州市南沙中心医 院住院的PNS 患儿共66 例,所有患儿均为广东 汉族,彼此间无血缘关系。其中男39 例,女27 例; 年龄3~14 岁,平均年龄7.8±3.2 岁; 身高 113±18 cm; 体重30±11 kg; 体重指数18±3; 发病时间7~35 d,平均病程22±9 d;24 h 尿蛋 白4.3±2.1 g;血浆白蛋白19±5 g/L;血浆胆固醇 7.2±1.5 mmol/L。其中40 例表现为单纯型,26 例 表现为肾炎型。
PNS 的诊断及糖皮质激素治疗反应类型依据 中华医学会儿科学分会肾脏病学组2009 年指南判 断[5]。PNS 诊断标准:(1)大量蛋白尿;(2)低 蛋白血症,血浆白蛋白低于25 g/L;(3) 高脂血 症,血浆胆固醇高于5.7 mmol/L;(4)出现不同 程度的水肿。激素敏感的判定:泼尼松足量治疗4 周内尿蛋白阴转;激素耐药的判定:泼尼松足量 治疗4 周以上尿蛋白仍阳性。
入选标准:符合PNS 诊断,且无糖皮质激素 禁忌症,无肾功能衰竭、血栓及严重感染等并发症, 入院前未经糖皮质激素治疗,确诊后糖皮质激素 规范治疗时间不少于4 周。
对照组来源于同时期上述两家医院健康体检 的儿童各30 例,共60 例,其中男32 例,女28 例,年龄4~14 岁,平均年龄 8.2±2.4 岁,身高 117±18 cm,体重30±11 kg,体重指数18±4 。 两组性别构成、年龄、身高、体重、体重指数比 较差异无统计学意义(P>0.05)。 1.2 样本采集和DNA 提取
所有患儿空腹抽取静脉血5 mL 置于EDTA 抗 凝试管中,采用Tiangen 公司提供的外周血基因组 DNA 提取试剂盒提取DNA,标化DNA 浓度值至 20 mg/L,溶于TE 缓冲液中,-80℃冻存。 1.3 ACE2 基因多态性检测
采用聚合酶链反应- 限制性核酸内切酶片段 长度多态性技术进行基因分型。上游引物序列为: 5'-CATGTGGTCAAAAGGATATCT -3',下游引物序 列为:5'-AAAGTAAGGTTGGCAGACAT-3'。酶切反 应体系20 μL,包括特异性PCR 扩增产物8 μL, Alu Ⅰ 酶1 U,10×buffer(Alu Ⅰ 酶自带)2 μL, 消毒双蒸水9 μL。酶切温度:37℃,酶切时间: 16 h。酶切产物点样于2% 琼脂糖凝胶,以50 bp ladder 标志作为判断DNA 片段大小的标准物, 100 V 电泳35 min,在紫外灯下观察电泳条带以鉴 定基因型。抽取部分样品测序核实基因型。 1.4 统计学分析
由于ACE2 基因位于X 染色体,按性别进行 分类统计。采用SPSS 13.0 统计软件进行统计学分 析,计量资料用均数± 标准差(x±s)表示,计 数资料用构成比(%)表示。两组间均数比较采 用成组t 检验,组间计数资料比较采用χ2 检验。 P<0.05 为差异有统计学意义。 2 结果 2.1 ACE2 基因型测序及酶切电泳结果
基因测序(图 1)证实ACE2 基因 A9570G 多 态性位于第3 内含子第4 碱基,纯合子呈单峰,杂合子呈双峰。AA 基因型的PCR 产物被酶切成 281 bp 和185 bp 两个片段,GG 基因型的产物不能 被酶切,电泳时仅有1 个片段,长度为466 bp, 而AG 杂合子表现为同时具有281 bp、185 bp 和 466 bp 3 个条带(图 2)。
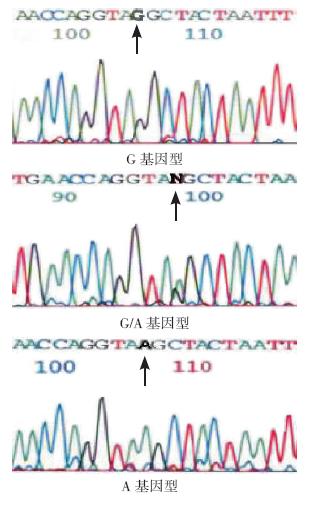 |
图 1 ACE2 基因A9570G 多态测序图图中箭头所 指部分为多态性位点,纯合子呈单峰,杂合子呈双峰。 |
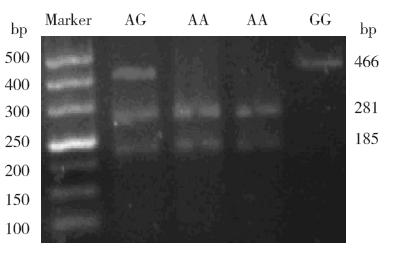 |
图 2 酶切电泳条带 |
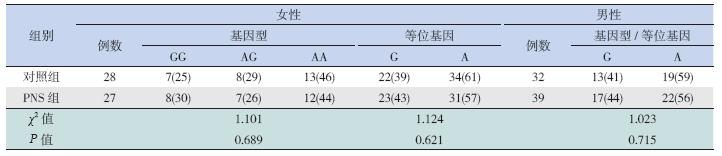
在女性,PNS 组和对照组均以AA 基因型 最常见,两组基因型分布差异无统计学意义 (P=0.689);两组等位基因频率比较差异也无统 计学意义(P=0.621),见表 1。在男性,对照组 和肾病组均以A 基因型常见,两组等位基因频率/ 基因型分布比较差异也无统计学意义(P=0.715), 见表 1。
| 表 1 PNS 组和对照组间ACE2 基因型分布和等位基因频率的比较 [n(%)] |
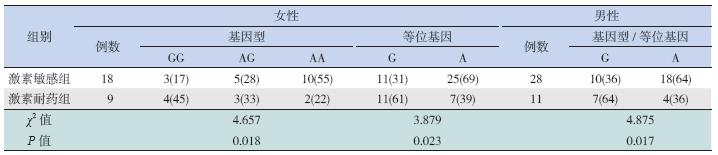
将66 例PNS 患儿按糖皮质激素治疗反应分为 激素敏感组和激素耐药组进行亚组分析。在女性, 激素敏感组GG 基因型频率低于激素耐药组,差 异有统计学意义(P=0.018);激素敏感组G 等位 基因频率亦低于激素耐药组,差异有统计学意义 (P=0.023),见表 2。在男性,激素敏感组G 基 因型/G 等位基因频率低于激素耐药组,差异有统 计学意义(P=0.017),见表 2。
| 表 2 PNS 亚组间ACE2 基因型分布和等位基因频率的比较 [n(%)] |
ACE2 是一种1 型跨膜糖蛋白,与ACE 具有 一定序列相似性的羧肽酶,在肾脏、血管内皮、心、 肺等多种器官和组织中均有表达。ACE2 的主要底 物为Ang Ⅱ,可将其分解为Ang-1~7,后者与其特 异受体Mas 结合,形成ACE2-Ang-(1~7)-Mas 通路, 发挥与传统ACE-Ang Ⅱ -AT1 通路相拮抗的作用。 ACE2 作为RAS 新发现的关键酶,近年来迅速成 为研究热点。Shiota 等[6] 用链脲佐菌素诱导ACE2 基因敲除小鼠和野生型小鼠发生糖尿病,分别在 第4 周和第18 周检测它们的尿液,发现ACE2 基 因敲除小鼠较野生型小鼠的蛋白尿出现早、进展 快;ACE2 基因敲除小鼠的肾小管间质损害更为严 重。Nadarajah 等[7] 发现,足细胞ACE2 表达对肾 损伤具有明显的保护作用,可见ACE2 对肾小球和 肾间质具有保护作用。徐志泉等[8] 研究发现,肾 病综合征患儿存在RAS 的激活,ACE2 可能参与 肾病综合征的发病。
ACE2 基因定位于Xp22[9],有18 个外显子, 本研究中的SNP 位点A9570G 位于第3 内含子, 紧靠外显子的位置,这个位点的变异可以改变 mRNA 的剪接[10],其改变可能对基因的功能产生 影响,从而参与疾病的发生发展。ACE2 基因多态 性与高血压、冠心病等疾病的关系已被多个研究 证实[11, 12],与肾脏疾病的关系也越来越受重视, Chaoxin 等[13] 研究发现携带G 等位基因的男性糖 尿病患者容易出现尿蛋白,提示G 等位基因可能 是肾脏损害的易感因素之一,而Currie 等[14] 针对 糖尿病肾病与ACE2 基因多态性的关系的研究,并 未发现阳性结果。有关ACE2 基因多态性与肾脏疾 病的研究结果尚不一致,有待进一步研究。本研 究发现,ACE2 基因A9570G 多态性在PNS 患儿和 健康儿童中的基因型分布和等位基因频率未见明 显差异,提示该多态性位点与儿童PNS 的发病无 明显关系。进一步行亚组分析发现,在女性,激 素敏感组GG 基因型频率和G 等位基因频率均低 于激素耐药组;在男性,激素敏感组G 基因型/G 等位基因频率低于激素耐药组,提示ACE2 基因 A9570G 多态性与PNS 患儿激素治疗反应有关,G 等位基因可能是激素耐药的遗传易感因素,而糖 皮质激素是治疗儿童PNS 的首选药,因此,检测 ACE2 基因A9570G 多态性有助于儿童PNS 的疗效 评估及预后判断。ACE2 基因A9570G 多态性如何 影响儿童PNS 对激素治疗的反应目前尚不清楚。 有研究发现,用牛血清白蛋白处理人肾近曲小管 上皮细胞可以导致ACE m-RNA 及蛋白水平显著升 高,ACE2 m-RNA 与蛋白水平下降,而细胞培养 液中Ang Ⅱ生成量增多,说明在病理状条件下产 生蛋白尿后,可能通过上调肾脏ACE 水平,下调 ACE2 水平诱导局部RAS 激活,加速肾脏病变进 程[15]。因此,本研究推测,当儿童PNS 发生后大 量的蛋白尿导致局部RAS 激活,由于基因多态性 的存在导致患儿局部RAS 激活的程度和反应有所 不同,特别是局部ACE2 水平的降低,导致肾脏病 变程度和对药物治疗反应均有所不同。
综上所述,本研究通过对PNS 患儿ACE2 基 因 A9570 多态性分析,发现ACE2 基因 A9570 多 态性与儿童PNS 的发生无明确关联,但可能与 PNS 患儿糖皮质激素治疗反应有关,G 等位基因有 望作为PNS 患儿预后的预测指标。但本研究样本 量小,尚需大样本、多中心进一步研究,并深入 探讨其内在机制,为儿童PNS 防治提供有效的理 论依据。
| [1] | Tikellis C, Bernardi S, Burns WC. Angiotensin-converting enzyme 2 is a key modulator of the renin-angiotensin system in cardiovascular and renal disease[J]. Curr Opin Nephrol Hypertens, 2011, 20(1): 62-68. |
| [2] | Burns WC, Thomas MC. Angiotensin II and its role in tubular epithelial to mesenchymal transition associated with chronic kidney disease[J]. Cells Tissues Organs, 2011, 193(1-2): 74-84. |
| [3] | Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensinconverting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9[J]. Circ Res, 2000, 87(5): E1-E9. |
| [4] | Prasun P, Prasad N, Tripathi G, et al. Association of angiotensinconverting enzyme gene I/D polymorphism with steroid responsiveness in childhood nephrotic syndrome[J]. Indian J Nephrol, 2011, 21(1): 26-29. |
| [5] | 中华医学会儿科学分会肾脏病学组. 儿童常见肾脏疾病诊治 循证指南(一):激素敏感、复发/依赖肾病综合征诊治循 证指南(试行)[J]. 中华儿科杂志, 2009, 47(3): 167-169. |
| [6] | Shiota A, Yamamoto K, Ohishi M, et al. Loss of ACE2 accelerates time-dependent glomerular and tubul ointerstitial damage in streptozotocin-induced diabetic mice[J]. Hypertens Res, 2010, 33 (4): 298-307. |
| [7] | Nadarajah R, Milagres R, Dilauro M, et al. Podocyte-specific over expression of human angiotensin-converting enzyme 2 attenuates diabetic nephropathy in mice[J]. Kidney Int, 2012, 82(3): 292-303. |
| [8] | 徐志泉, 易著文, 党西强, 等. 原发性肾病综合征儿童24 小 时动态血压与肾素-血管紧张素- 醛固酮水平的关系[J]. 中 国当代儿科杂志, 2010, 12(10): 788-792. |
| [9] | Eräranta A, Riutta A, Fan M, et al. Dietary phosphate binding and loading alter kidney angiotensin-converting enzyme mRNA and protein content in 5/6 nephrectomized rats[J]. Am J Nephrol, 2012, 35(5): 401-408. |
| [10] | Loudianos G, Iovicu M, Dessi V, et al. Abnormal mRNA splicing resulting from consensus sequence splicing mutations of ATP7B[J]. Hum mutat, 2002, 20(4): 260-266. |
| [11] | Patnaik M1, Pati P, Swain SN, et al. Association of angiotensinconverting enzyme and angiotensin-converting enzyme-2 gene polymorphisms with essential hypertension in the population of Odisha, India[J]. Ann Hum Biol, 2014, 41(2): 143-150. |
| [12] | Vašků A, Bienertová-Vašků J, Pařenica J, et al. ACE2 gene polymorphisms and invasively measured central pulse pressure in cardiac patients indicated for coronarography[J]. J Renin Angiotensin Aldosterone Syst, 2013, 14(3): 220-226. |
| [13] | Chaoxin J, Daili S, Yanxin H, et al. The influence of angiotensinconverting enzyme 2 gene polymorphisms on type 2 diabetes mellitus and coronary heart disease[J]. Eur Rev Med Pharmacol, 2013, 17(19): 2654-2659. |
| [14] | Currie D, McKnight AJ, Patterson CC, et al. Investigation of ACE, ACE2 and AGTR1 genes for association with nephropathy in Type 1 diabetes mellitus[J]. Diabet Med, 2010, 27(10): 1188- 1194. |
| [15] | Liu BC, Gao J, Li Q, et al. Albumin caused the increasing production of angiotensin II due to the dysregulation of ACE/ACE2 expression in HK2 cells[J]. Clin Chim Acta, 2009, 403(1-2): 23-30. |
 2015, Vol. 17
2015, Vol. 17