尽管世界卫生组织(WHO)已经把全世界范 围内麻疹消除作为自己的工作目标[1],但目前麻疹 仍是全世界范围内常见的传染病,威胁全世界儿 童的健康,尤其婴幼儿;麻疹易继发呼吸系统、 神经系统和心血管系统的并发症[2, 3]。文献报道 50% 的住院麻疹患儿并发肺炎,部分患儿可能出 现急性呼吸窘迫综合征(ARDS)[3, 4]。自发性气漏 和ARDS 是麻疹儿童早期的临床严重并发症,一 旦出现这些并发症需要进行呼吸支持治疗,具有 高病死率[5]。因此探讨影响麻疹患儿并发ARDS 的 临床相关因素,对于病情估计、治疗策略的选择 及预后的判断等具有重要意义。本研究探讨了麻 疹患儿并发ARDS 的危险因素,报告如下。 1 资料与方法 1.1 研究对象
2014 年1~5 月我院PICU 住院的重症麻疹患 儿55 例,其中合并肺炎52 例,喉炎2 例,抽搐1 例, 均有低氧血症,合并肺炎及喉炎患儿均有气促及 发绀。55 例患儿中,男44 例(80%),女11 例 (20%);年龄2~25 个月,平均年龄9±4 个月; 并发ARDS 11 例,未并发ARDS 44 例。 1.2 诊断标准
(1)麻疹诊断标准[6]:根据《中华人民共和 国传染病防治法》及《中华人民共和国传染病防 治法实施办法》制定的标准进行诊断:① 确诊: 1 个月内未接种过麻疹减毒活疫苗而血清麻疹抗体 IgM 阳性,且出现发热(>38℃),全身皮肤出现 红色斑丘疹,或伴有咳嗽或上呼吸道卡他症状或结 膜炎;② 临床诊断:血清麻疹抗体IgM 阴性,有 发热(>38℃),全身皮肤出现红色斑丘疹,或伴 有上呼吸道卡他症状或结膜炎,或口腔颊黏膜见 到麻疹黏膜斑,或皮肤红色斑丘疹由耳后开始向 全身扩展,持续3 d 以上呈典型经过,或有与确诊 麻疹的患者接触史,潜伏期6~18 d。本研究55 例 患儿中确诊54 例,临床诊断1 例。
(2)ARDS 的诊断标准:参照美国医学会杂 志(JAMA)2012 年公布的柏林标准[7]。
(3)脓毒症的诊断标准:参照2005 年美国 胸科医师学会/ 危重病医学会(ACCP/SCCM)发 布的拟订标准[8]。 1.3 研究方法
本研究采用回顾性分析,收集患儿临床资 料,包括:(1)一般情况,如年龄、性别、居住 地、是否存在基础疾病、营养状况(本研究参照 WHO2006 年生长发育量表体重低于同年龄、同性 别人群正常值的均数减2 个标准差考虑营养不良) 等;(2)病史采集,包括患儿疫苗接种情况及麻 疹接触史;(3)临床表现,包括发病后出疹时间、 发病至入院时间、入院时吸氧方式(鼻导管/ 面罩)、 是否合并脓毒症等;(4)实验室检查,包括白细 胞计数、淋巴细胞计数、C 反应蛋白(CRP)水平、 血清白蛋白水平等。 1.4 统计学分析
应用SPSS 19.0 统计软件进行统计学处理与 分析。符合正态分布的计量资料以均数± 标准差 (x±s)表示,不符合正态分布的采用中位数(四 分位数间距)[P50(P25,P75)] 表示,组间比较 采用两独立样本t 检验或Mann-Whitney U 检验; 计数资料以百分比表示,组间比较采用χ2 检验或 Fisher 精确概率检验。对涉及的相关因素进行单因 素分析后,筛选出有统计学意义的相关影响因素 采用逐步引入剔除法进行多因素非条件logistic 回 归分析。P<0.05 为差异有统计学意义。 2 结果 2.1 ARDS 组与非ARDS 组相关临床因素的比较
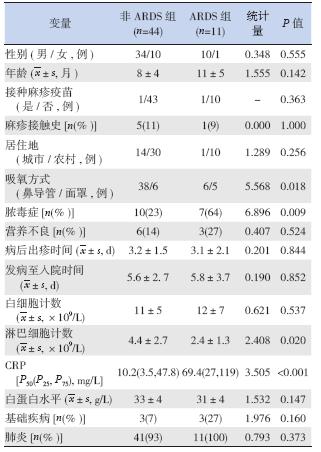
两组患儿入院时吸氧方式(鼻导管/ 面罩)、 合并脓毒症比例、CRP 水平及淋巴细胞计数差异 均有统计学意义(P<0.05),而在患儿性别、年龄、 是否接种麻疹疫苗、是否有麻疹接触史、居住地、 是否有营养不良、是否存在基础疾病、病后出疹 时间、发病至入院时间、白细胞计数、血白蛋白 水平等方面,两组比较差异无统计学意义,见表 1。
| 表 1 ARDS 组和非ARDS 组相关临床因素的比较 |
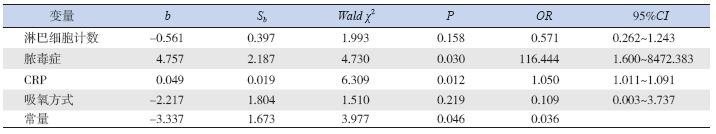
对筛选出的4 项可能影响麻疹儿童并发ARDS 的临床相关因素,即入院时吸氧方式(鼻导管/ 面 罩)、合并脓毒症比例、血CRP 水平及淋巴细胞 计数,进行多因素logistic 回归分析,显示合并脓 毒症和血CRP 水平增高为麻疹儿童并发ARDS 的 主要危险因素(表 2)。
| 表 2 影响麻疹儿童并发ARDS 的多因素logistic 回归分析结果 |
麻疹疫苗的出现有效地降低了麻疹的发病率, 但是近年来世界范围内仍有麻疹小范围暴发流行 的报道[9]。麻疹病毒感染有别于其他病毒感染,其 发病与是否麻疹疫苗的接种、营养状态、免疫状 态等相关[10, 11, 12]。其并发症主要累及呼吸系统、中 枢神经系统甚至心血管系统,肺炎和脑炎是常见 的死亡原因,其中脑炎易导致长期后遗症,在发 展中国家麻疹也是致盲的常见原因之一[13, 14]。
ARDS 是由多种因素造成肺毛细血管内皮细胞 和肺泡上皮细胞损伤造成弥漫性肺间质及肺泡水 肿,其临床特点是进行性或者顽固性低氧血症和 双肺浸润性阴影,其发病急,进展快,病死率可 高达27%~45%[6]。
尽管机械通气和体外膜肺氧合(EMCO)等 治疗方式不断进展,但这些措施并没有显著降低 ARDS 的发病率和病死率[15, 16]。本研究55 例麻疹 患儿中有11 例并发ARDS。影响麻疹患儿的发病 因素较多,单一的临床或生化指标不能对是否并 发ARDS 进行准确预测。本研究首先通过单因素 分析,发现入院时淋巴细胞计数、合并脓毒症比 例、血CRP 水平、吸氧方式在并发ARDS 组和非 ARDS 组间差异有统计学意义;然后通过非条件 logistic 多因素回归方法进一步分析,发现合并脓 毒症及血CRP 水平增高的麻疹患儿并发ARDS 的 风险增加(OR 分别为116.444、1.050)。
脓毒症由感染因素引起的全身炎症反应综合 征,引起感染的因素可能包括细菌、病毒、真菌、 寄生虫等。麻疹患儿出现脓毒症,可能的原因为 麻疹病毒直接引起的全身炎症反应或者在麻疹的 基础上继发或合并细菌或者其他病原体感染。一 旦出现脓毒症大量炎症介质入血,刺激炎症细胞 在肺组织的聚集和活化,产生的细胞因子、趋化 因子以及氧自由基等导致肺毛细血管内皮细胞和 肺泡上皮细胞受损,肺泡毛细血管壁对水和蛋白 质的通透性增加,进而导致ARDS 的发生[17]。另 外可能的原因是麻疹病毒的复制直接导致细胞结 构的损伤,尤其是肺泡上皮细胞及血管内皮细胞 的损伤,从而激活炎性细胞因子的释放形成逐级 放大的瀑布样连锁反应引起ARDS。我国文献报道 脓毒症占ARDS 发病原因的22.7%[18]。
CRP 是由肝脏合成的一种经典的急性时相 反应蛋白,在机体发生创伤或急性炎性发作后 6~12 h 血中浓度即明显增加,创伤和炎性修复或 清除后下降,是机体炎性反应的标志物。ARDS 是肺泡的弥漫性损害及免疫反应和非特异性炎症 反应的过程,有学者研究CRP 在ARDS 患者中的 诊断价值,但结果却有所差异[19, 20]。本研究中, ARDS 组入院时血CRP 水平显著高于非ARDS 组。 有文献报道CRP 测定诊断ARDS 的阴性预计值为 97.3%,阳性预计值为89.1%[21],说明CRP 在诊断 ARDS 中具有临床应用价值,可参考用于ARDS 的 早期诊断。
本研究的不足之处与局限性在于纳入病例数 相对较少;血CRP 水平、淋巴细胞计数、白细胞 计数等指标均为入院时采集标本,未能动态监测 以上指标的变化;部分麻疹患儿入PICU 前已在外 院接受治疗,本研究缺乏对患儿细胞免疫功能状 态的监测和统计分析,其可能对ARDS 的发生有所影响。
总之,影响麻疹患儿并发ARDS 的因素复杂 多样,精准预测其发生具有挑战性。本研究显示, 合并脓毒症、血CRP 水平增高的麻疹患儿并发 ARDS 的危险增加,但由于本研究病例数较少,需 扩大样本量进一步观察。
| [1] | Perry RT, Gacic-Dobo M, Dabbagh A, et al. Global control and regional elimination of measles, 2000-2012 [J]. MMWR Morb Mortal Wkly Rep, 2014, 63(5): 103-107. |
| [2] | Asaria P, MacMahon E. Measles in the United Kingdom: can we eradicate it by 2010?[J]. BMJ, 2006, 333(7574): 890-895. |
| [3] | Abramson O, Dagan R, Tal A, et al. Severe complications of measles requiring intensive care in infants and young children[J]. Arch Pediatr Adolesc Med, 1995, 149(11): 1237- 1240. |
| [4] | Weber I, Bouaziz JD, Wolkenstein P, et al. Respiratory distress with radiographic pleural effusion during measles virus infection[J]. J Eur Acad Dermatol Venereol, 2010, 24(1): 113- 114. |
| [5] | Piastra M, Onesimo R, De Luca D, et al. Measles-induced respiratory distress, air-leak and ARDS[J]. Eur J Clin Microbiol Infect Dis, 2010, 29(2): 181-185. |
| [6] | 卫生部政策法规司. WS296-2008 麻疹诊断标准[S]. 北京: 人 民卫生出版社, 2009. |
| [7] | Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012, 307(23): 2526-2533. |
| [8] | Goldstein B, Giroir B, Randolph A. International Pediatric Sepsis Consensus Conference: Definitions for Sepsis and Organ Dysfunction in Pediatrics[J]. Pediatr Crit Care Med, 2005, 6(1): 2-8. |
| [9] | Abdulkarim A, Johnson A, Yahaya-Kongoila S, et al. Measles:the past, the present and the future[J]. Niger J Paed, 2012, 39(3): 144-148. |
| [10] | Qaisar I, Ahmad A, Ahmad F, et al. Comparison of measles complications in well-nourished and mal-nourished children[J]. J Ayub Med Coll Abbottabad, 2009, 21(2): 30-31. |
| [11] | Aaby P, Samb B, Simondon F, et al. Non-specific beneficial effect of measles immunisation: analysis of mortality studies from developing countries[J]. BMJ, 1995, 311(7003): 481-485. |
| [12] | Lim TA, Marinova L, Kojouharova M, et al. Measles outbreak in Bulgaria: poor maternal educational attainment as a risk factor for medical complications[J]. Eur J Public Health, 2013, 23(4): 663-669. |
| [13] | Perry RT, Halsey NA. The clinical significance of measles: a review[J]. J Infect Dis, 2004, 189(Suppl 1): 4-16. |
| [14] | Rafat C, Klouche K, Ricard JD, et al. Severe measles infection: the spectrum of disease in 36 critically ill adult patients[J]. Medicine(Baltimore), 2013, 92(3): 257-272. |
| [15] | Phua J, Badia JR, Adhikari NK, et al. Has mortality from acute respiratory distress syndrome decreased over time?: A systematic review[J]. Am J Respir Crit Care Med, 2009, 179(3): 220-227. |
| [16] | Stawicki SP, Goyal M, Sarani B . High-frequency oscillatory ventilation (HFOV) and airway pressure release ventilation(APRV): a practical guide[J]. J Intensive Care Med, 2009, 24(4): 215-229. |
| [17] | Wada T, Jesmin S, Gando S, et al. The role of angiogenic factors and their soluble receptors in acute lung injury (ALI)/acute respiratory distress syndrome (ARDS) associated with critical illness[J]. J Inflamm (Lond), 2013, 10(1): 6. |
| [18] | 喻文亮, 陆铸今, 王莹, 等. 小儿ARDS 前瞻性多中心临床 流行病学研究[J]. 中华急诊医学杂志, 2005, 14(6): 448-453. |
| [19] | Lobo SM, Lobo FR, Bota DP, et al. C-reactive protein levels correlate with mortality and organ failure in critically ill patients[J]. Chest, 2003, 123(6): 2043-2049. |
| [20] | Bajwa EK, Khan UA, Januzzi JL, et al. Plasma C-reactive protein levels are associated with improved outcome in ARDS[J]. Chest, 2009, 136(2): 471-480. |
| [21] | 陈雪峰, 李小民, 刘克喜, 等. C 反应蛋白测定对ARDS 的早 期诊断价值[J]. 世界急危重病医学杂志, 2004, 1(5): 354-355. |
 2015, Vol. 17
2015, Vol. 17