2. 郑州大学第三附属医院小儿血液科, 河南 郑州 450052;
3. 郑州大学医学院病理生理教研室, 河南 郑州 450001;
4. 郑州大学第一附属医院小儿血液病实验室, 河南 郑州 450052
再生障碍性贫血(aplastic anemia,简称再障)是由免疫机制介导为主的、多因素综合作用引起的骨髓造血功能衰竭、全血细胞减少为特征的血液系统疾病,已研究证实调节性 T 细胞(Treg)表达紊乱参与了再障的发病及转归[1],而转录因子Foxp3 及活化的 T 细胞核因子(NFAT)在 Treg 的发育和分型中起重要作用,Foxp3 可能通过翻译水平来改变 Treg 的抑制功能,Foxp3 与 NFAT1 之间相互依存,两者在自身免疫性疾病中的作用逐渐成为研究热点,但有关 Foxp3 与 NFAT1 在再障发病中的作用目前尚不清楚,且两者联合检测在国内外尚较少。本研究采用免疫印迹试验(Western blot)方法检测再障患儿外周血中 Foxp3 及 NFAT1在蛋白水平的表达,并分析其与外周血血红蛋白(Hb)、白细胞(WBC)及血小板(PLT)数量的相关性,探讨它们之间的相互关系及在再障免疫学发病机制中的作用。1 资料与方法1.1 研究对象
研究对象为郑州市妇幼保健院、郑州大学一附院及三附院 2012 年 6 月至 2013 年 12 月确诊并治疗有效达缓解标准的 68 例再障患儿,其中男33 例,女 35 例,年龄 2~13 岁,中位年龄 7 岁;诊断及疗效标准均符合《小儿再障诊疗建议》[2]。均为初治患儿,既往均未给予输血及免疫抑制剂治疗。入院后均给予免疫抑制剂、小剂量皮质激素、雄性激素及预防出血、贫血及感染等一般对症支持治疗,治疗 6 个月后均达缓解标准(恢复期)。郑州市妇幼保健院同期体检的 60 例健康儿童作为对照组,其中男 30 例,女 30 例,年龄 1~13 岁,中位年龄 6 岁,其体检各项指标均在正常范围内。对照组与再障组年龄、性别差异无统计学意义(P>0.05)。该研究获得两组儿童家长知情同意。1.2 标本的采集
对照组于清晨空腹抽取外周静脉血 5 mL,再障组于发病期及治疗 6 个月达恢复期清晨空腹抽取外周静脉血 5 mL,用 EDTA 抗凝,其中 1 mL用于检测外周血Hb、WBC及PLT数量,其余4 mL 采用密度梯度离心法分离单个核细胞,保存于 -80℃冰箱,用于 Western blot 检测。1.3 Foxp3和NFAT1蛋白的检测
采 用 Western blot 法 检 测 Foxp3 和 NFAT1 蛋白的表达。提取细胞样品的蛋白质,采用 BCA 法测定蛋白质含量,将提取好的蛋白质样品在 BioRad 电泳槽中进行电泳,Foxp3 蛋白采用半干转膜法、NFAT1 蛋白采用不连续转膜法分别进行转膜,用封闭液封闭后洗膜 3 次,一抗鼠抗人 NFAT1 蛋白单克隆抗体(1 : 100 稀释)、一抗兔抗人 Foxp3蛋白多克隆抗体(1 : 200 稀释)、一抗鼠抗人β-actin蛋白单克隆抗体(1 : 1 000 稀释)分别于4℃摇床孵育至少 12 h,PBST 洗膜 3 次,用 HRP 标记的山羊抗鼠及山羊抗兔 IgG 抗体(稀释比例均为1 : 10 000),室温摇床孵育 1 h,PBST 洗膜 3 次,用 ECL 化学发光试剂作用后于暗室内压 X 光片曝光、显影、定影,水洗胶片晾干后保存。1.4 统计学分析
采用 SPSS 15.0 统计软件进行数据处理与分析,计量数据以均数 ± 标准差(x±s)表示,多样本均数比较采用单因素方差分析,组间比较采用 LSD 法,变量间的相关性分析采用 Pearson 积矩相关分析法,P<0.05 为差异有统计学意义。2 结果2.1 再障组与对照组外周血 Foxp3 及 NFAT1 表达的比较
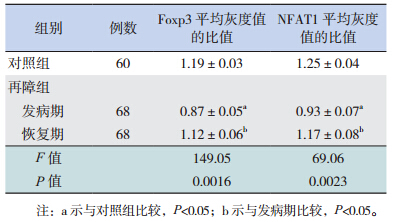
再障组发病期患儿外周血中 Foxp3、NFAT1蛋白的表达水平较对照组明显降低(P<0.05);再障组恢复期的表达水平较发病期明显升高(P<0.05),与对照组比较差异无统计学意义(表 1)。
| 表 1 两组中Foxp3 及NFAT1 蛋白的表达水平比较(x±s) |
再障组发病期患儿外周血中 Foxp3 和 NFAT1蛋白的表达呈正相关性(r=0.812,P<0.05)(图 1)。
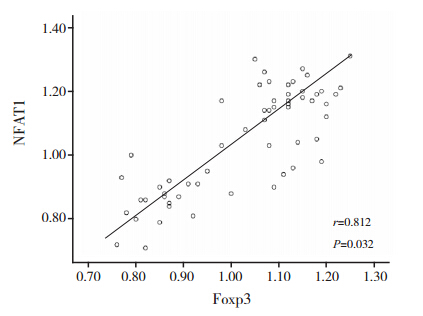 |
图 1 IM 再障组发病期患儿外周血中Foxp3和NFAT1蛋白表达的相关性 |
再障组恢复期患儿 Foxp3 蛋白表达水平与外周血 Hb、WBC 及 PLT 数量均呈正相关关系(r分别 为 0.537、0.579、0.655;P<0.05);NFAT1 蛋白表达水平与外周血 Hb、WBC 及 PLT 数量亦均呈正相关关系(r分 别 为 0.497、0.524、0.623;P<0.05)。3 讨论
细胞免疫异常在再障的发病中起主导作用。新近研究证明,再障患者外周血中存在 Treg 数量和功能的异常[3,4],而Foxp3 特异性地表达在CD4+ CD25+Treg 中,参与了 Treg 的发育、分化及免疫抑制功能[5]。研究发现,Foxp3 基因缺陷的小鼠体内CD4+ CD25+Treg 数量减少或调节功能缺失,可诱发严重的自身免疫性疾病,因此 Foxp3 对机体免疫稳态的调节起决定性作用[6]。Foxp3 的蛋白表达水平在 T 细胞抗原受体(TCR)刺激后有所上升,且上升幅度与 Treg 的抑制功能呈明显正相关,提示 Foxp3 可能通过翻译水平来改变 Treg 的抑制功能[7]。NFAT 是 TCR 介导的信号转导通路中非常关键的转录因子,可与人 IL-2 启动子的末梢抗原受体应答元件结合,并能产生快速诱导作用的核因子[8]。Solomou 等[3] 研究证实,再障患儿外周血中 Treg 表达水平降低,Foxp3 在蛋白水平和 mRNA水平均明显降低,同时 NFAT1 蛋白的表达亦降低,且 NFAT1 蛋白的低表达可能可以解释 Treg 的减少频率和 Foxp3 的低表达,提示 Treg 缺乏及 Foxp3、NFAT1 表达降低与再障的发病有关。 本研究用 Western blot 方法检测 68 例再障患儿治疗前后及 60 例健康儿童的外周血中 Foxp3、NFAT1 蛋白的表达水平的变化,发现再障患儿发病期(治疗前)较对照组明显降低,与 Solomou等[3] 研究结果一致,提示再障患儿体内 Foxp3 与NFAT1 蛋白在外周血中表达是降低的,且发病期表达低于恢复期,由此可能导致了机体免疫耐受被打破,并启动自身免疫应答,促进了再障的发生,提示 Foxp3 与 NFAT1 蛋白的低表达可能参与了再障的发病。经治疗有效后外周血中 Foxp3 与NFAT1 蛋白的表达水平上升,且与外周血 Hb、WBC 及 PLT 数量均呈正相关性,说明经免疫调节剂治疗有效后,机体免疫功能恢复,随之血象也逐渐恢复正常。因此,本研究认为 Foxp3 与NFAT1 蛋白在一定程度上可以提示病情的变化。转 录 因 子 Foxp3 及 NFAT 均 在 Treg 的 发 育和分型中起重要的作用。Bettelli 等[9] 研究发现:Foxp3 通过抑制 NFAT 的活性发挥它强有力的免疫抑制作用,它们之间相互联系,并且 Foxp3 可以阻断 NFAT 调控的基因表达。NFAT 蛋白的一部分片段定位于 Treg 的核心,在此处选择性地与Foxp3 蛋白结合,从而控制 Treg 的抑制功能[10]。当 NFAT 家族成员缺失时,CD4 T 细胞向 Treg 转化的能力也会明显降低,NFAT 的数量也决定了TGF-β 诱导的 Treg 的表达量[11]。本研究显示,再障患儿外周血单个核细胞内 Foxp3、NFAT1 蛋白的表达呈正相关性,说明两者在 Treg 的发育和分化中可能起协同作用。 综上所述,本研究表明,再障患儿外周血单个核细胞中 Foxp3、NFAT1 蛋白表达明显降低,两者的表达水平呈正相关性,且与外周血 Hb、WBC及 PLT 数量均呈正相关性,提示 Foxp3、NFAT1蛋白的低表达可能参与了再障的发生发展,而且在一定程度上可以提示病情的变化,此发现可作为再障免疫治疗的新靶点之一进行深入研究。
| [1] | 王西阁, 王晓格, 栾斌, 等. 调节性T细胞及Foxp3基因在 再生障碍性贫血患儿外周血中的变化及意义[J]. 中国当代儿科杂志, 2010, 12(4): 241-243. |
| [2] | 中华医学会儿科分会血液组, 中国小儿血液与肿瘤编委会. 小儿再生障碍性贫血的诊疗建议[J]. 中国小儿血液与肿瘤杂志, 2007, 12(5): 236-240. |
| [3] | Solomou EE, Rezvani K, Mielke S, et al. Deficient CD4+CD25+FOXP3+ T regulatory cells in acquired aplastic anemia[J]. Blood, 2007, 110(5): 1603-1606. |
| [4] | Chen J, Ellison FM, Eckhaus MA, et al. Minor antigen H60- mediated aplastic anemia is ameliorated by immunosuppression and the infusion of regulatory T cells[J]. J Immunol, 2007, 178(7): 4159-4168. |
| [5] | Park JH, Ko JS, Shin Y, et al. Intranuclear interactomic inhibition of Foxp3 suppresses functions of Treg cells[J]. Biochem Biophys Res Commun, 2014, 451(1): 1-7. |
| [6] | Fontenot JD, Rudensky AY. A well adapted regulatory contriveance: regulatory T cell development and the forkhead family transcription factor Foxp3[J]. NAT Immunol, 2005, 6(4): 331-337. |
| [7] | Sakaguchi S. Regulatory T cells: history and perspective[J]. Methods Mol Biol, 2011, 707(10): 3-17. |
| [8] | Ghosh S, Koralov SB, Stevanovic I, et al. Hyperactivation of nuclear factor of activated T cells 1 (NFAT1) in T cells attenuates severity of murine autoimmune encephalomyelitis[J]. Proc Natl Acad Sci USA, 2010, 107(34): 15169-15174. |
| [9] | Bettelli E, Dastrange M, Oukka M. Foxp3 interacts with nuclear factor of activated T cells and NF-κB to repress cytokine gene expression and effector functions of T helper ceells[J]. Proc Natl Acad Sci USA, 2005, 102(14): 5138-5143. |
| [10] | Li Q, Shakya A, Guo X, et al. Constitutive nuclear localization of NFAT in Foxp3+ regulatory T cells independent of calcineurin activity[J]. J Immunol, 2012, 188(9): 4268-4277. |
| [11] | Vaeth M, Schliesser U, Muller G, et al. Dependence on nuclear factor of activated T-cells (NFAT) levels discriminates conventional T cells from Foxp3+ regulatory T cells[J]. Proc Natl Acad Sci USA, 2012, 109(40): 16258-16263. |
 2015, Vol. 17
2015, Vol. 17