新生儿缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)是由于各种围生期窒息引起 的部分或者完全缺氧,脑血流减少或者暂停而导 致胎儿或新生儿脑损伤性疾病,是引起新生儿急 性死亡和慢性神经系统损伤的主要原因之一[1]。 本病发病机制比较复杂,细胞内钙超载是目前 比较认同的引起HIBD 的机制之一,而钙网蛋白 (calreticulin,CRT)作为内质网中的一种多功能分 子伴侣,在维持细胞内Ca2+ 稳态中发挥重要作用。 目前研究认为:坏死和凋亡是HIBD 时神经元死亡 的两种主要形式,脑缺氧缺血导致的迟发性神经 元死亡主要与细胞凋亡有关[2]。
参附注射液的主要成分是人参皂甙和乌头类 生物碱,对心血管系统、缺血再灌注损伤、免疫系 统以及抗肿瘤治疗等具有良好的保护作用。近年来 研究发现参附注射液对颅脑损伤也有很好的保护 作用[3],王军等[4] 前期研究发现参附注射液能减少 HIBD 新生大鼠海马神经元凋亡的发生。但其对于 HIBD 后CRT 表达以及细胞内Ca2+ 的影响如何,国 内外尚未见报道。本实验参照Rice 法[5] 建立HIBD 模型,观察参附注射液对HIBD 后皮质区Ca2+ 相关 蛋白CRT 表达及神经元凋亡的影响,探讨参附注 射液在HIBD 新生大鼠中可能的脑保护机制。 1 材料与方法 1.1 实验动物
7 日龄新生Sprague-Dawley(SD)大鼠,体重 12~16 g,雌雄不限,由徐州医学院实验动物中心 提供。 1.2 主要试剂
Trizol Reagent 试剂为Invitrogen 公司产品, RT-PCR 试剂盒购于北京天根生化科技有限公司, 引物及内参均由上海生工生物技术服务有限公司 提供;兔抗鼠CRT 多克隆抗体购于美国CST 公司, 羊抗兔二抗以及β-actin 一抗、二抗均购于北京中 杉金桥生物技术有限公司;Fura-2/AM 由Sigma 公 司生产,参附注射液由雅安三九药业有限公司生 产(批号:Z20043116)。 1.3 动物模型的制备及分组
新生SD 大鼠随机分为对照组、缺氧缺血组和 参附干预组。参照Rice 法[5] 制作HIBD 模型:将 新生7 d SD 大鼠用无水乙醚吸入麻醉后,取仰卧 位,四肢固定于手术板上,颈正中线切开皮肤, 游离右侧颈总动脉,丝线结扎,缝合切口,造成 缺血;回窝休息2 h,再置于一体积为2 000 mL、 底部铺有CO2 吸收剂钠石灰、与混合气体相连的 密闭有机玻璃箱内;将该容器置于37℃水浴中, 以1~2 L/min 的速度输入含8% 氧气、92% 氮气的 混合气体,持续2 h,造成缺氧。对照组只做颈部 切开和右侧颈总动脉分离术,不结扎,缝合切口 后呼吸正常空气。参附干预组于造模成功后立即 腹腔注射参附注射液(10 mL/kg),每日1 次, 连用3 d。缺氧缺血组于造模成功后与对照组一同 行等量生理盐水腹腔注射。各组按照观察时间点 不同进一步分为缺氧缺血后3、6、12、24、72 h 5 个亚组,每组均10 只,其中8 只用于基因、蛋白、 Ca2+ 浓度及凋亡率的检测,另外2 只用于苏木精- 伊红(HE)染色。 1.4 HE 染色标本制备
分离出各组新生大鼠的右侧大脑半球标本, 常规固定、脱水、石蜡包埋后,为了具有可比性, 统一取相当于耳间前线2 mm 水平(即相当于大脑 中后1/3 部位)行冠状位脑组织切片,采用HE 染色, 光镜下观察皮层脑组织病理变化。 1.5 RT-PCR 检测CRT mRNA 含量
取新鲜大脑皮层标本,用TRIzol 试剂提 取总RNA,采用逆转录试剂盒,按照说明书 操作步骤进行逆转录反应。CRT 引物序列: 上游5'-CAAGGATATCCGGTGTAAGGA-3', 下游5'-CATAGATATTCGCATCGGGG-3',产 物长度445 bp; 内参β-actin 引物序列: 上 游5'-CGTAAAGACCTCTATGCCAACA-3',下游 5'-CGGACTCATCGTACTCCTGCT-3',产物长度 229 bp。PCR 反应体系(25 μL):cDNA 3 μL, 2×Taq PCR MasterMix 12.5 μL,上下游引物各 1 μL,ddH2O 7.5 μL。PCR 扩增条件为:94℃预变 性3 min;94℃变性30 s,55℃(CRT)/57℃(β-actin) 退火30 s,72℃延伸1 min,30 个循环;72℃再延 伸7 min 终止反应。取5 μL PCR 产物在1.5% 琼脂 糖凝胶电泳后,用凝胶成像分析系统扫描、拍照, 结果以目的基因与内参基因条带灰度值比值表示。 1.6 Western blot 检测CRT 蛋白含量
取新鲜右侧大脑皮层组织,用RIPA 裂解液裂解蛋白,BCA 法蛋白定量。上样后SDS-PAGE 凝 胶电泳,半干转法转NC 膜。一抗(1 : 100)4℃孵 育过夜后孵育二抗。DAB 法显色后拍照,用Image J 图像分析系统测条带灰度值,并做统计学分析。 1.7 脑细胞内游离Ca2+ 浓度测定
于不同时间点将各组新生大鼠快速断头取脑, 至于冷Hank's 液中(pH 7.4),分离右侧大脑皮层, 冲洗后剪碎,加适量0.125% 胰酶消化3~5 min 后 用含10% 小牛血清的DMEM 终止消化,200 目过 筛后1 500 r/min 离心5 min,弃上清,将脑细胞 悬浮于Hank's 液中制成脑细胞悬液。取上述悬液 1.5 mL 中加入1 mmol/L 的Fura-2/AM 7.5 μL,37℃ 恒温振荡孵育40 min,用Hank's 液洗涤2 次,最 后Hank's 液(pH 7.0)悬浮,用毛细吸管吸取细 胞悬液滴一滴于洁净载玻片上,盖上盖玻片静置 2 min,荧光显微镜观察脑细胞,荧光图像分析系 统检测单个脑细胞荧光强度,激发波长为340 nm 和380 nm,发射波长为505 nm,F340 nm/F380 nm 比值测定胞浆Ca2+ 浓度。 1.8 流式细胞术检测各组大脑皮层神经元凋亡率
新鲜大脑皮层组织置于PBS 中轻柔剪碎,放 离心管中用PBS 稀释为4 mL,反复吹打20 次,沉 淀5 min,取上清,经200 目尼龙网过滤2 次,制 成单细胞悬液,以700 mL/L 乙醇4℃固定12 h, 上机前再用PBS 稀释,再次离心去上清,加入PI 染液,4℃避光放置30 min,24 h 内应用流式细胞 仪检测。 1.9 统计学分析
采用SPSS 16.0 统计软件对数据进行统计学比 较分析,计量资料以均数± 标准差(x±s)表示, 多组间比较行单因素方差分析,组间两两比较采 用LSD-t 检验,P<0.05 为差异有统计学意义。 2 结果 2.1 HIBD 大鼠一般情况
缺氧约10 min 后,所有新生大鼠开始烦躁不 安,随即出现全身发绀,呼吸加深加快,进而站 立不稳,爬行时左后肢呈拖步;缺氧时间达30 min 以上后,活动明显减少;1 h 后出现嗜睡及激惹。 2.2 脑组织病理改变
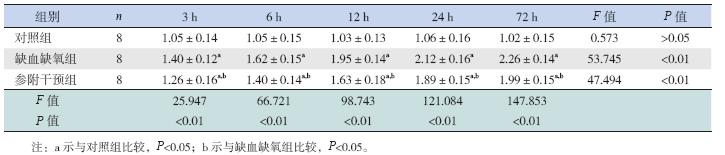
缺氧缺血72 h 时间点脑组织切片经HE 染色 后行光学显微镜下观察发现:对照组脑组织结构 及细胞层次清晰,神经细胞排列整齐紧密,形态 正常;缺氧缺血组病变区脑组织细胞间隙增大, 细胞稀疏,水肿明显,表现为细胞体积增大,胞 质疏松、淡染,部分细胞严重水肿,胞质透明如 气球,呈气球样变,并伴有细胞坏死,表现为核 固缩、核碎裂等;参附干预组细胞排列尚规则, 体积稍大,呈轻度水肿改变,见图 1。
 |
图 1 缺氧缺血72 h 各组右侧脑皮质区病理改变(苏木精- 伊红染色,×400)对照组细胞排列紧密,形态正 常;缺氧缺血组细胞排列稀疏,体积增大,胞质淡染,部分透明如气球,伴核固缩、核碎裂等;参附干预组细胞排列尚规则, 体积稍大,呈轻度水肿改变。 |
缺氧缺血组及参附干预组各时间点CRT mRNA 及蛋白的表达水平均较对照组升高 (P<0.05);与缺氧缺血组相比较,参附干预组各 时间点CRT mRNA 及蛋白的表达水平升高更加明 显(P<0.05)。CRT mRNA 表达高峰出现在造模 后12 h,CRT 蛋白表达高峰出现在造模后24 h。 见图 2~3。
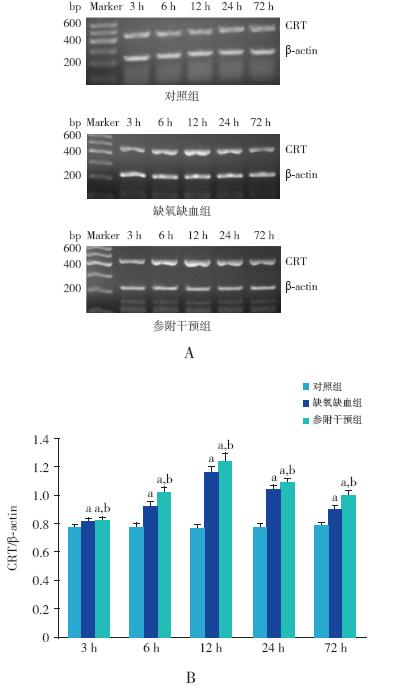 |
图 2 RT-PCR 检测各组不同时间点CRT mRNA 的表达A 为各组不同时间点CRT mRNA 电泳条带图。B 为各组不 同时间点CRT mRNA 表达量的统计柱状图(n=8);a 示与对照组 比较,P<0.05;b 示与缺氧缺血组比较,P<0.05。 |
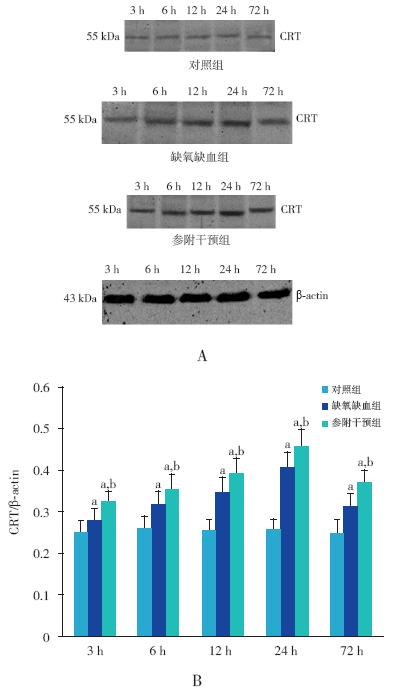 |
图 3 Western blot 检测各组不同时间点CRT 蛋白的表达 A 为各组不同时间点CRT 蛋白条带图。B 为各组不同时 间点CRT 蛋白表达量的统计柱状图(n=8);a 示与对照组比较, P<0.05;b 示与缺氧缺血组比较,P<0.05。 |
缺氧缺血组各时间点脑细胞内游离Ca2+ 浓度 较对照组明显升高(P<0.05),并随着时间推移, 游离Ca2+ 水平升高逐渐明显;予参附注射液干预 后,细胞内游离Ca2+ 浓度较缺氧缺血组明显下降, 但仍高于对照组(P<0.05),且游离Ca2+ 水平随 时间推移逐渐升高。见表 1。
| 表 1 各组不同时间点右侧脑皮层细胞胞浆内游离Ca2+ 浓度的变化 (x±s) |
对照组各时间点脑皮层神经元凋亡率极低; 缺氧缺血组和参附干预组各时间点神经元凋亡率 均较对照组明显升高(P<0.05);而与缺氧缺血组 相比较,参附干预组各时间点的神经元凋亡率则 明显降低,但仍高于对照组(P<0.05);缺氧缺血 组和参附干预组均在缺氧缺血后12 h 神经元凋亡 率最高。见表 2。
| 表 2 各组不同时间点右侧大脑皮层神经元凋亡率比较 (x±s) |
缺氧缺血导致的脑损伤一般分为原发性损伤 (窒息后4~6 h)和更为剧烈持久的继发性损伤(窒 息后6~72 h)两个阶段,因此本研究选择缺氧缺 血后3、6、12、24 以及72 h 作为观察点。无论原 发损伤还是继发损伤都会因能量衰竭造成Na+-K+- ATP 失活,最终均导致大量Ca2+ 内流,造成Ca2+ 超载,从而介导细胞内一系列依赖Ca2+ 的生化 反应,诱导神经元凋亡。CRT 是内质网中主要的 Ca2+ 结合蛋白,通过调节内质网 Ca2+ 贮存而影响 细胞浆游离Ca2+ 水平,并作为内质网分子伴侣参 与蛋白质折叠,具有调节Ca2+ 稳态、蛋白质折叠、 细胞凋亡等多种生物学功能。CRT 能与Ca2+-ATP 酶(sarco endoplasmic reticulurn calcium ATPase, SERCA)糖基化的C- 端末尾直接作用,当内质网 中Ca2+ 耗竭时,两者解离,ATP 酶活化,回收胞 浆内Ca2+;当内质网中Ca2+ 充足时,两者结合, 抑制ATP 酶活性,胞浆内Ca2+ 向内质网转运停 止,提示CRT 可能通过SERCA 来调节Ca2+ 稳态。 目前文献中关于CRT 在缺血缺氧、氧化应激等致 细胞凋亡中的作用尚有争议。有报道认为CRT 参 与了应激细胞的保护:Liu 等 [6] 研究发现,在创伤 后应激障碍大鼠海马中,胞浆内游离Ca2+ 浓度升 高,Ca2+ 平衡失调,CRT 表达升高,参与Ca2+ 超 载与内质网应激的调节,减轻了细胞损伤。在微 波辐射诱导的大鼠心肌微血管内皮细胞损伤模型 中,外源性CRT 可以通过减轻内质网应激反应来 起到保护作用[7]。与上述研究相反,有报道认为 CRT 过表达增加细胞对凋亡刺激的敏感性:Lopez Sambrooks 等[8] 证实了细胞膜上的CRT 增加了细 胞凋亡的敏感性。Shi 等[9] 通过对先兆子癎患者胎 盘的研究发现,CRT 能促进肿瘤细胞的凋亡,抑 制肿瘤细胞的增殖与侵犯。本研究发现,新生大 鼠脑皮层中CRT 的表达在缺氧缺血后3 h 即已明 显增加,其基因表达在缺氧缺血后 12 h 达到高峰, 蛋白在24 h 达到高峰,随后逐渐下降,72 h 仍明 显高于对照组。因此可以推测CRT 相关信号转导 通路在缺氧缺血性脑损伤新生大鼠大脑皮层中被 激活。
参附注射液源于参附汤,是由红参和附片经 提取加工后制成的注射液,其主要成分为人参皂 甙和乌头类生物碱。近年来研究发现参附注射液 具有多种药理作用和神经保护作用,其机制为: 清除氧自由基,抑制脂质过氧化物的产生;抑制 过量Ca2+ 内流,减轻钙超载;降低炎症因子,减 轻炎症反应;上调BCL-2 表达,抑制细胞凋亡等[10]。 李锋等[11] 研究表明参附注射液在低(5 mL/kg)、 中(10 mL/kg)、高(20 mL/kg)不同剂量经腹腔 注射后对SD 大鼠颅脑损伤均有保护作用,且无剂 量效应关系,再结合预实验结果,本研究选择中 等剂量的参附注射液(10 mL/kg)。此次研究结果 显示:与缺氧缺血组相比较,参附干预组脑组织 病理损伤明显减轻,而且皮层区神经元的凋亡率 显著下降,此外,参附干预组各时间点CRT 表达 量均高于缺氧缺血组,胞浆Ca2+ 浓度明显低于缺 氧缺血组,提示参附注射液可能通过上调CRT 的 表达,降低钙超载来减少神经元凋亡,从而起到脑保护作用。
综上所述,本次试验结果显示缺氧缺血后新 生大鼠脑皮层胞浆内Ca2+ 浓度上升,CRT 表达增加, 表明缺氧缺血造成了细胞内钙超载,并且激活了 Ca2+ 相关蛋白CRT。用参附注射液干预后CRT 表 达升高更加明显,同时胞浆内Ca2+ 浓度明显下降, 而大脑皮层神经元凋亡率下降,脑组织病理损伤 减轻,因此推测参附注射液可能通过上调CRT 的 表达、降低Ca2+ 超载来发挥神经保护作用。当然, 参附注射液是否还存在其他神经保护机制? CRT 是否通过SERCA 来减轻钙超载?这些问题需要进 一步研究。
| [1] | 王卫平. 儿科学[M]. 第8 版. 北京: 人民卫生出版社, 2013: 107-108. |
| [2] | Cao G, Xing J, Xiao X, et al. Critical role of calpain I in mitochondrial release of apoptosis-inducing factor in ischemic neuronal injury[J]. J Neurosci, 2007, 27(35): 9278-9293. |
| [3] | 史伟, 张良登, 宋玉明, 等. 参附注射液在脑血管疾病方面 的临床应用与实验研究进展[J]. 中国中医药信息杂志, 2009, 16(1): 109-111. |
| [4] | 王军, 杨丽娟, 何艳芳, 等. 参附注射液对缺氧缺血性脑损 伤新生大鼠海马神经元凋亡影响[J]. 实用儿科临床杂志, 2007, 22(21): 1658-1659. |
| [5] | Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9(2): 131-141. |
| [6] | Liu H, Han F, Shi Y. Effect of calreticulin on Ca2+/CaM kinase II alpha and endoplasmic reticulum stress in hippocampal in a rat model of post-traumatic stress disorder[J]. Neurochem Res, 2013, 38(7): 1407-1414. |
| [7] | Li WH, Li YZ, Song DD, et al. Calreticulin protects rat microvascular endothelial cells against microwave radiationinduced injury by attenuating endoplasmic reticulum stress[J]. Microcirculation, 2014, 21(6): 506-515. |
| [8] | Lopez Sambrooks C, Carpio MA, Hallak ME. Arginylated calreticulin at plasma membrane increases susceptibility of cells to apoptosis[J]. J Biol Chem, 2012, 287(26): 22043-22054. |
| [9] | Shi Z, Hou W, Hua X, et al. Overexpression of calreticulin in pre-eclamptic placentas: effect on apoptosis, cell invasion and severity of pre-eclampsia[J]. Cell Biochem Biophys, 2012, 63(2): 183-189. |
| [10] | 徐军, 楼洪刚, 楼宜嘉, 等. 参附注射液药理作用的研究进 展[J]. 上海中医药杂志, 2008, 42(10): 87-88. |
| [11] | 李峰, 钟宏, 陈喜志, 等. 参附注射液对颅脑损伤的脑保护 作用[J]. 中医药临床杂志, 2006, 18(5): 455-456. |
 2015, Vol. 17
2015, Vol. 17