金黄色葡萄球菌(简称金葡菌)是人类的常见定植(寄生)菌和主要致病菌之一,随着耐甲氧西林金葡菌(MRSA)的出现,对金葡菌的有效控制显得尤其重要。成年人中,约80%的金葡菌感染与内源性定植有关[1],而鼻部定植是金葡菌感染的潜在危险因素之一[2, 3]。目前,还没有关于中国大陆地区儿童金葡菌鼻部携带与金葡菌感染之间关系的研究。本研究以我院金葡菌感染住院患儿为研究对象,初步了解金葡菌感染患儿鼻部金葡菌携带情况,进一步明确本地区儿童金葡菌鼻部携带与金葡菌感染之间的关系。
1 资料与方法 1.1 研究对象采用横断面调查的方法,收集2013年10月至2014年4月在四川大学华西第二医院儿科住院期间临床标本(包括痰液、全血、脓液和局部分泌物等)培养确诊为金葡菌感染的患儿资料。本研究的纳入标准为:临床标本培养确诊为金葡菌感染的患儿;同意参加此次研究者,配合并完整填写受试者知情同意书;年龄0~18岁;汉族儿童。
本研究经四川大学华西第二医院医学伦理委员会批准。
1.2 菌株的采集鼻部携带菌株:如果患儿的临床标本培养为金葡菌,则在临床标本培养结果出来后的3 d之内,采集患儿的鼻拭子标本(此鼻拭子含有培养基,可保存48 h左右)。用鼻拭子中的无菌棉签擦拭患儿鼻前庭部分泌物,无分泌物者用棉签蘸取无菌生理盐水擦拭患儿鼻前庭,进行细菌培养。尽快将棉签转种于7.5%氯化钠肉汤中,35℃培养箱内孵育24 h后,转种到甘露醇盐平板中。将甘露醇盐平板放在35℃培养箱内孵育24 h后,拿出平板观察上面是否有黄色的菌落,挑选出培养基中长出的黄色的圆形独立菌落,将菌落接种于BAP血平板上,再次放在35℃培养箱内孵育24 h,观察平板上是否有β溶血现象,将有溶血环的独立菌落挑出,进行乳胶凝集鉴定试验。若出现凝集块现象,则可鉴定为金葡菌。将菌落保存于已灭菌的20%脱脂牛奶中,置于-70℃冰箱保存待用。
感染菌株:如果患儿的鼻拭子培养为阳性,则将该患儿的金葡菌感染株培养于血培养平板中,24 h后,将平板上的单个菌落保存于已灭菌的20%脱脂牛奶中,置于-70℃冰箱保存待用。此处应注意:将患儿鼻拭子和临床标本分别培养所得的金葡菌进行一一对应,确保二者的编号一一对应。
1.3 临床资料的收集临床资料包括:姓名、性别、年龄、体重、近1年住院史、药物和食物过敏史、近期与动物接触史、家庭成员住院史、家庭成员吸烟史、儿童半年内抗生素使用情况、标本来源、药敏试验结果、临床诊断、临床治疗情况、治疗结局等。
1.4 菌株的mecA耐药基因和PVL毒力基因的检测采用PCR方法检测感染菌株和鼻部携带菌株的mecA耐药基因和PVL毒力基因。使用基因细菌组DNA提取试剂盒(北京天根生化科技有限公司)提取临床菌株和鼻部菌株的DNA。使用韩国BIONEER PCR纯化试剂盒进行DNA扩增,扩增产物在琼脂糖凝胶(含0.5 μg/mL 溴化乙啶) 110 V 电压下电泳约30 min,全自动凝胶图像分析系统显像观察并拍照。
(1)mecA引物基因序列 P4:5'-TCCAGATTACAACTTCACCAGG-3';P7:5'-CCACTTCATATCTTGTAACG-3'。扩增条件为:95℃ 5 min预变性,95℃ 1 min、52℃ 30 s、72℃ 1 min扩增35个循环,72℃ 延伸5 min。
(2)PVL引物基因序列 luk-pv1:5'-ATCATTAGGTAAAATGTCTGGACATGATCCA-3';luk-pv2:5'-GCATCAACTGTATTGGATAGCAAAAGC-3'。扩增条件为:95℃ 5 min预变性,94℃ 1 min、56℃ 30 s、72℃ 1 min、扩增35个循环,72℃延伸5 min。
1.5 统计学分析采用SPSS 13.0统计软件对数据进行统计学分析,计数资料用例数和构成比表示,组间比较采用卡方检验。P<0.05表示差异有统计学意义。
2 结果 2.1 一般情况共纳入了56名金葡菌感染住院患儿。其中鼻拭子培养出金葡菌的患儿有22名,金葡菌感染患儿的鼻部携带率为39% 。
22例患儿中,男16例,女6例。年龄最小的为1 d 8 h,最大为12岁3个月,以1岁以内的婴儿为主(18例)。各年龄组间金葡菌携带率差异无统计学意义(χ2=3.447,P=0.328),见表 1。
| 表 1 鼻部菌株携带者和非携带者的年龄分布 |
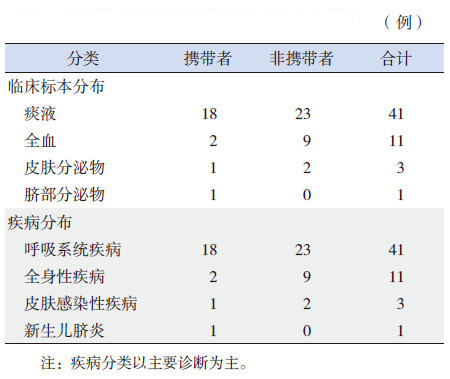
临床标本主要来自痰液,其次还包括全血、皮肤分泌物和脐部分泌物。56例金葡菌感染患儿疾病分布分别为:呼吸系统疾病(支气管肺炎、新生儿肺炎和呼吸衰竭)、全身性疾病(败血症、脓毒症和多器官功能衰竭)、皮肤感染性疾病(葡萄球菌性烫伤样皮肤综合征)、新生儿脐炎。金葡菌携带者和非携带者临床标本和疾病分布见表 2。
| 表 2 携带者和非携带者临床标本和疾病分布 |
22例鼻部金葡菌携带患儿中,11例(50%)患儿既往1年内有住院史,其中9例(41%)患儿此次患病曾经在其他医院就诊过,4例(18%)患儿半年内曾用过抗生素,无患儿有近期与动物的密切接触史。
56例金葡菌感染住院患儿中,MRSA分离率为29%(16/56),多重耐药(对3类或3类以上的抗生素耐药)菌株的分离率为66%(37/56)。其中,22例鼻部携带患儿的MRSA分离率为32%(7/22,且7株MRSA均为多重耐药),多重耐药菌株的分离率为68%(15/22)。56株感染株中,53株对青霉素耐药,37株对克林霉素耐药,37株对红霉素耐药,耐药率分别为95%、66%、66%。未发现对利奈唑胺和万古霉素耐药菌株。
2.2 抗生素使用情况及转归22例鼻部金葡菌携带患儿中,4例患儿于临床药敏试验结果报告后换用抗生素。34名非携带患儿中,3例患儿换用抗生素。携带者和非携带者的抗生素使用情况见表 3。
| 表 3 携带者和非携带者的抗生素使用情况 |
56例患儿中,22例鼻部金葡菌携带患儿治疗结果均为好转;34例非携带患儿中,有2例患儿死亡,临床诊断分别为葡萄球菌性烫伤样皮肤综合征和严重脓毒症、多器官功能衰竭(呼吸、肝脏、循环)和声门下梗阻,其临床菌株的药敏结果均为MRSA,且为多重耐药。
2.3 临床感染菌株的mecA基因和PVL基因结果对22例鼻部金葡菌携带患儿中,临床感染菌株mecA基因检测阳性者7例,均为临床药敏试验结果为MRSA的菌株;PVL基因检测阳性者7例,其中包括4例MRSA,3例MSSA。
2.4 鼻部携带菌株的mecA基因和PVL基因结果22例鼻部金葡菌携带患儿的鼻部携带菌株mecA基因检测阳性者也为7例,恰恰可以与临床药敏试验结果为MRSA的感染株编号一一对应;PVL基因检测为阳性者5例,其中4例PVL阳性鼻部携带菌株与4例PVL阳性MRSA感染菌株编号一一对应,且此4例均为MRSA菌株。
3 讨论本研究发现,金葡菌感染住院患儿的金葡菌鼻部携带率为39%,虽明显低于成年人的80%[1],但与我们研究团队之前针对健康儿童研究所得的金葡菌鼻部携带率(18.4%)[4]相比,金葡菌感染患儿的鼻部携带率远高于健康儿童的鼻部携带率,可见鼻部携带确实是患儿发生金葡菌感染的一大危险因素。携带了金葡菌菌株的鼻前庭,对宿主自身来讲,可能是作为金葡菌感染的一个内部存储部位;对其他人而言,可能是传播给他人的传染源。儿童的易感性和活动范围大等特性,也决定了儿童可能是促成金葡菌在家庭中和社区内传播的重要来源和媒介[5]。有研究表明,清除鼻腔的金葡菌定植,可以减少金葡菌感染的发生[6, 7]。
既往1年内有住院史的鼻部金葡菌携带儿童所占比例高达50%,表明既往住院史与金葡菌的鼻部携带有一定相关性,既往住院增加了金葡菌鼻部携带的风险,医院内传播可能是金葡菌定植的重要途径。患儿住院时,可能发生鼻部定植金葡菌,鼻部作为一个内部存储部位,处于长期携带状态,成为下次金葡菌感染的潜在危险。由此可见,医院内传播是导致鼻部长期携带,最终导致金葡菌感染的重要潜在危险。本研究纳入的患儿既往使用抗生素和密切接触动物的概率均不是很高,这可能与患儿总体集中在婴儿时期,为刚出生不久的患儿,以及来院治疗的患儿大多为成都周边居民、家庭环境较好有关。
我们研究团队8年前对成都地区金葡菌感染的儿童进行的一项研究结果显示:金葡菌感染患儿的MRSA分离率为19.6%(10/51),多重耐药率为52.9%,青霉素、红霉素、克林霉素的耐药率分别为98%、86.3%、45.1%[8]。本次研究中,56株金葡菌感染株的MRSA分离率为29%,多重耐药菌株的分离率高达66%,青霉素耐药率依然很高(95%),克林霉素和红霉素耐药率也不低,均为66%。上述结果表明:成都地区儿童金葡菌感染者的MRSA分离率较前几年明显增加,形势不容乐观,需引起高度重视。金葡菌感染住院患儿,导致抗生素的联用非常普遍,多重耐药形势越发严峻,不容小视。虽我院尚未发现对利奈唑胺和万古霉素耐药的金葡菌菌株,但是对这两种药物的使用仍要保持理智的态度,谨防此类耐药菌株的产生。
PCR检测结果发现,鼻部金葡菌携带患儿的临床感染菌株和鼻部携带菌株mecA阳性结果完全一致,可一一对应;90%(4/5)的PVL阳性鼻部携带菌株可以与临床感染菌株一一对应,且均为MRSA菌株。由此可以推测:金葡菌感染患儿的感染株可能与患儿的鼻部携带菌株具有同源关系;PVL阳性的MRSA可能更容易定植于鼻部;是否毒力强的菌株更易于定植,还有待进一步证实。
综上,鼻部定植是金葡菌感染的潜在危险因素。医院内传播是导致鼻部携带,最终导致金葡菌感染的重要潜在危险。成都地区金葡菌感染住院患儿的MRSA分离率较前几年明显增加,需要高度警惕。鼻部携带菌株与感染菌株可能具有同源关系,需要进一步通过多位点序列分型来明确,以证实是否进行常规鼻拭子检查,预先清除鼻部金葡菌携带,可以减少金葡菌感染的发生。
| [1] | Werttheim HF, Vos MC, Ott A, et al. Risk and outcome of nosocomial Staphylococcus aureus bacteraemia in nasal carriers versus non-carriers [J]. Lancet, 2004, 364(9435): 703-705. |
| [2] | Wertheim HF, Melles DC, Vos MC, et al. The role of nasal carriage in Staphylococcus aureus infections[J]. Lancet Infect Dis, 2005, 5(12): 751-762. |
| [3] | Honda H, Krauss MJ, Coopersmith CM, et al. Staphylococcus aureus nasal colonization and subsequent infection in intensive care unit patients: does methicillin resistance matter?[J]. Infect Control Hosp Epidemiol, 2010, 31(6): 584-591. |
| [4] | 范娟, 周伟, 舒敏, 等. 成都地区健康儿童鼻腔社区获得性耐甲氧西林金黄色葡萄球菌的携带研究[J]. 中国当代儿科杂志, 2011, 13(1): 16-19. |
| [5] | Davis MF, Iverson S, Baron P, et al. Household transmission of meticillin-resistant Staphylococcus aureus and other staphylococci[J]. Lancet Infect Dis, 2012,12(9): 703-716. |
| [6] | Aslam N, Izhar M, Mehdi N. Frequency of methicillin-resistant Staphylococcus aureus nasal colonization among patients suffering from methicillin resistant Staphylococcus aureus bacteraemia[J]. Pak J Med Sci, 2013, 29(6): 1430-1432. |
| [7] | Kluytmans J. Reduction of surgical site infections in major surgery by elimination of nasal carriage of Staphylococcus aureus[J]. J Hosp Infect, 1998, 40(Suppl B): S25-S29. |
| [8] | 邓建军, 万朝敏, 母得志, 等. 成都地区儿童金黄色葡萄球菌定植/感染分离株的流行病学研究[J]. 临床儿科杂志, 2012, 30(6): 507-511. |
 2015, Vol. 17
2015, Vol. 17