2. 滨州医学院附属医院临床医学实验中心, 山东 滨州 256603;
3. 滨州市人民医院呼吸科, 山东 滨州 256610
肺炎支原体(Mycoplasma pneumoniae, MP)是儿童呼吸道感染的常见病原体,以下呼吸道感染最为常见。肺炎支原体肺炎(Mycoplasma pneumoniae pneumonia, MPP)作为儿科最常见的非典型肺炎,近年发病率呈逐年上升趋势,除呼吸系统受累外,还可引起多系统损害,而且重症病例逐渐增多,严重时甚至引起死亡,已引起广泛关注[1]。随着对MP感染发病机制的深入研究,现已证实免疫学机制在其发生发展中起重要作用。辅助性T细胞9(Th9)是新近发现的一种辅助性T细胞新亚群,以分泌细胞因子白细胞介素-9(IL-9)为典型特征,具有重要的免疫调节作用,在自身免疫性疾病中受到广泛关注[2]。本文通过检测MP感染患儿外周血Th9细胞及其细胞因子IL-9的水平,探讨两者在MP感染患儿中的作用。
1 资料与方法 1.1 研究对象根据纳入及排除标准,选取2013年1月至2014年6月于滨州医学院附属医院儿科诊断为MP感染的86例急性期患儿(病程10 d以内)为研究对象,分为上呼吸道感染(upper respiratory infection, URI)组和MPP组,MPP组进一步分为轻症组和重症组。URI组患儿29例,其中男14例,女15例,年龄3.2~13岁,平均年龄8.2±3.4岁;轻症MPP组患儿32例,其中男15例,女17例,年龄2.5~13岁,平均年龄7.8±3.7岁;重症MPP组患儿25例,其中男13例,女12例,年龄3.5~13岁,平均年龄8.5±3.3岁。另选取28例同期于我院儿保门诊行健康体检儿童为健康对照组,其中男13例,女15例,年龄2.6~13岁,平均年龄7.9±3.9岁。4组儿童在性别、年龄方面比较差异无统计学意义,具有可比性。本研究获得我院医学伦理委员会批准,并取得患儿监护人知情同意。
1.2 纳入和排除标准(1)URI组纳入标准:①依据第7版《诸福棠实用儿科学》[3],血清特异性抗体MP-IgM阳性;②仅有上呼吸道感染的症状及体征;③肺部X线检查无下呼吸道感染表现。
(2)MPP组纳入标准:符合MPP诊断标准[3],其中轻症MPP组不具备以下任何1条,重症MPP组还应具备以下至少1条[4]:①症状重,病情进展快,肺大叶实变,单用大环内酯类抗生素治疗效果不佳;②肺大叶实变伴中至大量胸腔积液;③影响呼吸功能或合并其他系统功能障碍;④合并闭塞性支气管炎或者坏死性肺炎;⑤病程超过6周肺部病变仍迁延不愈。
(3)排除标准:①2个月内有任何其他病原体感染者;②就诊前应用过大环内酯类抗生素治疗者;③2个月内应用激素、免疫球蛋白等免疫抑制剂或调节剂者;④有支气管哮喘等免疫性疾病者或本次MP感染诱发的支气管哮喘发作者;⑤有先天性免疫缺陷病及其他慢性病史者;⑥有家族性过敏史者。
1.3 主要试剂淋巴细胞分离液(Ficoll)购自上海朗顿生物科技有限公司;PC5标记的抗人CD4单克隆抗体(mAb)、PE标记的抗人IL-9 mAb及匹配的同型对照mAb均购自美国BD公司;鼠抗人CD3、CD28 mAb购自美国BD-PharMingen公司;固定剂与破膜剂购自美国Beckman-coulter公司;RPMI-1640和胎牛血清购自HyClone公司;人IL-9 ELISA试剂盒购自美国BD公司。
1.4 外周血Th9细胞及血清IL-9水平的检测采集各组儿童空腹静脉血6 mL,分别置于抗凝管及非抗凝管中。
采用Ficoll密度梯度离心法分离抗凝血中外周血单个核细胞(PBMC),并用PBS充分洗涤。显微镜下观察细胞形态并计数,用含10%胎牛血清的RPMI-1640培养液重悬细胞,调整细胞密度为5×106/mL,分别加入鼠抗人CD3、CD28 mAb,使其终浓度分别为0.2 mg/L、1 mg/L,置于37℃、5%CO2培养箱中培养5 h,收集细胞用PBS洗涤2次。将PBMC进行荧光标记抗体的表面染色,同型对照管和实验管各取100 μL细胞悬液(细胞1×106个),然后各加入CD4-PC5荧光mAb 20 μL混匀,于4℃避光孵育30 min。洗涤、去上清,加入100 μL固定剂混匀,室温避光反应20 min,然后加入破膜剂100 μL混匀,室温避光放置5 min,实验管中加入抗人IL-9-PE mAb 20 μL,同型对照管中加入同型对照抗体20 μL,混匀后于4℃避光反应30 min。孵育结束后,加入PBS 3 mL洗涤2次,去上清,每管加入0.5 mL 1%的多聚甲醛固定液固定后上机检测。首先设门于淋巴细胞,再以CD4+T细胞设门,以散点图表示CD4+T细胞中IL-9+T细胞的百分率。
非抗凝血以3 000 rpm离心10 min分离血清,采用ELISA法,严格按照试剂盒说明书检测血清中细胞因子IL-9的表达水平。
1.5 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析。检测结果采用均数±标准差( x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果 2.1 各组外周血中Th9细胞的百分率URI组、轻症MPP组、重症MPP组患儿外周血Th9细胞百分率均显著高于对照组(P<0.05),且病例组间两两比较差异均有统计学意义(P<0.05),见表 1,图 1。
| 表 1 各组外周血Th9 细胞百分率及细胞因子IL-9 的浓度比较 |
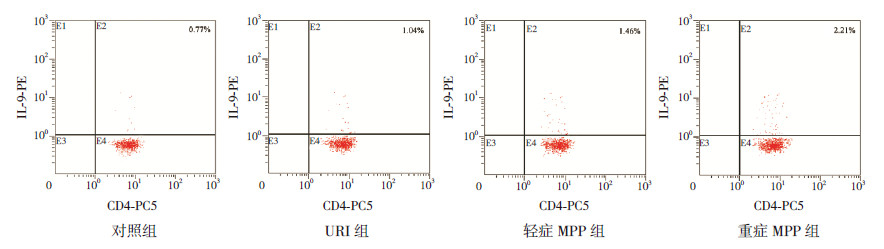 |
图 1 流式细胞术检测各组外周血Th9 细胞百分率 E2 象限示Th9 细胞百分率。 |
URI组、轻症MPP组、重症MPP组患儿血清IL-9水平均显著高于对照组(P<0.05),且病例组间两两比较差异均有统计学意义(P<0.05),见表 1。
3 讨论近年来,儿童MP感染有逐渐增多的趋势,并且发病年龄明显前移。MP感染不仅可以造成严重的肺部损伤,而且可并发多器官、系统的损害,研究报道MP感染肺外脏器受累可高达45%,特别多见于中枢神经系统及循环系统[5]。迄今为止,MP感染的发病机制尚不清楚,目前大多数研究认为免疫学机制在其发病中起重要作用,并且体液免疫和细胞免疫共同参与了其发病过程。国外研究发现MP抗原分子能刺激Th0细胞活化,分化为Th1、Th2、Th17及Treg细胞,合成和分泌多种细胞因子,包括促炎症细胞因子IFN-γ、TNF-α、IL-1、IL-6等和抗炎细胞因子TGF-β、IL-10等[6];近年我国学者研究表明MP感染的儿童存在Th1/Th2、Th17/Treg细胞的免疫失衡,并伴有IFN-γ、IL-4、IL-17等相应细胞因子水平的紊乱,表明辅助性T细胞亚群及其细胞因子在MP感染的发病机制中起非常重要的作用[7, 8]。
Th9细胞是辅助性T细胞系中的新亚群,以分泌细胞因子IL-9为典型特征,由Th0细胞在IL-4和TGF-β的特殊刺激下共同诱导产生或由TGF-β作用于Th2细胞亚群分化而来[2, 9]。不同于已知的Th1、Th2、Th17和Treg细胞亚群,Th9细胞的特异性转录因子是PU.1,从而在基因水平上也提示Th9细胞与其他辅助性T细胞亚群不同[2, 10]。研究发现Th9细胞与自身免疫疾病密切相关,主要作用是促使炎症细胞数量上升并分泌相关炎症介质,从而促进炎症的发生发展[2, 9]。IL-9作为人类Th9细胞的效应分子,是一种多效能的细胞因子,主要通过肥大细胞发挥生物学效应,介导JAK/STAT信号通路,是参与免疫应答和免疫调节的重要细胞因子,在自身免疫性疾病中的作用受到广泛关注[2, 11]。目前,Th9细胞及细胞因子IL-9是否参与了MP感染的发病在国内外尚未见报道。本研究通过检测Th9细胞及IL-9在MP感染患儿外周血中的表达情况,探讨其在儿童MP感染中可能的作用。
本研究结果显示,各组MP感染患儿外周血Th9细胞百分率及其细胞因子IL-9水平均高于健康对照组,轻重症MPP组均高于URI组,而且重症MPP组明显高于轻症MPP组,提示Th9细胞及其细胞因子IL-9在MP感染患儿中的表达升高,并随病变的加重而增加。Xing等[12]研究发现过敏性哮喘患者体内Th9细胞表达率明显高于正常对照组,并提出Th9细胞可以作用于炎症细胞和组织细胞,使肥大细胞、嗜酸性粒细胞及淋巴细胞的数量增多,促进IgE及细胞因子分泌并参与炎症反应,推测Th9细胞在过敏性哮喘等各种自身免疫病发生发展的过程中起着主要角色。另有研究表明哮喘患者体内IL-9的水平与病情严重程度呈正相关性,推测IL-9的水平可作为自身免疫病活动的标志[13]。另外,在过敏性鼻炎、类风湿性关节炎、系统性红斑狼疮、系统性硬化症等免疫性疾病中,Th9细胞及IL-9的表达亦显著升高,而且与病情活动度呈正相关[14, 15, 16],这些均与本研究结果一致。据此推测Th9细胞可能作为一种重要的效应性T细胞,与其细胞因子IL-9共同促进了MP炎症的发生发展,并可能成为判断MP感染病情轻重的重要指标。此外,国外一项临床随机对照试验研究表明,IL-9单克隆抗体可通过中和异常增高的IL-9而发挥抗哮喘的作用[17]。所以我们猜测,可以通过调节Th9及IL-9的表达来协助治疗重症MP感染的患儿。
综上所述,Th9细胞及其细胞因子IL-9在MP感染患儿外周血中的表达均高于健康儿童,并随病变的加重而增加。据此推测Th9细胞及IL-9的异常高表达可能参与了儿童MP感染的发病,并可作为MP感染患儿病情发展、转归的评价指标。
| [1] | Cao B, Ren LL, Zhao F, et al. Viral and Mycoplasma pneumonia community-acquired pneumonia and novel clinical outcome evaluation in ambulatory adult patients in China[J]. Eur J Clin Microbiol Infect Dis, 2010, 29(11): 1443-1448. |
| [2] | Veldhoen M, Uyttenhove C, Van Snick J, et al. Transforming growth factor-beta ‘reprograms' the differentiation of T helper 2 cells and promotes an interleukin 9-producing subset[J]. Nat Immunol, 2008, 9(12): 1341-1346. |
| [3] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7 版. 北京: 人民卫生出版社, 2003: 1204-1205. |
| [4] | 齐建光, 张韶杰, 陈永红, 等. 儿童重症支原体肺炎的临床特征和治疗探讨[J]. 中国当代儿科杂志, 2008, 10(6): 719- 722. |
| [5] | Bae JW, Kim HJ, Chang GY, et al. Combined striatum, brain stem, and optic nerve involvement due to Mycoplasma pneumoniae in an ambulatory child[J]. Case Rep Neurol, 2011, 3(2): 109-112. |
| [6] | Yang J, Hooper WC, Phillips DJ, et al. Cytokines in Mycoplasma pneumoniae infections[J]. Cytokine Growth Factor Rev, 2004, 15(2-3): 157-168. |
| [7] | 潘薇, 许忠, 郑百红. 肺炎支原体肺炎患儿急性期外周血 IFN-γ、IL-4 的变化[J]. 中国当代儿科杂志, 2006, 8(5): 373- 375. |
| [8] | 宋磊, 赵小冬, 张瑜, 等. 儿童肺炎支原体感染者血Th17/Treg 的变化分析与临床意义[J]. 中国血液流变学杂志, 2011, 21(4): 699-702. |
| [9] | Dardalhon V, Awasthi A, Kwon H, et al. IL-4 inhibits TGF-betainduced Foxp3+ T cells and, together with TGF-beta, generates IL-9+ IL-10+ Foxp3(-) effector T cells[J]. Nat Immunol, 2008, 9(12): 1347-1355. |
| [10] | Li Z, Zhang Y, Sun B. Current understanding of Th2 cell differentiation and function[J]. Protein Cell, 2011, 2(8): 604- 611. |
| [11] | Wiener Z, Falus A, Toth S. IL-9 increases the expression of several cytokines in activated mast cells, while the IL-9-induced IL-9 production is inhibited in mast cells of histamine-free transgenic mice[J]. Cytokine, 2004, 26(3): 122-130. |
| [12] | Xing J, Wu Y, Ni B. Th9: a new player in asthma pathogenesis?[J]. J Asthma, 2011, 48(2): 115-125. |
| [13] | Ciprandi G, De Amici M, Marseglia GL. Serum IL-9 levels and sublingual immunotherapy: preliminary report[J]. J Biol Regul Homeost Agents, 2011, 25(2): 295-297. |
| [14] | Devos S, Cormont F, Vrtala S, et al. Allergen-induced interleukin-9 production in vitro: correlation with atopy in human adults and comparison with interleukin-5 and interleukin- 13[J]. Clin Exp Allergy, 2006, 36(2): 174-182. |
| [15] | 崔冉, 徐建华. 类风湿关节炎患者外周血辅助性T 细胞9 及白细胞介素-9 的变化及临床意义[J]. 中华风湿病性杂志, 2012, 16(7): 442-445. |
| [16] | Yanaba K, Yoshizaki A, Asano Y, et al. Serum interleukin 9 levels are increased in patients with systemic sclerosis: association with lower frequency and severity of pulmonary fibrosis[J]. J Rheumatol, 2011, 38(10): 2193-2197. |
| [17] | Parker JM, Oh CK, LaForce C, et al. Safety profile and clinical activity of multiple subcutaneous doses of MEDI-528, a humanized anti-interleukin-9 monoclonal antibody, in two randomized phase 2a studies in subjects with asthma[J]. BMC Pulm Med, 2011, 11: 14. |
 2015, Vol. 17
2015, Vol. 17