喘息是婴幼儿时期常见的呼吸道症状。文献报道,至少超过1/3的婴幼儿在3岁前曾患喘息性疾病[1, 2],且近年逐渐呈上升趋势,严重危害患儿的身心健康,也给家庭及社会带来较大的负担。目前对婴幼儿反复喘息发生的机制及预后尚未完全清楚,但病毒感染及免疫学异常在该症状发生方面的作用越来越受到国内外学者的关注。髓源性抑制细胞(myeliod-derived suppressor cell, MDSC)是上世纪80年代从肿瘤患者体内发现的一群异质性细胞群,来源于骨髓祖细胞及未成熟髓细胞,是树突细胞、巨噬细胞和(或)粒细胞前体,具有强大的免疫调节功能[3, 4]。近年来随着研究的不断深入,发现MDSC不仅在肿瘤发生发展中起重要作用,而且在病毒感染、脓毒血症、自身免疫系统疾病等病理状态下亦有MDSC的高表达[5, 6]。国内外有研究表明MDSC在肺部炎症、肺部过敏性炎症中高表达,且参与哮喘肺部炎症、气道高反应及气道重塑的发生[7, 8]。Th17细胞是2005年发现的一类新的CD4+ T细胞亚群,研究表明Th17细胞在哮喘、毛细支气管炎等喘息性疾病中发挥着重要作用,且与它们的严重程度密切相关[9]。Th17细胞及MDSC在以哮喘为代表的喘息性疾病中发挥着重要作用,目前MDSC与婴幼儿反复喘息之间的关系的报道很少,MDSC与Th17在该类疾病中的关系更尚未见报道。本研究主要通过检测反复喘息患儿外周血中的MDSC及Th17细胞所占百分比及它们间的相关关系,探究二者在婴幼儿反复喘息发生发展中的可能作用。
1 资料与方法 1.1 研究对象随机选取2013年10月至2014年4月在我院儿科住院的30例反复喘息的婴幼儿作为研究对象,其中男16 例,女 14例,年龄4个月至3岁,平均年龄1岁4个月。均为疾病急性发作期,肺部听诊闻及明显哮鸣音。患儿在过去的12个月内至少有2次或2次以上喘息史,并排除先天性发育畸形、支气管异物吸入、气管结核、纵隔占位等可能引起喘息的原因。
选取同时期及同年龄段在我院门诊及病房就诊的支气管肺炎患儿20例作为肺炎组,其中男 9例,女11 例,年龄5个月至3岁,平均年龄1岁5个月,均符合第七版《诸福棠实用儿科学》支气管肺炎的诊断标准[10]。另选取同时期及同年龄段在我院外科住院的疝气、肾结石等非感染性、非肿瘤性疾病术前患儿23例作为对照组,其中男10例,女13例,年龄3个月至3岁,平均年龄1岁7个月。
入选的3组患儿均为足月出生,病前2周内无感染病史、无激素及免疫抑制剂使用史,各组年龄、性别构成比比较差异均无统计学意义(P>0.05)。此研究获得江苏大学附属医院伦理委员会批准,并征得相关监护人的知情同意。
1.2 主要试剂及实验仪器荧光标记的抗体:CD4-FITC、IL-17-PE、CD14-PEcy5、HLA-DR-FITC、CD11b-APC、CD33-PE(eBioscience, San Diego, CA, USA)。1640胎牛血清、PBS缓冲液、Hank液、RPMI-1640、淋巴细胞分离液、固定破膜剂等。FCM Calibur型流式细胞仪购自美国BD公司。
1.3 MDSC膜表面标记染色MDSC在外周血中的表达用CD14-HLA-DR-CD33+CD11b+表示。取100 μL抗凝血加入流式管,将荧光抗体从冰箱中取出,放入准备好的冰盒中,避光条件下在相应的试管加入单克隆抗体CD14-PEcP、HLA-DR-FITC、CD11b-APC、CD33-PE各2 μL,避光反应15 min,15 min后各流式管加入1 mL的溶血剂,充分混匀,避光反应10 min后加入配好的PBS混匀,2 000 prm/min,弃上清。重复一次,加入200 μL的PBS混匀,用流式细胞式细胞仪检测。同型对照管加入同型对照抗体,调节电压和荧光补偿,防止非特异染色。
1.4 PBMC的提取及Th17细胞的检测用肝素抗凝管收集各组患儿空腹静脉血3 mL,1 mL静脉血用于MDSC的检测,2 mL用于Th17的检测。2 mL静脉血以PBS 1 : 1稀释混匀,沿管壁轻缓移入放有等体积的人淋巴细胞分离液离心管中,1 500 prm/min,离心15 min,离心半径为10 cm,吸取分层液的云雾层,PBS洗涤,用RPMI-1640培养液(含10%胎牛血清)调整细胞悬液浓度为2×106/mL PBMC 1 mL加入培养板中,加2 μL PMA(50 μg/ μL),1 μL Ionomycin(100 ng/μL)置于37℃和5% CO2条件下刺激培养5 h。同型对照管及试验管各取1×106/mL PBMC,分别加入CD4-FITC 10 μL,避光孵育40 min,洗涤上清,多聚甲醛固定后,室温孵育30 min,加入破膜剂15 min,离心去上清。加入IL-17-PE 15 μL于试验管中,于同型对照管加入相应的对照抗体,室温避光孵育15 min,用PBS洗涤,1 500 prm/min,15 min,弃上清,加入200 μL的PBS混匀,用流式细胞式细胞仪检测。
1.5 统计学分析采用SPSS 16.0统计软件进行统计学分析,用GraphPadPrism 5.01做统计图。正态分布计量资料以均数±标准差( x±s)表示。非正态分布计量资料用P50(P25,P75)表示,多组间比较采用Kruskal-Wallis检验,组间两两比较采用Dunney检验。外周血MDSC与Th17细胞比例的相关性采用Spearman相关分析。P<0.05为差异有统计学意义。
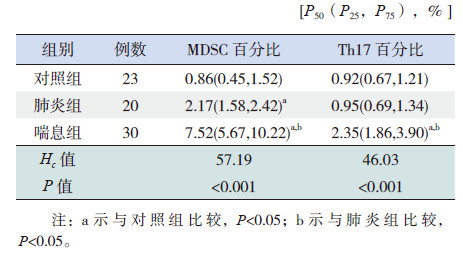
2 结果 2.1 各组外周血中MDSC占有核细胞的百分比各组患儿外周血中MDSC占有核细胞的百分比的差异有统计学意义(Hc=57.19,P<0.001),其中喘息组患儿MDSC占有核细胞的百分比明显高于肺炎组和对照组,肺炎组高于对照组(P<0.05),见表 1和图 1。
| 表 1 各组患儿MDSC 细胞及Th17 细胞所占比例的比较 |
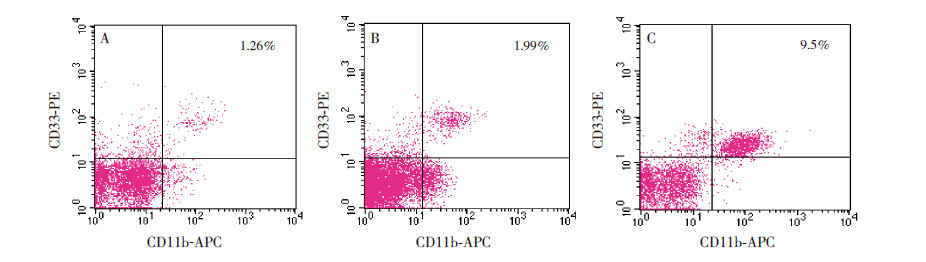 |
图 1 MDSC 占有核细胞比例的流式细胞术检测结果 A 为对照组,B 为肺炎组,C 为喘息组。右上象限为CD14-HLA-DR-CD33+CD11b+ 细胞群,即MDSC。 |
各组患儿外周血中Th17细胞占单个核细胞的百分比差异有统计学意义(Hc=46.03,P<0.001),其中喘息组Th17细胞占单个核细胞的百分比明显高于肺炎组及对照组,肺炎组与对照组Th17比较差异无统计学意义,见表 1和图 2。
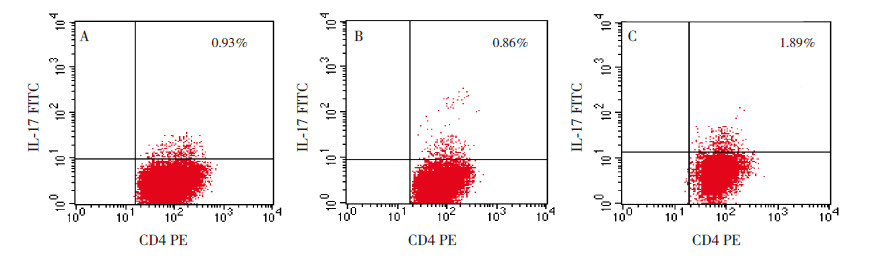 |
图 2 h17 细胞占单个核比例的流式细胞术检测结果 A 为对照组,B 为肺炎组,C 为喘息组。右上象限为Th17 细胞。 |
喘息组外周血MDSC及Th17细胞比例呈正相关关系(r=0.645,P<0.001),而对照组(r=0.281,P=0.229)及肺炎组(r=0.056,P=0.621)二者均无相关关系(图 3)。
 |
图 3 各组患儿Th17 细胞与MDSCs 细胞所占比例的相关性 |
反复喘息的患儿较非喘息患儿更容易发展成支气管哮喘。流行病学研究显示,支气管哮喘可以发生于任何年龄段,87.67%哮喘患儿首次喘息发生在5岁之前,70%发生在3岁以内[11]。对于反复喘息患儿而言,防止随后哮喘的发生成为世界范围内儿科医生的努力方向。婴幼儿反复喘息多与呼吸道合胞病毒感染、特应性体质、免疫学异常等有关,且与支气管哮喘存在类似的病理特点。
MDSC是一群具有负向免疫调节功能的异质细胞群,不仅在肿瘤的发生、转移、增殖中扮演重要角色,而且在病毒感染、脓毒血症、急性及慢性非特异性炎症、哮喘及其他自身免疫疾病中发挥着重要作用。人体中,MDSC主要表面标志表达为人白细胞谱抗原lin-HLA-DR-CD33+或是CD33+CD11b+CD14-细胞群[12, 13]。该研究中将人体MDSC的表面标志表达为CD14-HLA-DR-CD33+CD11b+。在抗原依赖和抗原非依赖的T细胞反应中,MDSC发挥着强大的抑制作用。本研究发现喘息组患儿体内MDSC的比例明显高于肺炎组及对照组,导致此结果的原因可能有以下几点:
(1)呼吸道病毒是导致婴幼儿反复喘息的重要原因[14]。MDSC不仅能介导肿瘤的免疫逃逸,还能介导呼吸道病毒的免疫逃逸,致使病毒可在宿主肺部增殖,甚至长期存在,反复刺激呼吸道从而导致呼吸道慢性炎症的形成。(2)研究发现,感染可以通过释放一些炎症因子如IL-6、TGF-β及IL-1β等来诱导MDSC的产生,这可能是肺炎组及喘息组较正常对照组MDSC的比例升高的重要原因。(3)研究表明,在病毒感染中MDSC比例显著增加,并引起T细胞功能抑制,产生Th2为主的免疫应答倾向[15],这也是导致反复喘息的重要原因。(4)MDSC能够高表达的可诱导一氧化氮合酶(iNOS),其诱导生产高浓度的NO,可导致微血管的渗出,支气管上皮细胞脱落和功能性改变,增加气道的炎症反应,引起气道的高反应性。国内廖原等[16, 17]研究发现将肿瘤模型中MDSC过继哮喘小鼠模型中可以有效减轻哮喘的炎症反应,本研究出现与其不同的结果,可能最大的原因是本研究的研究对象是人,而非动物模型。本研究的MDSC的表面标志表达为CD14-HLLA-DR-CD33+CD11b+,实验的方法是检测占有核细胞的百分比,而非单个核细胞的百分比,结果可能较其他研究者不同。
Th17细胞是近年来发现的另一种辅助细胞,主要通过分泌IL-17A/F、IL-21、TGF-β及TNF-α等炎症因子而参与神经系统、呼吸系统、心血管系统、消化系统等多种疾病的发生。IL-17是一种具有强大招募中性粒细胞作用的前炎症因子,与中性粒细胞的增殖与分化成熟密切相关。研究表明病毒感染小鼠肺部炎症反应中,出现IL-17及肺部淋巴结中Th17细胞水平的升高[18]。国内研究发现,Th17细胞参与呼吸道合胞病毒感染、哮喘的发生及发展过程,且与它们的严重程度呈正相关[9]。本研究发现反复喘息患儿Th17细胞占单个核细胞的百分比明显高于对照组及肺炎组,表明Th17可能参与反复喘息的发病过程。
MDSC增殖与分化涉及IL-6、IL-1β、IL-4、TGF-β、环氧合酶2及前列腺素、肿瘤坏死因子等诸多因子,它们通过激活蛋白质酪氨酸激酶途径和信号转导与转录激活途径参与其增殖及分化[19]。Veldhoen等[20]研究发现,在小鼠的幼稚T细胞向Th17分化过程中,IL-6及TGF-β是必不可少的,IL-6及TGF-β通过活化Smad2/3、Stat3及NF-kβ等信号分子诱导Th17细胞的产生。在实验性自身免疫性脑脊髓膜炎(EAE)实验中,向体内转移G-MDSC可以阻断Th17细胞的活动从而减轻EAE的症状和体征,在体外实验,尤其是Th17极化的条件即IL-6、TGF-β及IL-1β增多时,MDSC可以促使幼稚的T细胞转化为Th17细胞[21, 22, 23]。反复喘息患儿体内IL-6及TGF-β增多,恰好满足MDSC产生及促使幼稚的T细胞向Th17细胞转化所需要的条件。本研究发现,在喘息组,MDSC与Th17所占比例呈正相关,而在其他组不存在相关性,表明在反复喘息患儿外周血中MDSC与Th17细胞水平都升高,二者共同参与反复喘息的发生与发展。
综上所述,MDSC细胞及Th17细胞的数量及二者的相关关系可能在喘息性疾病的发生发展中发挥重要作用,但是MDSC与Th17细胞到底如何相互影响的及其它们在喘息性疾病中的具体机制有待进一步完善。本研究通过探究MDSC及Th17细胞在婴幼儿喘息中的可能关系,拓宽了喘息性疾病研究的视野,一定程度上为其治疗及改善预后提供新的方向及希望。
| [1] | Stein RT, Martine FD. Asthma phenotypes in childhood: lessons from an epidemiological approach[J]. Peadiatr Respir Rev, 2004, 5(2): 155-161. |
| [2] | Bisgaard H, Szefler S. Prevalence of asthma-like symptoms in yong children[J]. Pediatr Pulmonol, 2007, 42(8): 723-728. |
| [3] | Young MR, Newby M, Wepsic HT, et al. Hematopoiesis and suppressor bone marrow cells in mice bearing large metastatic lewis lung carcinama tumors[J]. Cancer Res, 1987, 47(1): 100- 105. |
| [4] | Strobers. Natural suppressor (NS) cells, neonatal tolerance ,and total lympoid irradiation:exploring obscure relationship[J]. Annu Rev Immol, 1984, 4(2): 219-237. |
| [5] | Kao J, Ko EC, Eisenstein S, et al. Targeting immune suppressing myeloid-derived suppressor cells in oncology[J]. Crit Rev Oncol Hematol, 2011, 77(1): 12-29. |
| [6] | 崔自由, 黄幼田, 赵继敏, 等. 应用流式细胞术动态观测小鼠树突状细胞诱导的T 细胞增殖的变化[J]. 郑州大学学报(医学版), 2005, 40(9): 822-824. |
| [7] | 张艳丽, 王秀芳, 雷瑞瑞, 等. 哮喘、毛细支气管炎患儿外周血MDSCs、IL-10 和IL-12 水平及意义[J]. 西安交通大学学报(医学版), 2013, 34(4): 503-508. |
| [8] | Den J, Zmijewski JW, Luther R, et al. Free radicalproducing myeloid-derived regulatory cells: potent activators and suppressors of lung inflammation and airway hyperresponsiveness[J]. Mucosal Immunol, 2011, 4(5): 503-517. |
| [9] | 赵茜叶, 周旭华, 于艳艳. Th17/Il-17 与呼吸道合胞病毒毛细支气管炎气道炎症相关性[J]. 中国儿童保健杂志, 2014, 22(4): 414-416. |
| [10] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第七版. 北京: 人民卫生出版社, 2002: 1175-1187. |
| [11] | 全国儿童哮喘防治协作. 中国城区儿童哮喘患病率调查[J]. 中华儿科杂志, 2003, 41(2): 123-127. |
| [12] | Gabrilovich DI, Nagaraj S. Myeloid derived suppressor cells as regulators of immune system[J]. Nat Rev Immunol, 2009, 9(3): 162-174. |
| [13] | Ochoa AC, Zea AH, Hernandez C, et al. Arginase, prostaglandins, and myeloid-derived suppressor cells in renal cell carcinoma[J]. Clin Cancer Res, 2007, 13(2 Pt 2): 721s-726s. |
| [14] | 姚苗苗, 王克明, 徐群英. 婴幼儿喘息的病因及相关危险因素分析[J]. 中国当代儿科杂志, 2011, 13(3): 195-198. |
| [15] | Cuenca AG, Delano MJ, Keuy-Scumpia KM, et al. A paradoxical role for myeloid-derived suppressor cell in sepsis and trauma[J]. Mol Med, 2011, 17(3-4): 281-292. |
| [16] | 廖原, 于化鹏, 樊慧珍, 等. 荷瘤小鼠髓系来源抑制细胞对 CD8+CD28- T 细胞的调控及其在支气管哮喘中的作用[J]. 中华结核和呼吸杂志, 2012, 35(7): 538-539. |
| [17] | 廖原, 于化鹏, 陈新, 等. 荷瘤小鼠髓系来源抑制细胞对哮喘小鼠气道炎症的影响[J]. 中国呼吸及危重杂志, 2012, 11(2): 121-124. |
| [18] | Kawaguchi M, Kokubu F, Fujita J, et al. Role of interleukin- 17in asthma[J]. Inflanm Allergy Drug Targets, 2009, 8(5): 383- 389. |
| [19] | Rodriguez PC, Hernandez CP, Quiceno D, et al. Arginase I in myeliod suppressor cells is induced by COX-2 in lung carcinoma[J]. Exp Med, 2005, 202(7): 931-939. |
| [20] | Veldhoen M, Hocking RT, Atkins CJ, et al. TGF-β in the context of an inflammatory cytokine milieu suppors denovo differentiation of IL-17-producing T cells[J]. Immunity, 2006, 24(2): 179-189. |
| [21] | Hoechst B, Gamrekelashvili J, Manns MP, et al. Plasticity of human Th17 cells and iTregs is orchestrated by different subsets of myeloid cells[J]. Blood, 2011, 117(24): 6532-6541. |
| [22] | Chtterjee S, Das S, Chakraborty P, et al. Myeloid derived suppressor cells (MDSCs) can induce the generation of Th17 response from naive CD4+T cells[J]. Immunobiology, 2013, 218(5): 718-724. |
| [23] | Yi H, Guo C, Yu X, et al. Mouse CD11b+Gr-1+++ myeloid cells can promote Th17 cell differentiation and experimental autoimmune encephalomyelitis[J]. J Immunol, 2012, 189(9): 4295-4304. |
 2015, Vol. 17
2015, Vol. 17