急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是以骨髓中原始、幼稚淋巴细胞增多为特征的急性白血病。儿童ALL的治愈率逐年提高,先进治疗组儿童ALL的5年无事件生存率(EFS)达70%~80%,但仍约有15%~20%的患儿复发,导致治疗失败,ALL也成为导致儿童死亡的最常见的恶性肿瘤之一[1]。现对我院接受CCLG-ALL2008方案治疗的591例初诊ALL儿童的临床资料进行回顾性分析,随访观察其中80例复发患儿的临床及生物学特征。
1 资料与方法 1.1 研究对象及方法2008年4月至2013年6月在中国医学科学院血液病医院住院并按照CCLG-ALL2008方案治疗的ALL初诊患儿共591例,其中男363例,女228例,中位年龄5.0岁(范围0.4~15岁)。回顾性分析并随访观察其中80例复发患儿的临床及生物学特征。80例复发患儿中,男50例,女30例,中位年龄5.5岁(范围0.4~13岁)。ALL的诊断、完全缓解、复发标准参照《血液病诊断和疗效标准》第三版[2]。
根据CCLG-ALL2008方案中的标准进行危险性分组和治疗[3]。随访时间截止至2014年6月,中位随访时间34个月(范围1~74个月)。
1.2 统计学分析采用SPSS 17.0统计软件进行统计学处理与分析,采用Kaplan-Meier方法评估患儿生存率,组间生存率的比较采用log-rank检验。生存分析应用Kaplan-Meier法绘制生存曲线。计数资料以频数或百分率(%)表示。P<0.05为差异有统计学意义。
2 结果 2.1 591例患儿总疗效分析591例患儿中,580例患儿治疗后达完全缓解(CR),CR率为97.4%,5年总生存率(OS)为(80.67±0.02)%,EFS为(79.07±0.02)%。580例CR患儿中,标危组230例,中危组196例,高危组150例。标危组5年OS 与EFS分别为(94.87±0.02)%和(93.81±0.02)%,中危组5年OS 与EFS分别为(86.03±0.03) %和(84.59±0.04)%,高危组5年OS与EFS分别为(52.76±0.05)%和(47.16±0.06)% ,不同危险性组别间OS 与EFS 差异有统计学意义(P<0.001)。
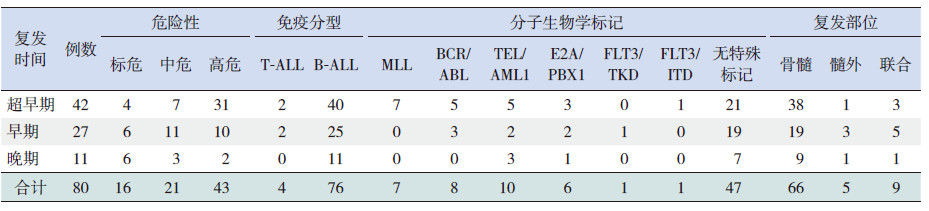
2.2 复发情况分析对580例获得CR的患儿进行长期随访观察,中位随访时间34个月,其中复发80例(13.9%),自诊断至复发的中位时间为26.2个月。其中超早期复发(自诊断至复发时间<18个月)42例(53%);早期复发(自诊断至复发时间为18~36个月)27例(34%);晚期复发(自诊断至复发时间>36个月)11例(14%)。
对复发部位进行分析发现,单纯骨髓复发66例(83%),髓外复发5例(6%)(单纯中枢神经系统复发3例,单纯睾丸复发2例),骨髓联合髓外复发9例(11%)。
依据不同危险度分组对复发情况进行分析发现,80例患儿中,标危组复发16例(占标危组患儿的7.0%),中位复发时间31.5个月;中危组复发21例(占中危组患儿的10.7%),中位复发时间21.5个月;高危组复发43例(占高危组患儿的28.7%),中位复发时间9个月,3组的复发率比较差异有统计学意义(P<0.05)。
根据免疫学分型及分子生物学标记对复发情况进行分析发现,复发患儿中T-细胞型ALL(T-ALL)4例(占T-ALL患儿的9.5%),B-细胞型ALL(B-ALL)76例(占B-ALL患儿的14.3%)。80例复发患儿中 MLL阳性7例(占MLL阳性患儿的35.0%);BCR/ABL阳性8例(占BCR/AB阳性患儿的24.2%);E2A/PBX1阳性6例 (占E2A/PBX1阳性患儿的18.2%);TEL/AML1阳性10例(占TEL/AML1阳性患儿的8.0%);FLT3/ITD阳性1例(占FLT3/ITD阳性患儿的33.3%);无特殊分子生物学标记47例(占无特殊分子生物学标记患儿的14.2%)。不同复发时间复发患儿的免疫分型、复发部位及分子生物学标记分布情况见表 1。
| 表 1 复发患儿情况 |
80例复发的患儿中,超早期复发42例,18例再诱导,7例达第二次CR(CR2)(39%), 4例至随访结束时存活(其中1例为中枢神经系统白血病,存活,1例接受半相合移植,2例持续化疗中),3例达CR2后未继续治疗再复发死亡。早期复发27例中,18例再诱导,14例达CR2(78%),3例部分缓解;6例存活,余21例死亡。晚期复发11例中,9例再诱导,均获CR2(100%),但1例巩固化疗感染死亡,1例移植时死亡;最终1例失访,6例存活(3例移植存活),余4例死亡。
80例患儿中,共45例接受再诱导治疗,完全缓解率为62%,生存率为(14.05±0.05)%。
2.4 不同特征复发患儿的预后分析(1)复发时间与预后:超早期复发患儿42例,5年预期生存率为0;早期复发患儿27例,5年预期生存率(11.44±0.09)%;晚期复发的11例患儿5年预期生存率(60.00±0.15)%(P<0.001)(图 1)。
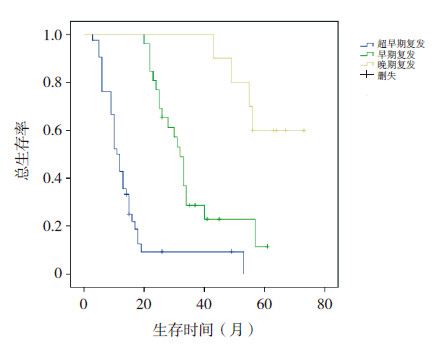 |
图 1 不同时间复发患儿生存曲线 |
(2)复发部位与预后:单纯骨髓复发患儿66例,5年预期生存率(9.23±0.04)%;单纯髓外复发患儿5例,5年预期生存率100%;骨髓复发同时伴有髓外复发的9例患儿5年预期生存率(25.00±0.15)%(P=0.010)(图 2)。
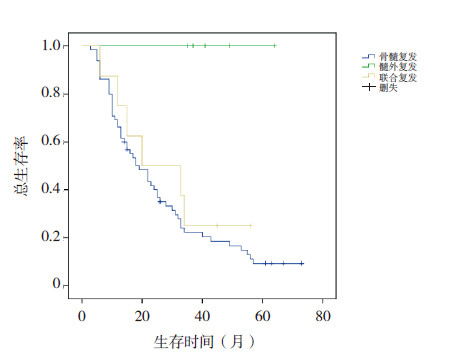 |
图 2 不同部位复发患儿生存曲线 |
(3)免疫分型与预后:T-ALL复发7例患儿5年预期总生存率为0,B-ALL复发73例患儿5年预期总生存率为(15.52±0.05)%(P=0.020)(图 3)。
 |
图 3 不同免疫分型复发患儿生存曲线 |
(4)分子生物学特征与预后:无特殊分子生物学标记者5年预期总生存率(17.41±0.06)%;伴有TEL/AML1阳性的复发患儿5年预期总生存率(37.04±0.19)%;余伴有分子生物学标记,如BCR/ABL、MLL、E2A/PBX1、FLT3/TKD异常的复发患儿5年预期总生存率均为0(P=0.008)(图 4)。
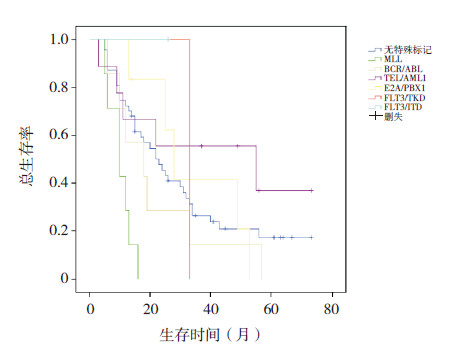 |
图 4 不同分子生物学标记复发患儿生存曲线 |
单纯骨髓复发者预后差,其次是骨髓联合髓外复发,预后最好的是单纯髓外复发者,COG协作组数据显示单纯骨髓复发、骨髓联合髓外复发及单纯髓外复发3组病人5年EFS分别是24%、33%和59%;同时,复发的时间、复发部位、疾病免疫分型均与复发者的预后相关[5]。据报道,泰国儿童ALL复发率为20.9%[6]。我国上海应用98方案治疗儿童ALL的回顾性分析显示ALL复发率为30%,以骨髓复发为主(22.5%)[7]。本研究应用CCLG-ALL2008方案治疗儿童ALL,总体疗效明显提高,复发率为13.9%,但复发的80例患儿中仅45例接受再诱导治疗,CR2为62%,生存率仅为14.05%,且复发部位与预后明显相关,单纯髓外复发者预后最好,5年预期总生存率达100%,骨髓联合髓外复发为25.00%,而单纯骨髓复发预后差,仅为9.23%。本组病例采用造血干细胞移植者很少,且部分患儿复发后未进行序贯治疗,限制了复发后的疗效,复发患儿治疗方案的进一步改善及治疗依从性的增强可改善预后。
Pui等[8]报道的儿童ALL,单纯中枢神经系统白血病发生率为3%左右,发生中枢神经系统白血病的高危因素包括:T-ALL、高白细胞、高危基因异常如BCR-ABL阳性等。初诊时脑脊液存在白血病细胞或穿刺损伤对中枢神经系统白血病发生的影响不同协作组有所不同,可能与采取的治疗措施不同有关[9, 10, 11, 12, 13]。本研究中单纯中枢神经系统白血病的发生率为0.5%,与国际先进水平相当[8]。Kawedia 等[14]报道地塞米松清除率高者复发率高,中枢神经系统白血病发生率高,可能与地塞米松高清除率者血清中抗门冬酰胺酶抗体水平高有关。
Pui等[9]报道复发时间与预后密切相关,本研究同样提示初诊至复发的时间少于36个月者预后差,尤其在18个月内复发者,而晚期复发患儿5年总生存率可达60%。本研究同时显示T-ALL复发的患儿5年预期总生存率为0,低于B-ALL复发的患儿,进一步提示对于早期复发尤其是超早期复发的患儿及T-ALL复发的患儿应进行造血干细胞移植。
研究白血病细胞的生物学特征对预后判断具有重要意义,有利于进一步减少复发。超二倍体、4号、10号、17号三体及ETV6-RUNX1阳性者预后相对好,而亚二倍体、21号染色体内部扩增及BCR-ABL 阳性者预后差,更易复发,伴有 t(1;19) (q23;p13) 或TCF3-PBX1融合基因表达者不同治疗组报道不一[15]。Pui等[16]报道,伴有t(9;22)/BCR-ABL1、t(1;19)/TCF3-PBX1或t(4;11)/MLL-AFF1异常的未发现2年以后复发的,预示这些患者比其他亚型更早治愈;患儿缓解后10年复发率仅为0.6%。本组病例应用CCLG-ALL2008方案进行化疗,改善了T-ALL患儿的生存率。但其中高危组复发率仍较高,且多早期复发。MLL、BCR-ABL等阳性是高危复发因素,且易早期复发,与文献报道一致[16]。Marjerrison等[17]的研究显示,儿童ALL的复发中位时间是1.7年(范围0.8~3.1年);第一次复发后3年OS为28.2%;年龄大于10岁、白细胞高于50×109/L、有骨髓复发及初诊至复发时间小于36个月是预后不良因素;复发后生存率明显下降,放弃治疗的患儿均死亡。
目前尚无统一的复发后治疗方案。复发患儿的治疗是一大挑战,造血干细胞移植是挽救性治疗的优良策略[18]。近年Pui等[15]对复发患儿进行分析总结,认为仅部分患儿需要造血干细胞移植。对早期复发(自缓解到复发的时间小于30个月)者获得CR2后采用含有全身照射(TBI)预处理方案的HLA相合异基因造血干细胞移植的无白血病生存(LFS)和OS均优于单纯化疗者。造血干细胞移植推荐用于:Pre-B-ALL早期复发并获得CR2;T-ALL的CR2期;所有处于CR3及以上期者。而对单纯发生髓外复发的患儿采取局部治疗联合系统性治疗,无需进行造血干细胞移植,对第一次晚期复发的Pre-B-ALL患儿且微小残留白血病清除好的行化疗亦取得好的进展[10]。对复发患儿生物学机制和药物耐药的认识,研究白血病细胞靶向治疗和宿主基因治疗,以微小残留白血病测量作为危险分组的精确性,靶向治疗和免疫治疗的发展可进一步提高复发患儿的疗效[19, 20]。本组患儿中晚期复发者预后明显优于早期复发者,但部分患儿未能序贯治疗导致治疗失败。MLL、BCR-ABL阳性复发患儿预后差,无长期生存者,对复发后患儿的系统评估与治疗势在必行。
由于部分复发患儿并无已知高危因素,所以Yang等[21]对2 535例初诊患儿进行基因组测序,结果显示一些基因型与复发相关,并发现PDE4B和ABCB1等与白血病细胞耐药有关。Bhojwani等[19]通过RNA测序发现白血病细胞的细胞增殖、DNA修复和凋亡异常,NT5C2突变者易早期复发,可能与耐药克隆发生有关。二氢叶酸还原酶是MTX的靶点,其多态性与复发有关[22, 23]。<10%的患儿复发时的异常克隆与初诊时不同,30%的患儿复发时发现额外异常基因克隆,50%的患儿复发时有丢失或获得新的基因,有一些与治疗相关或与疾病进展相关,如IKZF1 和 CDKN2A/B缺失,19%的复发ALL患者有CREBBP缺失突变,亦有一些基因初诊与复发时保持不变或加倍异常。早期复发(<36个月)和晚期复发者基因表型可能不同,Wnt通路、Ras/Raf/MEK/ERK及NOTCH1、PI3K-AKT和Cyclin D3:CDK4/6的信号调节异常可能与复发相关[24, 25, 26, 27, 28]。所以应进一步研究基因型与预后的相关性,以利于靶向治疗的应用。本组患儿中部分无特殊基因型表达,早期发现与预后不良相关的基因,早期进行个体化治疗及靶向治疗的策略,有望进一步提高疗效。
随着我国健康教育的加强,患儿父母对疾病的认识逐步提高,治疗的依从性逐渐提高,对减少疾病复发也尤为重要。总之,CCLG-ALL2008方案一疗程完全缓解率高,复发率低。但伴有MLL、BCR/ABL等基因异常者复发率明显增高,并有部分患儿无目前已知特异分子生物学标记,且复发患儿生存率低,尤其早期复发及伴有骨髓复发的患儿,故而加强个体化治疗,适时采用造血干细胞移植,提高复发者的总生存率,并继续寻找未知的与复发相关的基因,以期进一步降低复发率,提高总体生存率。
| [1] | Pui CH, Robison LL, Look AT. Acute lymphoblastic leukaemia[J]. Lancet, 2008, 371(9617): 1030-1043. |
| [2] | 张之南, 沈悌. 血液病诊断及疗效标准[M]. 第3 版. 北京: 科学出版社, 2007: 19-23. |
| [3] | 陈波, 宪莹, 苏庸春, 等. CCLG-ALL 08 方案治疗儿童急性淋巴细胞白血病毒副作用的临床研究[J]. 中国当代儿科杂志, 2013, 15(9): 737-742. |
| [4] | Pui CH. Recent research advances in childhood acute lymphoblastic leukemia[J]. J Formos Med Assoc, 2010, 109(11): 777-787. |
| [5] | Nguyen K, Devidas M, Cheng SC, et al. Factors influencing survival after relapse from acute lymphoblastic leukemia: a Children’s Oncology Group study[J]. Leukemia, 2008, 22(12): 2142-2150. |
| [6] | Tharnprisan P, Khiewyoo J, Sripraya P, et al. Relapse-free rate with childhood acute lymphoblastic leukemia treated under the thai national protocol[J]. Asian Pac J Cancer Prev, 2013, 14(2): 1127-1130. |
| [7] | 刘瑞海, 宋亮, 刘华林, 等. 98- 方案诊治儿童急性淋巴细胞白血病疗效和预后因素分析[J]. 临床儿科杂志, 2010, 28(5): 423-427. |
| [8] | Pui CH, Campana D, Pei D, et al. Treatment of childhood acute lymphoblastic leukemia without prophylactic cranial irradiation[J]. N Engl J Med, 2009, 360(26): 2730-2741. |
| [9] | Cancela CS, Murao M, Viana MB, et al. Incidence and risk factors for central nervous system relapse in children and adolescents with acute lymphoblastic leukemia[J]. Rev Bras Hematol Hemoter, 2012, 34(6): 436-441. |
| [10] | Locatelli F, Schrappe M, Bernardo ME, et al. How I treat relapsed childhood acute lymphoblastic leukemia[J]. Blood, 2012, 120(14): 2807-2816. |
| [11] | Pui CH, Howard SC. Current management and challenges of malignant disease in the CNS in paediatric leukaemia[J]. Lancet Oncol, 2008, 9(3): 257-268. |
| [12] | Pui CH, Thiel E. Central nervous system disease in hematologic malignancies: historical perspective and practical applications[J]. Semin Oncol, 2009, 36(4 Suppl 2): S2-S16. |
| [13] | Jorgensen M, Shankar A, Aabideen Z, et al. The role of routine surveillance for silent central nervous system relapse in children with acute lymphoblastic leukaemia[J]. Br J Haematol, 2012, 159(3): 368-370. |
| [14] | Kawedia JD, Liu C, Pei D, et al. Dexamethasone exposure and asparaginase antibodies affect relapse risk in acute lymphoblastic leukemia[J]. Blood, 2012, 119(7): 1658-1664. |
| [15] | Pui CH, Mullighan CG, Evans WE, et al. Pediatric acute lymphoblastic leukemia: where are we going and how do we get there?[J]. Blood, 2012, 120(6): 1165-1174. |
| [16] | Pui CH, Pei D, Campana D, et al. A revised definition for cure of childhood acute lymphoblastic leukemia[J]. Leukemia, 2014, 28(12): 2336-2343. |
| [17] | Marjerrison S, Antillon F, Fu L, et al. Outcome of children treated for relapsed acute lymphoblastic leukemia in Central America[J]. Cancer, 2013, 119(6): 1277-1283. |
| [18] | Pulsipher MA, Peters C, Pui CH. High-risk pediatric acute lymphoblastic leukemia: to transplant or not to transplant? [J]. Biol Blood Marrow Transplant, 2011, 17(1 Suppl): S137-S148. |
| [19] | Bhojwani D, Pui CH. Relapsed childhood acute lymphoblastic leukaemia[J]. Lancet Oncol, 2013, 14(6): e205-e217. |
| [20] | Burke MJ, Lamba JK, Pounds S, et al. A therapeutic trial of decitabine and vorinostat in combination with chemotherapy for relapsed/refractory acute lymphoblastic leukemia[J]. Am J Hematol, 2014, 89(9): 889-895. |
| [21] | Yang JJ, Cheng C, Devidas M, et al. Genome-wide association study identifies germline polymorphisms associated with relapse of childhood acute lymphoblastic leukemia[J]. Blood, 2012, 120(20): 4197-4204. |
| [22] | Gómez-Gómez Y, Organista-Nava J, Saavedra-Herrera MV, et al. Survival and risk of relapse of acute lymphoblastic leukemia in a Mexican population is affected by dihydrofolate reductase gene polymorphisms[J]. Exp Ther Med, 2012, 3(4): 665-672. |
| [23] | Meyer JA, Wang J, Hogan LE, et al. Relapse-specific mutations in NT5C2 in childhood acute lymphoblastic leukemia[J]. Nat Genet, 2013, 45(3): 290-294. |
| [24] | Lo Nigro L. Biology of childhood acute lymphoblastic leukemia[J]. J Pediatr Hematol Oncol, 2013, 35(4): 245-252. |
| [25] | Dandekar S, Romanos-Sirakis E, Pais F, et al. Wnt inhibition leads to improved chemosensitivity in paediatric acute lymphoblastic leukaemia[J]. Br J Haematol, 2014, 167(1): 87- 99. |
| [26] | Knight T, Irving JA. Ras/Raf/MEK/ERK pathway activation in childhood acute lymphoblastic leukemia and its therapeutic targeting[J]. Front Oncol, 2014, 4: 160. |
| [27] | Roti G, Stegmaier K. New approaches to target T-ALL[J]. Front Oncol, 2014, 4: 170. |
| [28] | Bhatla T, Jones CL, Meyer JA, et al. The biology of relapsed acute lymphoblastic leukemia: opportunities for therapeutic interventions[J]. J Pediatr Hematol Oncol, 2014, 36(6): 413-418. |
 2015, Vol. 17
2015, Vol. 17