近年来儿童急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)的总体治愈率已达80%左右,但非高危组与高危组的预后有明显的差异[1, 2]。BFM协作组总结儿童ALL总体6年预计无事件生存率(probability of event free survival, pEFS)为79.6%,其中标危患儿pEFS为89.5%、中危患儿pEFS为79.7%、高危(high risk, HR)患儿pEFS为49.2%[3]。我中心从2003年7月起启用ALL-BFM 95方案治疗HR-ALL,现对临床治疗效果进行回顾性分析,探索该方案在治疗国内儿童HR-ALL的可行性及疗效。
1 资料与方法 1.1 研究对象回顾性分析2003年7月至2013年8月初次诊断为ALL并达到HR入组标准的患儿共47例的临床资料,其中男27例,女20例,年龄范围2~15岁,中位年龄7岁,随访时间16~127个月,中位随访时间39个月。
HR入组标准:(1)强的松反应差(prednisone poor responders, PPR),即化疗后8 d外周血幼稚细胞>1.0×109/L;(2)中危患儿诱导化疗后15 d骨髓原始幼稚淋巴细胞>25%(M3型);(3)诱导化疗后33 d骨髓原始幼稚淋巴细胞为5%~25%(M2或M3型);(4)合并t(9;22)(BCR/ABL)或t(4;11)(MLL/AF4)。(5)诊断时有髓外白血病(睾丸白血病、中枢神经系统白血病)[3]。
1.2 治疗方法47例患儿按ALL-BFM 95方案进行化疗[3],化疗方案由诱导阶段、巩固阶段、再诱导阶段和维持阶段构成。27例患儿采用单纯化疗;7例有相合亲缘供者及6例有相合非血缘供者的HR-ALL患儿,在完全缓解后经至少1个巩固阶段化疗后行造血干细胞移植(hematopoietic stem cell transplantation, HSCT);7例因无相合供者,行亲缘半相合HSCT。BCR/ABL阳性患者加用格列卫至移植后半年。
亲缘全相合移植的预处理方案采用环磷酰胺(Cy)+白消安(BU)+氟达拉滨(FLU)+塞替派(TT),非血缘全相合及亲缘半相合HSCT加用抗淋巴细胞球蛋白(ATG)。亲缘和非血缘全相合HSCT采用输注供者外周血干细胞(PBSC),输注单个核细胞(MNC)数为5.0~8.0×108/kg,中位数为7.0×108/kg;亲缘半相合HSCT采用输注供者骨髓,输注MNC数为1.5~3.0×108/kg,中位数为2.0×108/kg。亲缘及非血缘全相合HSCT均采用环孢素A(CsA)+骁悉(MMF)+短程小剂量甲氨蝶呤(MTX)预防移植物抗宿主病,亲缘半相合HSCT采用他克莫司(FK506)代替CsA。
1.3 疗效分析经治疗后骨髓中原始及幼稚细胞百分比<5%为完全缓解。pEFS是指从临床观察开始至疾病复发或死亡的预计时间。
1.4 统计学分析应用SPSS 17.0 统计软件对数据进行统计学分析,生存率采用百分率(%)表示,Kaplan-Meier方法进行生存分析,组间生存率比较采用log-rank检验,P<0.05为差异有统计学意义。
2 结果 2.1 死亡情况分析在47例患儿中,共有17例死亡,其中复发相关死亡12例(71%),治疗相关死亡5例(29%)。治疗相关死亡中,1例为巩固化疗过程中出现高浓度MTX,经亚叶酸钙解救无效后继发急性肾功能衰竭死亡,2例死于诱导化疗后继发严重腹腔感染,2例为移植相关死亡(其中因急性移植物抗宿主病Ⅳ度死亡1例,因慢性肺部移植物抗宿主病合并重症肺炎死亡1例),移植相关病死率为10%(2/20)。总体5年pEFS 为62%,见图 1。
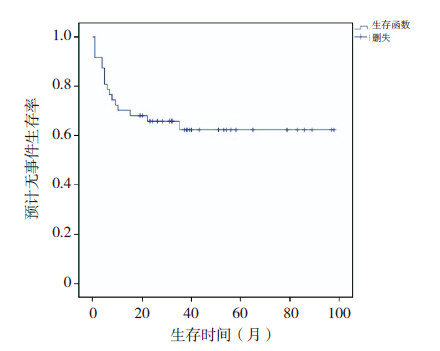 |
图 1 47 例HR-ALL 患儿总体5 年pEFS |
在47例患儿中,单纯PPR的HR-ALL患儿5年pEFS显著高于化疗后第15天及第33天骨髓M3状态的HR-ALL患儿(P=0.029)。HR-ALL患儿中有27例采用单纯化疗治疗,20例采用化疗联合HSCT方式治疗,两者5年pEFS分别是52%和77%,差异有统计学意义(P=0.035)(图 2)。见表 1。
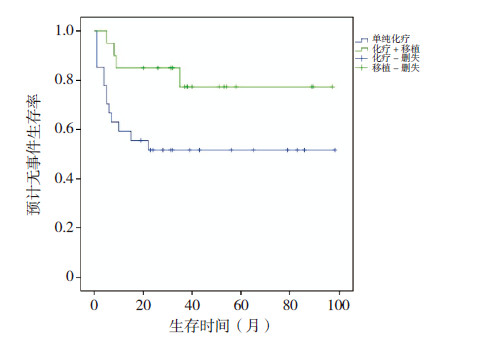 |
图 2 单纯化疗组与HSCT 组5 年pEFS |
| 表 1 47 例ALL 患儿不同分层情况下5 年pEFS 比较 |
存在BCR/ABL、MLL/AF4基因阳性或髓外白血病的HR患儿,其早期治疗反应常有不同。在BCR/ABL基因阳性的11例患儿中,PPR 1例,诱导化疗后15 d M3型4例,诱导缓解失败1例;采用单纯化疗3例(复发2例,治疗相关死亡1例),化疗联合HSCT 8例(除移植相关死亡2例外,6例无病生存),5年pEFS为55%。MLL/AF4基因阳性的5例患儿中,PPR 1例,诱导化疗后15 d M3型2例;采用单纯化疗3例,化疗联合HSCT2例,5年pEFS为80%。髓外白血病的6例患儿中,PPR 1例,诱导化疗后15 d M3型1例;全部采用单纯化疗,5年pEFS 为67%。见表 1。
3 讨论目前儿童ALL治疗的瓶颈主要在HR患儿,因为HR患儿存在较高的复发风险和较低的生存率[4]。而现在普遍公认的HR因素主要有:Ph染色体或MLL基因阳性、早期治疗反应差、婴儿白血病等,本组病例中不含婴儿白血病。
Ph染色体阳性ALL与其他ALL亚型不同点在于即使超过95%的Ph染色体阳性 ALL患者对初始诱导化疗敏感,但缓解是暂时的,存在诊断后3~4年内高复发率[5]。Arico等[6]报道了一项多中心回顾性研究,在267例Ph染色体阳性的ALL患儿中,单纯化疗和接受HSCT的5年无病生存率(DFS)分别是25%和72%。在Schultz等[7]的研究中报道了采用强烈化疗联合伊马替尼对Ph染色体阳性ALL病人进行治疗的5年DFS为70%,但长期疗效仍有待于观察。本研究的11例BCR/ABL阳性患儿选择移植治疗的8例,除2例出现移植相关死亡外,余6例无病存活(75%);单纯化疗的3例,其中2例由于经济原因,未能规律服用伊马替尼,在维持阶段前复发,1例在诱导期因败血症死亡,提示在中国国情下HSCT加短期格列卫治疗仍是Ph染色体阳性ALL的值得选择的方案,可获得较好的长期无病存活。
由于T-ALL免疫表型存在一定的异质性,不同的免疫表型决定其预后[8]。本研究显示T细胞HR-ALL患儿的4年pEFS为57%,低于B细胞HR-ALL患儿的65%,但差异无统计学意义。Coustan-Smith等[9]报道显示,T-ALL中的早期前体T细胞ALL(ETP-ALL)预后极差,10年存活率仅为19%,建议行HSCT。本组T-ALL未能分辨出ETP-ALL病例,可能导致T细胞HR-ALL患儿无病存活率降低。
儿童ALL早期治疗反应与预后直接相关[10]。BFM协作组通常采用7 d强的松反应、第15天及第33天骨髓缓解情况来定义早期治疗反应[11]。意大利AIEOP-BFM ALL 2000协作组最近报道了312例高危ALL患儿的5年EFS为58.9%,17例33 d不缓解的EFS为41.2%,152例单纯PPR患儿的EFS为74%[12]。一项多中心大样本回顾性研究指出,诱导缓解失败的总体10年OS率仅32%[13]。本研究同样显示,第33天反应差的HR-ALL患儿预后最差,第15天反应差的次之,而单纯PPR的HR-ALL患儿经过强化治疗同样能获得良好的预后。近年来BFM协作组采用PCR方法或流式细胞术监测微小残留病(MRD)水平,并因此重新调整ALL危险度分组(分为MRD-标危、MRD-中危、MRD-高危),10年EFS分别是93%、74%、16%[14],因此根据MRD水平的危险度分组能进一步指导治疗,改善预后。
对于HR-ALL的治疗方法,国际上通常采用的手段主要包括强化的化疗或化疗联合HSCT治疗。欧洲有一项多中心前瞻性研究结果发现HSCT治疗儿童极高危ALL的DFS为56.7%,优于单纯化疗的40.6%,且差异有统计学意义[15]。BFM协作组对儿童ALL首次缓解进行移植治疗有相应的指引[16]:诱导缓解失败(诱导化疗第33天骨髓中幼稚细胞≥5%);低二倍体;t(4;11)或t(9;22)加上诱导第33天或第78天MRD阳性;T细胞ALL合并PPR;诱导第78天MRD≥10-3。本研究显示行HSCT治疗的患儿所具有的HR因素(如BCR/ABL及MLL阳性)多于单纯化疗组,而相对危险度较低的PPR及髓外白血病病例则显著少于单纯化疗组。在美国St Jude儿童医院报道了针对极高危ALL患儿,不管采用全相合或半相合的HSCT方法均可提高存活率,5年OS率达65%[17]。本研究采用与St Jude儿童医院相似的HSCT方法,对不同供者来源采用相应的预处理方案对HR-ALL患者进行HSCT,较单纯化疗组提高了长期无病存活率,然而本研究移植组EFS较国外报道要略高一些,原因可能在于国外入组移植病人为极高危组,而本研究入组的仅为HR患儿,且不含婴儿白血病亚型。
本中心采用BFM协作组方案治疗儿童HR-ALL,亦取得了62%的5年pEFS,较2008年BFM协作组报道的49.2%要高[3],与2014年AIEOP-BFM协作组报道的58.9%相仿[12]。本组研究发现HR-ALL患儿的复发相关病死率达71%,提示复发是HR-ALL患儿最常见的死亡原因。在有条件的单位(移植相关病死率低的单位),选用HSCT可改善HR-ALL患儿预后。总体来说,HR病例的高危因素重叠存在,治疗反应各不相同,无论化疗或移植,治疗强度都很大,并发症及治疗相关死亡均较多,有待更多临床经验的总结和完善,就本中心而言,引进ALL-BFM 95方案后大幅度改善了儿童HR-ALL的预后。
今后的治疗策略趋向于应用MRD水平监测对HR-ALL患儿进一步行分层治疗,采用基因靶向药物、去甲基化新药以及免疫疗法联合HSCT,有望进一步改善儿童HR-ALL的预后。
| [1] | Gaynon PS, Angiolillo AL, Carroll WL, et al. Long-term results of the children's cancer group studies for childhood acute lymphoblastic leukemia 1983-2002: a Children's Oncology Group Report[J]. Leukemia, 2010, 24(2): 285-297. |
| [2] | Moricke A, Zimmermann M, Reiter A, et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981- 2000[J]. Leukemia, 2010, 24(2): 265-284. |
| [3] | Moricke A, Reiter A, Zimmermann M, et al. Risk-adjusted therapy of acute lymphoblastic leukemia can decrease treatment burden and improve survival: treatment results of 2169 unselected pediatric and adolescent patients enrolled in the trial ALL-BFM 95[J]. Blood, 2008, 111(9): 4477-4489. |
| [4] | Bhojwani D, Howard SC, Pui CH. High-risk childhood acute lymphoblastic leukemia[J]. Clin Lymphoma Myeloma, 2009, 9(Suppl 3): S222-S230. |
| [5] | Uckun FM, Nachman JB, Sather HN, et al. Clinical significance of Philadelphia chromosome positive pediatric acute lymphoblastic leukemia in the context of contemporary intensive therapies: a report from the Children’s Cancer Group[J]. Cancer, 1998, 83(9): 2030-2039. |
| [6] | Arico M, Valsecchi MG, Camitta B, et al. Outcome of treatment in children with Philadelphia chromosome-positive acute lymphoblastic leukemia[J]. N Engl J Med, 2000, 342(14): 998- 1006. |
| [7] | Schultz KR, Carroll A, Heerema NA, et al. Long-term follow-up of imatinib in pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia: Children’s Oncology Group Study AALL0031[J]. Leukemia, 2014, 28(7): 1467-1471. |
| [8] | 熊昊, 张耀, 胡群, 等. 23 例儿童T 系急性淋巴细胞白血病的生物学特征分析[J]. 中国当代儿科杂志, 2010, 12(8): 605- 608. |
| [9] | Coustan-Smith E, Mullighan CG, Onciu M, et al. Early T-cell precursor leukaemia: a subtype of high-risk acute lymphoblastic leukaemia[J]. Lancet Oncol, 2009, 10(2): 147-156. |
| [10] | Lauten M, Moricke A, Beier R, et al. Prediction of outcome by early bone marrow response in childhood acute lymphoblastic leukemia treated in the ALL-BFM 95 trial: differential effects in precursor B-cell and T-cell leukemia[J]. Haematologica, 2012, 97(7): 1048-1056. |
| [11] | Schrappe M, Reiter A, Ludwig WD, et al. Improved outcome in childhood acute lymphoblastic leukemia despite reduced use of anthracyclines and cranial radio-therapy: results of trial ALLBFM 90. German-Austrian-Swiss ALL-BFM Study Group[J]. Blood, 2000, 95(11): 3310-3322. |
| [12] | Conter V, Valsecchi MG, Parasole R, et al. Childhood high-risk acute lymphoblastic leukemia in first remission: results after chemotherapy or transplant from the AIEOP ALL 2000 study[J]. Blood, 2014, 123(10): 1470-1478. |
| [13] | Schrappe M, Hunger SP, Pui CH, et al. Outcomes after induction failure in childhood acute lymphoblastic leukemia[J]. N Engl J Med, 2012, 366(15): 1371-1381. |
| [14] | Flohr T, Schrauder A, Cazzaniga G, et al. Minimal residual disease-directed risk stratification using real-time quantitative PCR analysis of immunoglobulin and T-cell receptor gene rearrangements in the international multicenter trial AIEOPBFM ALL 2000 for childhood acute lymphoblastic leukemia[J]. Leukemia, 2008, 22(4): 771-782. |
| [15] | Balduzzi A, Valsecchi MG, Uderzo C, et al. Chemotherapy versus allogeneic transplantation for very-high-risk childhood acute lymphoblastic leukaemia in first complete remission: comparison by genetic randomisation in an international prospective study[J]. Lancet, 2005, 366(9486): 635-642. |
| [16] | Pulsipher MA, Peters C, Pui CH. High-risk pediatric acute lymphoblastic leukemia: to transplant or not to transplant?[J]. Biol Blood Marrow Transplant, 2011, 17(1 Suppl): S137-S148. |
| [17] | Leung W, Campana D, Yang J, et al. High success rate of hematopoietic cell transplantation regardless of donor source in children with very high-risk leukemia[J]. Blood, 2011, 118(2): 223-230. |
 2015, Vol. 17
2015, Vol. 17