新生儿败血症是新生儿重症监护室(neonatal intensive care unit, NICU)常见危重疾病之一,其发病率及病死率均较高。据世界卫生组织(WHO)一项统计表明,新生儿败血症每年导致约一百万儿童死亡[1]。Volante等[2]的一项前瞻性研究证实新生儿败血症发病率占活产婴儿1‰~10‰。弥散性血管内凝血(disseminated intravascular coagulation, DIC)是败血症发展成为多器官功能衰竭(MODS)的重要机制之一[3]。败血症合并DIC病情凶险,因此,早期诊断败血症合并DIC不容忽视。目前DIC诊断的评分系统有日本卫生福利部(Japanese Ministry of Health and Welfare, JMHW)评价系统、国际血栓与止血委员会(International Society of Thrombosis and Hemostasis, ISTH)评分标准及日本危重病协会(Japanese Association for Acute Medicine, JAAM)评分系统三种。ISTH显性DIC评分系统与其他两种评分系统相比,其对脓毒症的分层及预后判断具有独特优势[4, 5, 6]。目前将ISTH评分系统用于新生儿败血症合并DIC的研究国内外报道罕见,本文通过采用ISTH显性DIC评分系统,对新生儿败血症合并早期DIC的临床相关因素进行分析,为败血症合并DIC早期阶段诊断、治疗提供参考。
1 资料与方法 1.1 研究对象纳入我院NICU 2012~2013年确诊为新生儿败血症的100例患儿(具有败血症临床表现并且血培养阳性),其中排除先天性凝血因子、血小板异常及血液系统疾病等;所有病例母亲产前、产时均未使用对凝血系统或纤溶系统有影响的药物。男71例,女29例;早产儿24例,足月儿76例;胎龄28~41周,平均38.2周;体重<1 500 g 2例,1 500~2 499 g 22例,2 500~4 000 g 73例,>4 000 g 3例;患儿入院后均进行血、尿、粪三大常规、血生化、凝血功能监测、血培养等检查,并观察其临床表现。新生儿败血症诊断标准参照2003年“新生儿败血症诊疗方案”[7]。
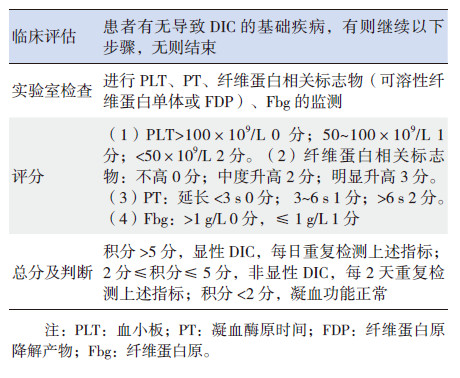
1.2 早期DIC诊断标准依据2001 ISTH明确提出DIC诊断标准[8],结合患儿临床症状、体征及检查化验结果,当积分<2时患儿凝血功能正常,故将积分<2定义为凝血功能正常组;将2≤积分≤5定义为非显性DIC组(早期DIC组);积分>5定义为显性DIC组(晚期DIC组),见表 1。
| 表 1 ISTH 显性DIC 评分系统 |
采用回顾性临床研究方法,收集败血症患儿的一般情况、出生状况、临床表现、实验室检查结果等。按诊断标准判别各患儿凝血系统积分,确定分组,统计分析不同分组患儿临床表现及败血症合并早期DIC相关临床因素。
1.4 统计学分析采用SPSS 19.0统计软件对数据进行处理,计数资料用率(%)表示,组间比较采用分类资料χ2检验;早期DIC临床相关因素分析采用多因素logistic回归分析。P<0.05为差异有统计学意义。
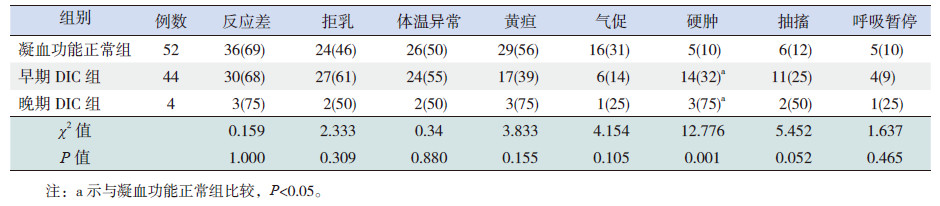
2 结果 2.1 不同组别临床表现100例败血症患儿中凝血功能正常52例、合并早期DIC者44例,合并晚期DIC者4例。败血症患儿主要临床表现为反应差(69%)、拒乳(53%)、体温异常(52%)及黄疸(49%)。3组患儿硬肿的发生比例差异有统计学意义(χ2=12.776,P<0.01),晚期DIC及早期DIC组中硬肿发生率分别为75%、32%,明显高于凝血功能正常组(10%),差异有统计学意义(分别χ2=8.178、7.401,均P<0.05),但早期DIC组与晚期DIC组硬肿发生率差异无统计学意义(χ2=1.399,P>0.05)。其他临床表现发生率在3组患儿间比较差异均无统计学意义(P>0.05)。见表 2。
| 表 2 不同分组患儿临床表现比较 |
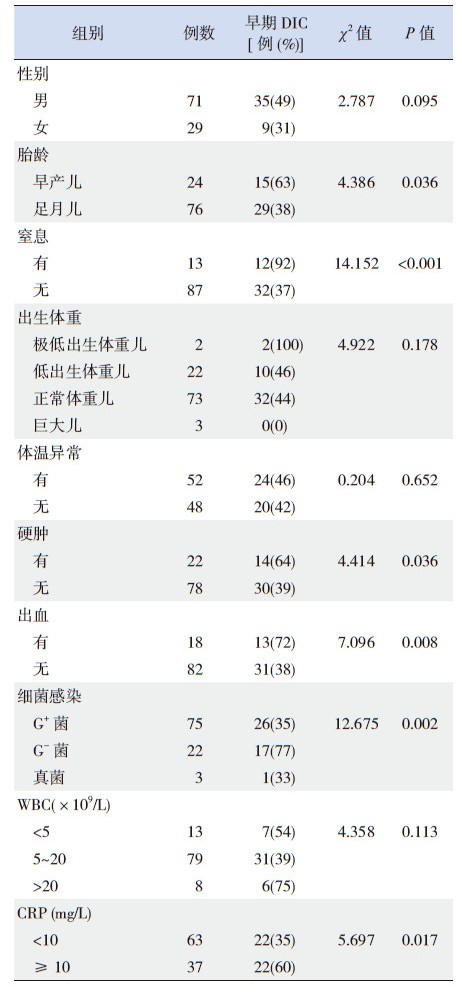
100例败血症患儿中合并早期DIC 44例,发生率44%,研究发现早产、窒息、硬肿、出血、G-菌感染、CRP≥10 mg/L与败血症合并早期DIC有关(P<0.05)。见表 3。
| 表 3 新生儿败血症合并早期DIC 相关因素分析 |
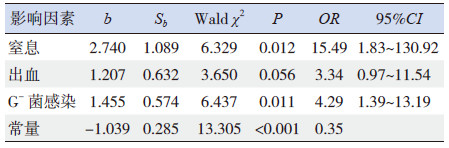
将上述有统计学意义的6个因素进行多因素logistic回归分析,发现窒息、出血及G-菌感染是新生儿败血症合并早期DIC的独立危险因素,见表 4。
| 表 4 新生儿败血症合并早期DIC 多因素Logistic 回归分析 |
新生儿凝血系统维持在低水平、脆弱的平衡状态,感染、缺氧、电解质紊乱等易打破这种平衡状态发生DIC[9]。新生儿败血症时更易发生DIC,并与病情严重程度成正比[10]。Oren等[11]对5535例住院患儿调查发现,DIC患儿中感染因素占95.2%。孟哲等[12]对43例DIC患儿分析,感染因素占46.5%。新生儿败血症合并DIC存在时病情凶险,确诊败血症合并早期DIC对患儿生存至关重要。
新生儿败血症临床表现极不典型,需密切观察其临床表现[13]。本研究中,败血症主要表现为反应差(69%)、拒乳(53%)、体温异常(52%)及黄疸(49%)。反应差是新生儿败血症早期敏感度最高、最有特异性的临床表现[14]。
本研究中早产儿败血症合并早期DIC发生率(63%)远高于足月儿(38%),早产儿体内VitK依赖的凝血因子(比如Ⅱ、Ⅶ、Ⅸ、Ⅹ等)及接触因子(比如Ⅺ、Ⅻ、前激肽释放酶及高分子量激肽原等)为成人50%[15]。早产儿胎龄越小越容易出现凝血功能紊乱[16]。早产儿免疫系统不成熟,无法启动保护性炎症反应易发生败血症[17],从而打破原来低水平的平衡产生DIC。
新生儿窒息时易合并DIC,窒息时D-二聚体、纤维蛋白原、纤维蛋白降解产物等明显升高[18]。窒息缺氧可激活内外源性凝血系统,抑制纤溶系统,导致DIC发生。本研究发现合并窒息者早期DIC的发生率为92%,而无窒息者仅为37%,logistic分析提示窒息是新生儿败血症合并早期DIC的危险因素。
有研究表明,重度硬肿患儿中出凝血功能障碍者可高达90%以上[19]。本研究中晚期DIC及早期DIC组中硬肿发生率分别为75%、32%,远高于凝血功能正常组(10%),而早期DIC组与晚期DIC组硬肿发生无统计学差异,考虑与下列原因有关:(1)本研究病例数较少;(2)DIC的发生受多种危险因素的影响,硬肿只是其中的危险因素之一,并不是决定因素。
不同细菌感染与败血症合并早期DIC有统计学意义。G-菌感染时新生儿败血症合并早期DIC的发生率为77%,logistic分析也表明G-菌感染更易发生DIC。内毒素血症时,通过激活凝血系统、抑制生理的抗凝系统及削弱纤溶系统,可导致广泛微血栓形成、出血及DIC[20]。
CRP为急性时相反应蛋白,败血症易并发全身炎症反应综合征(systemic inflammatory response syndrome, SIRS)[21],存在CRP的升高。SIRS中炎症介质、细胞因子打破凝血平衡,导致凝血、出血及DIC[22]。白细胞计数与新生儿败血症合并早期DIC无相关性,主要考虑以下原因:(1)本文数据资料有限,研究存在一定局限性,其他混杂因素可能影响计算结果;(2)新生儿免疫功能低下,严重感染者白细胞计数降低,并不是与感染的严重程度存在一致性;(3)新生儿败血症合并病毒感染时,白细胞升高并不显著。
综上所述,窒息、出血及G-菌感染是败血症合并早期DIC的独立危险因素。对于败血症患儿同时存在上述因素的,应积极监测凝血功能预防早期DIC进展为晚期DIC,降低败血症患儿病死率。
| [1] | Edmond K, Zaidi A. New approaches to preventing, diagnosing, and treating neonatal sepsis[J]. Plos Medicine, 2010, 7(3): 1-8. |
| [2] | Volante E, Moretti S, Pisani F, et al. Early diagnosis of bacterial infection in the neonate[J]. J Matern Fetal Neonatal Med, 2004, 16(2): 13-16. |
| [3] | 何颜霞. 脓毒症凝血功能紊乱与抗凝治疗进展[J]. 中国实用儿科杂志, 2011, 26(12): 914-916. |
| [4] | 乔凤伶, 冷平. 弥散性血管内凝血诊断标准研究进展[J]. 成都医学院学报, 2010, 5(4): 342-346. |
| [5] | 许靖, 潘新年. 新生儿弥漫性血管内凝血特征及诊断方法的进展[J]. 中华儿科杂志, 2013, 51(3): 227-230. |
| [6] | 苏磊, 彭娜, 唐丽群. 脓毒症时弥漫性血管内凝血的发病机制与临床进展[J]. 中华急诊医学杂志, 2012, 21(4): 345-350. |
| [7] | 中华医学会儿科学分会新生儿学组, 《中华医学会中华儿科杂志》编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. |
| [8] | 刘敏涓, 刘泽霖. 关于DIC 的定义、临床、实验室标准与其计分系统[J]. 血栓与止血学, 2002, 8(2): 85-86. |
| [9] | 赵捷, 庄思齐. 新生儿早期凝血分子标志物检测的临床意义[J]. 国际儿科学杂志, 2006, 33(1): 58-60. |
| [10] | 郝玲, 王娜. 败血症新生儿血栓调节蛋白和D- 二聚体的变化及意义[J]. 中国当代儿科杂志, 2013, 15(10): 841-844. |
| [11] | Oren H, Cingoz I, Duman M, et al. Disseminated intravascular coagulation in pediatric patients: clinical and laboratory features and prognostic factors influencing the survival[J]. Pediatr Hematol Oncol, 2005, 22(8): 679-688. |
| [12] | 孟哲, 李文益, 陈环, 等. 小儿弥散性血管内43 例临床分析[J]. 中国当代儿科杂志, 2002, 4(3): 1008-8830. |
| [13] | 王政力, 余加林. 新生儿败血症诊断新进展[J]. 中国当代儿科杂志, 2013, 15(3): 236-240. |
| [14] | Camacho-Gonzalez A, Spearman PW, Stoll BJ. Neonatal infectious diseases: evaluation of neonatal sepsis[J]. Pediatr Clin North Am, 2013, 60(2): 367-389. |
| [15] | Pichler E, Pichler L. The neonatal coagulation system and the vitamin K deficiency bleeding-a mini review[J]. Wien Med Wochenschr, 2008, 158(13-14): 385-395. |
| [16] | 杨璐, 李秋平, 许靖, 等. 不同胎龄新生儿凝血功能的临床研究[J]. 国际检验医学杂志, 2013, 34(16): 2078-2082. |
| [17] | Strunk T, Currie A, Richmond P, et al. Innate immunity in human newborn infants: prematurity means more than immaturity[J]. J Matern Fetal Neonatal Med, 2011, 24(1): 25-31. |
| [18] | Bauman ME, Cheung PY, Massicotte MP. Hemostasis and platelet dysfunction in asphyxiated neonates[J]. J Pediatr, 2011, 158(2 Suppl): e35-e39. |
| [19] | 郭铭玉, 郭杰, 高丽, 等. 新生儿硬肿症出凝血功能的变化及其临床意义[J]. 中国实用儿科杂志, 2000, 15(2): 95-96. |
| [20] | Levi M, van der Poll T. The role of natural anticoagulants in the pathogenesis and management of systemic activation of coagulation and inflammation in critically ill patients[J]. Semin Thromb Hemost, 2008, 34(5): 459-468. |
| [21] | Zeckey C, Andruszkow H, Neunaber C, et al. Protective effects of finasteride on the pulmonary immune response in a combined model of trauma-hemorrhage and polymicrobial sepsis in mice[J]. Cytokine, 2011, 56(2): 305-311. |
| [22] | Schroeder JE, Weiss YG, Mosheiff R. The current state in the evaluation and treatment of ARDS and SIRS[J]. Injury, 2009, 40(Suppl 4): S82-S89. |
 2015, Vol. 17
2015, Vol. 17