伴皮层下囊肿的巨脑性白质脑病(megalencephalic leukoencephalopathy with subcortical cysts, MLC)是van der Knaap等[1]于1995年首先描述的一种罕见的儿童期发病的空泡性白质脑病,该病显著特点为生后1年内头围显著增大、进行性运动功能障碍,头颅MRI扫描显示特征性的弥漫性脑白质受累肿胀,伴双侧额顶部、颞叶囊肿。MLC呈常染色体隐性遗传,2001年Leegwater等[2]将其致病基因定位于22q13.3的MLC1,2006年国内首次诊断并报告了MLC病例及其家系MLC1基因突变[3]。近年国内外研究表明临床诊断的MLC患者中约75%能检测到MLC1基因突变,临床表现为经典型,也被称为MLC1型MLC,中国人MLC1突变类型与其他国家地区可能不同[4, 5]。本研究采用聚合酶链反应(PCR)和DNA直接测序的方法,对2013年9月就诊于北京军区总医院附属八一儿童医院门诊的1个MLC患儿及家系成员进行了MLC1突变分析,以进一步了解中国人MLC的分子遗传学特征。
1 资料与方法 1.1 一般资料先证者,女,1岁1个月。因运动发育迟缓就诊。患儿系第1胎第1产,围生期无异常。生后4个月能竖头,6个月翻身,8个月可独坐,就诊时能扶站,不能独站,不能走。可说“爸爸、妈妈”等。无惊厥发作。家族史无特殊。体查:头围49.5 cm,前囟1 cm×1 cm。神志清楚,精神反应可,表情丰富,追视、追声好。无皮疹、黄染,皮纹正常。心肺腹未见异常。颅神经检查未见异常。四肢肌力5级,肌张力正常,双手持物未见抖动,四肢腱反射对称引出,双侧巴氏征阴性,脑膜刺激征阴性。血、尿、便常规未见异常,生化、肌酶、肝肾功能、血氨及尿代谢病筛查均未见异常。头颅MRI扫描显示双侧额、颞、顶、枕白质弥漫异常信号,双侧额顶部囊性变(图 1)。脑电图显示背景节律稍慢,额颞区见少量棘慢波发放。视觉、听觉诱发电位未见异常。患儿携带MLC1基因2个杂合突变(c.217G>A p.Gly73Arg、c.772-1G>C in IVS9-1),患儿的父亲及母亲均为c.772-1G>C in IVS9-1杂合突变携带者,先证者家系谱见图 2。
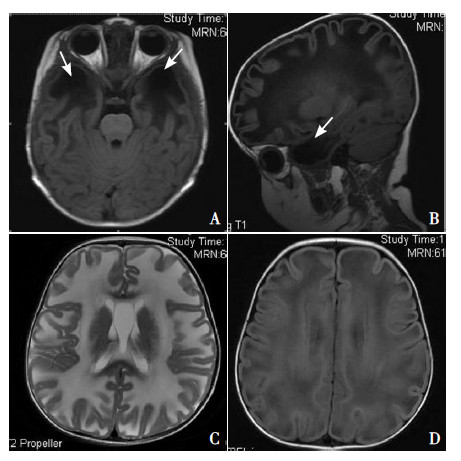 |
图 1 患儿头颅MRI 扫描结果 A: T1 横断位显示前额 及额顶部皮层下囊肿(箭头所指);B:T1 矢状位显示前额及额 顶部皮层下囊肿(箭头所指);C、D:大脑半球白质广泛性异常 伴轻度肿胀。 |
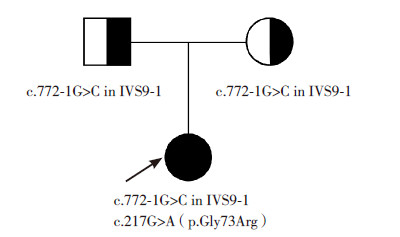 |
图 2 MLC 患儿家系谱
 先证者; 先证者;  男性携带
者; 男性携带
者; 女性携带者。先证者携带MLC1 基因2 个杂合突变:c.217G>A
(p.Gly73Arg)、c.772-1G>C in IVS9-1,患儿的父亲及母亲均为
c.772-1G>C in IVS9-1 杂合突变携带者。 女性携带者。先证者携带MLC1 基因2 个杂合突变:c.217G>A
(p.Gly73Arg)、c.772-1G>C in IVS9-1,患儿的父亲及母亲均为
c.772-1G>C in IVS9-1 杂合突变携带者。
|
在家属签署知情同意书后,采集患儿及其父母的外周血4 mL,盐析法抽提基因组DNA。50个与患儿无血缘关系的正常健康人,在签署知情同意书后,采集外周血并提取DNA。
1.3 引物设计与合成根据人类基因组数据库GenBank 中获得的MLC1基因序列(NM_015166),应用Primer5.0软件对所有外显子和内含子与外显子连接区域设计PCR扩增引物。
PCR扩增:PCR在10 μL反应体系中进行:2×GCⅠ缓冲液5 μL,5 mmol/L dNTP 0.5 μL,50 ng/μL正反向引物各0.5 μL,Tag DNA聚合酶1 U,100 ng/μL DNA 1 μL,加去离子水至10 μL。Touchdown PCR反应条件:94℃预变性5 min;94℃1 min,退火15 s,72℃延伸1 min,退火温度以高于最终温度6℃开始,每2个循环降低2℃,直至最终退火温度进行28个循环,共34个循环;最后72℃延伸5 min,4℃保存。取1 μL PCR产物以1%琼脂糖凝胶电泳,紫外灯下鉴定扩增结果,将目的片段纯化、测序。
1.4 测序反应及验证以PCR引物作为测序引物,委托北京诺赛基因组研究中心有限责任公司,用末端终止法在ABI 9700型热循环仪上进行测序反应,反应结束后,延伸产物在ABIPRISM3730型XL DNA序列分析仪上进行分析,对测序异常的片段重新进行PCR扩增,再次正、反向测序,以验证结果可靠性。
1.5 生物信息学分析应用DNAstar软件包中的SeqmanTM(Lasergene公司产品)软件进行序列对比分析。突变的命名参考GenBank中的cDNA序列(NM_015166.3)。
2 结果患儿1岁内出现头大、运动发育迟缓,头颅MRI扫描显示双侧额、颞、顶、枕白质弥漫异常信号,双侧额顶部囊性变,为经典型MLC。患儿MLC1基因扩增产物DNA直接测序结果发现了两个位点改变。第3外显子发现一个错义突变c.217G>A(p.Gly73Arg),遗传密码子由GGG变为GAG(图 3A),从而导致第73位甘氨酸被精氨酸替代(p.Gly73Arg,G73R)。另一个为剪接位点改变c.772-1G>C in IVS9-1(图 3B),第9内含子的剪接受位区最关键的核苷酸发生改变,可能导致其后的外显子剪接异常。先证者之父亲和母亲MLC1基因第3外显子第73位核苷酸未发现改变。但是存在与先证者相同的c.772-1G>C in IVS9-1改变。患儿父母均为正常临床表型的携带者。检测的50个正常健康人的MLC1基因未发现第3外显子第73位核苷酸及第9内含子的剪接受位区核苷酸的改变。
 |
图 3 先证者MLC1 测序结果 A:c.217 G>A (p.Gly73Arg) 突变, 箭头所指为突变位点;B:c.772-1G>C in IVS9-1 突变,箭头所指为突变位点。 |
van der Knaap等[5]推荐的MLC临床诊断标准:(1)出生后早期头围增大,以1岁以内最为明显。(2)早期发育多正常或轻度落后。(3)儿童早期或以后逐渐出现缓慢进展性运动功能恶化伴有小脑共济失调、肢体痉挛。智力倒退在病程晚期出现,而且进展缓慢,远比运动障碍轻。多数患儿有惊厥发作,但对抗惊厥药物反应良好。(4)神经系统体征主要为小脑性共济失调及继发的锥体系损伤。(5)典型的头颅MRI表现:大脑半球白质广泛性异常伴轻度肿胀,随着病情发展,白质肿胀消失后会出现脑萎缩;前额及额顶部皮层下囊肿,皮层下囊肿可扩大及增多;中央白质结构包括胼胝体和内囊及脑干虽不完全正常但较其他结构保存相对完好。本例患儿出生后到1岁内发现巨颅,存在轻度运动发育迟缓,头颅MRI扫描显示MLC特征性改变,可临床诊断MLC。本例患儿就诊较早,未出现惊厥,但脑电图已经显示癎样放电,后期可能出现癫癎发作,需要随访。
MLC1基因突变分析可协助诊断MLC,且对于MLC的遗传咨询、产前诊断及了解MLC1蛋白功能相当重要。MLC1基因组DNA全长约20 Kb,包含12个外显子,编码含377个氨基酸的MLC1蛋白,包含8个跨膜功能区,该蛋白在脑内表达较高,主要位于脑内血管周围、室管膜下及软膜下星形胶质细胞的突触末端,MLC1蛋白异常有可能通过影响星形胶质细胞钙波传递参与了细胞内外稳态的平衡[6, 7]。人类基因突变数据库(Human Gene Mutation Database)中报道的与MLC相关的MLC1突变有100余种。我国Wang等[4]对13个符合MLC临床诊断的患者进行MLC1基因突变筛查,应用Western blot及免疫化学方法进行突变功能研究。发现10例突变,其中7种为新的突变类型。5种新的错义突变(c.65G>A,p.R22Q;c.218G>A,p.G73E;c.823G>A,p.A275T;c.832T>C,p.C278R;c95C>T,p.A32V),一种新的剪接突变IVS9-1G>C,已报道的一种无义突变(c.594delCTCA,p.Y198X)与2种错义突变(c.206C>T,p.S69L;c.353C>T,p.T118M)。本例患儿亦发现了c.772-1G>C in IVS9-1,引起第9内含子剪接受位的AG突变为AC,进行家系分析显示突变来源于父母,患儿父母为突变的杂合子,无MLC临床症状,为MLC携带者。结合文献报道[3, 4],推测c.772-1G>C in IVS9-1有可能为中国MLC患者的热点突变。本例患儿另一突变为第3外显子c.217G>A(p.Gly73Arg),氨基酸序列保守性分析显示,第73位的甘氨酸在人类、大鼠、小鼠间高度保守,同时突变的氨基酸的理化特性也发生改变,即从甘氨酸转变为精氨酸。家系分析显示第3外显子的错义突变为自身突变。检测了50个正常健康人的MLC1基因,未发现第3外显子第73位核苷酸的改变。我们对人类基因组数据库(http://www.hgmd.cf.av.uk/)以及近期国际文献进行检索,未见c.217G>A(p.Gly73Arg)突变的报告,表明这是国际上尚未报道的突变类型。无论从碱基改变所处位置、类似突变病例报告以及本家系患者和携带者基因传递方式等各方面都表明,c.772-< span class="char-style-override-1">1G>C in IVS9-1和c.217G>A(p.Gly73Arg)两种突变均为致病突变,本例患儿同时携带MLC1的2个杂合突变从而致病。
研究表明20%的MLC患者则是由肝细胞黏附分子HEPACAM(称为HEPACM-相关的MLC)突变导致,郭芒芒等[8]分析一个MLC1基因突变阴性的MLC患者家系HEPACAM基因突变,先证者携带2个杂合突变,其c.203A>T(p.K68M)突变来自母亲,c.395C>A(p.T132N)突变来自父亲,其父母均为正常表型的携带者。对于临床诊断MLC而MLC1基因突变阴性者可考虑进行HEPACAM基因突变分析。
MLC目前尚无根本治疗方法,主要为对症治疗,若存在癫癎发作应用抗癫癎药物,早期进行肢体功能及言语训练可提高患儿发育水平。有关MLC长远预后报道较少,Koyama等[9]报道1例日本女性MLC患者,已经54岁,伴有智力下降、痉挛步态、共济失调。对于MLC先证者的家庭应该进行遗传咨询,尽可能对其家庭成员进行MLC1基因突变分析确定携带者,根据遗传规律预测患病风险,进行产前诊断。吴维青等[10]于国内首次对1个MLC家系进行遗传分析并对高危胎儿进行了产前诊断。通过MLC1基因突变分析对该病进行产前诊断有望进一步发展。
| [1] | van der Knaap MS, Barth PG, StroinkH, et al. Leukoencephalopathy with swelling and a discrepantly mild clinical course in eight children[J]. Ann Neurol, 1995, 37(3): 324-334. |
| [2] | Leegwater PA, Yuan BQ, van der Steen J, et al. Mutations of MLC1 ( KIAA0027), encoding a putative membrane protein, cause megalencephalic leukoencephalopathy with subcortical cysts[J]. Am J Hum Genet, 2001, 68 (4): 831-838. |
| [3] | 蔚洪恩, 姜玉武, 王静敏, 等. 巨脑性白质脑病伴皮层下囊肿一家系MLC1 基因突变分析[J]. 实用儿科临床杂志, 2006, 21(21): 1497-1499. |
| [4] | Wang J, Shang J, Wu Y, et al. Identification of novel MLC1 mutationgs in Chinese patients with megalencephalic leukoencephalopathy with subcortical cysts (MLC)[J]. J Hum Genet, 2011, 56(2): 138-142. |
| [5] | van der Knaap MS, Lai V, Kohler W, et al. Megalencephalic leukoencephalopathy with cysts without MLC1 defect[J]. Ann Neurol, 2010, 67(6): 834-837. |
| [6] | De Keyser J, Mostert JP, Koch MVV. Dysfunctional astrocytes as key players in the pathogenesis of central nervous system disorders[J]. J Neuro Sci, 2008, 267(1-2): 3-16. |
| [7] | 王静敏, 姜玉武, 吴希如. 巨脑性白质脑病伴皮层下囊肿 MLC1 基因突变对星形胶质细胞功能的影响 [J]. 生理科学进展, 2010, 41(1): 69-71. |
| [8] | 郭芒芒, 姜玉武, 谢涵, 等. 伴皮层下囊肿的巨脑性白质脑病一家系HEPACAM 基因突变分析[J]. 中华儿科杂志, 2012, 50(12): 895-898. |
| [9] | Koyama S, Kawanami T, Arawaka S, et al. A Japanese adult case of megalencephalic leukoencephalopathy with subcortical cysts with a good long-term prognosis[J]. Intern Med, 2012, 51(5): 503-506. |
| [10] | 吴维青, 谢建生, 韩春锡, 等. 一个巨脑性白质脑病伴皮层下囊肿家系遗传分析及产前诊断[J]. 中华医学遗传学杂志, 2011, 28(6): 616-619. |
 2015, Vol. 17
2015, Vol. 17


