2. 兰州大学第一医院传染科, 甘肃 兰州 730000
乙型肝炎由乙型肝炎病毒(hepatitis B virus, HBV)感染引起、以肝脏炎性病变为主的传染性疾病,是全球重要的公共卫生问题之一。全球每年约有4亿人感染HBV病毒,其中约1百万人因感染HBV发展为肝癌后死亡[1]。南非、太平洋以及亚洲是HBV流行的主要区域,而我国更是HBV高发的地区之一[1],约有四分之三的患者在儿童时期就感染了HBV。乙型肝炎所引起的许多肝外表现主要有感觉运动的减退(5%)、干燥综合征(3%)、肌肉痛(3%)、肾小球肾炎(3%)和关节痛(3%)[2]。
乙型肝炎病毒相关性肾炎(hepatitis B virus-associated glomerular nephritis, HBV-GN)是指由HBV直接或间接诱发的肾小球肾炎,中国西北地区是HBV感染的高发区,HBV-GN是临床常见病,也是继发性肾小球肾炎的主要病因之一[3]。近10年间中国、日本、韩国的科学家在HBV-GN的发病机制和治疗上做出了巨大的贡献[4]。本研究通过对41例HBV-GN患儿血清标本进行基因分型、cccDNA检测,分析了HBV-GN不同基因型之间临床及病理特征的差异。
1 资料与方法 1.1 研究对象根据住院的先后顺序选择同时行肝穿和肾穿的41例HBV-GN患儿,其中男23例,女18例,平均年龄11±6岁,为甘肃省人民医院儿科和兰州大学第一医院感染科2009年4月至2013年4月住院患儿。乙型肝炎的诊断标准符合2010年《慢性乙型肝炎防治指南》[5]。所有患儿均排除其他肝炎病毒感染、自身免疫性肝病、药物性肝损害及酒精性肝损害等。HBV-GN的诊断标准根据1990年世界卫生组织的分类标准[6],肾病的诊断由病理学检查证实。
1.2 肾脏活检病理学检查经皮肤肾脏穿刺取肾脏组织,取得的肾小球分别行光镜、免疫荧光(包括IgG,IgA,IgM,C3,HBsAg)、电镜检查。
1.3 肝脏活检病理学检查在B超引导下行肝穿采集肝组织标本进行病理活检,均行两点穿刺,要求每条肝组织长度>1.0 cm,肝组织经固定、脱水、石蜡包埋、切片后,进行苏木精-伊红(HE)染色及网状纤维染色,光镜下进行组织学观察,按 2000年全国病毒性肝炎学术会议修订的标准,将肝组织炎症分为 G0~G4 级,纤维化分为 S0~S4期。
1.4 HBV-DNA基因分型留取晨空腹静脉血5 mL,3 000 r/min离心10 min吸取1~2 mL血清在 -70℃冰箱保存备用,采用HBV基因分型诊断试剂盒(PCR荧光法),试剂盒由上海克隆生物高技术有限公司提供,实验步骤严格按照试剂说明书进行。
1.5 HBV cccDNA检测采用PCR荧光分子信标技术检测HBV cccDNA。于清晨用一次性注射器采血,分离血清200 μL保存于 -18℃备检,具体的检测方法及阳性判断见文献[7]。
1.6 统计学分析采用SPSS 16.0统计软件进行统计学分析,计数资料以例数和百分率(%)表示,组间比较采用卡方检验。P<0.05为差异有统计学意义。
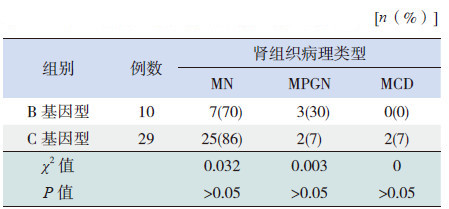
2 结果 2.1 患儿肾组织病理类型41例HBV-GN患儿中,肾穿刺的肾小球数为4~19个(平均10±6个),其中肾小球数6个以上的有36例 (87%),其余5例中,2例有4个肾小球,2例有3个肾小球,1例有2个肾小球。肾脏穿刺活检结果显示,32例为膜性肾病(MN),5例为膜增生性肾炎(MPGN),4例为微小病变性肾炎(MCD)。
2.2 患儿的基因型分布41例患儿中,以C、B基因型为主,其中C基因型29例(71%),B基因型10例(24%),B/C混合型2例(5%),未检出非B/C型。
2.3 B、C基因型患儿间肾组织病理类型分布的比较卡方检验显示,B、C基因型患儿间肾组织病理类型分布差异无统计学意义(表 1)。
| 表 1 B、C 基因型患儿肾组织病理类型的比较 |
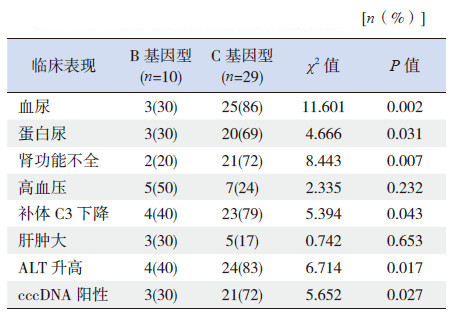
C基因型患儿的血尿、蛋白尿、补体C3下降、谷丙转氨酶(ALT)升高及肾功能不全发生率均显著高于B基因型,但高血压、肝肿大阳性率两者比较差异无统计学意义;C基因型患儿HBV cccDNA阳性比例高于B基因型患儿(表 2)。
| 表 2 B、C 基因型患儿临床表现等的比较 |
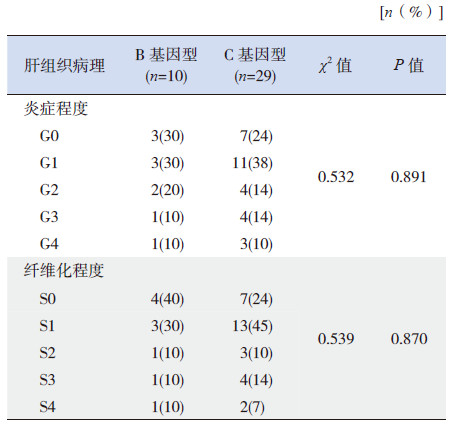
B和C基因型患儿肝组织炎症程度分级和纤维化程度分期比较差异均无统计学意义(P>0.05),见表 3。
| 表 3 B、C 基因型患儿炎症程度和纤维化程度的比较 |
中国西北地区是HBV感染高发区,HBV感染除引起肝脏组织本身的病变外,HBV-GN则是 HBV 感染的重要肝外表现之一,临床危害较大[8]。有关HBV-GN发病机制的研究表明,患者在遗传易感基因的背景下,免疫功能紊乱导致 HBV 免疫复合物清除障碍是其中的重要环节,除HBV直接感染肾脏外,还有细胞免疫、自身免疫、遗传及社会生物学因素等学说[9]。但因缺乏理想的细胞模型和动物模型,故目前HBV-GN发病机制的研究仍较为局限。根据孙永红等[10]及雷小燕等[11]对成人和儿童基因型的研究,HBV基因型对于乙肝患者临床分度、治疗效果、临床转归均有一定影响。本研究调查了HBV-GN患儿的基因型分布,结果显示,在41例HBV-GN患儿中,C型、B型、B/C型、非B/C型所占比例分别为为71%、24%、5%、0,其中C基因型为优势基因型,与甘肃省成人及儿童乙肝基因型分布基本一致[10],其中B/C混合型占有一定比例,考虑可能是重叠感染或基因之间部分转换而来,此次没有检测到非B/C型,可能与样本量较小有关。
中国自然人群中 HBV 携带率为10%,HBV 感染者肾小球肾炎的发生率为6.8%~20.0%[12],HBV-GN成为临床较常见的继发性肾脏病[10]。HBV-GN的病理类型多样化,其肝组织及肾组织病理改变不一定呈平行关系[13]。本研究显示,HBV-GN患儿肾组织病理类型以MN为主,MPGN、MCD占有较小的比例,与国内相关报道基本一致[14]。在儿童中,最常见的病理类型是MN,可能是因为儿童免疫系统尚未发育健全,免疫复合物沉积较成人多,而成人中肾组织 HBV抗原以单项抗原沉积为主。雷晓燕等[15]在研究儿童乙型肝炎T细胞亚群时发现,免疫功能缺陷可能为 HBV-GN 的发病机制之一。
本研究显示,儿童HBV-GN常见的病理类型是MN,常见基因型为C基因型,其次是B基因型。C、B基因型患儿间肾组织病理类型差异无统计学意义,是否与样本量较小有关有待扩大样本量进一步研究。但本研究结果显示,C基因型患儿血尿、蛋白尿、补体C3水平下降及肾功能不全发生率均高于B基因型患儿,说明C基因型的患儿更容易发生肾脏损伤,即早期对乙肝患儿进行乙肝基因型的检测将有利于及时发现HBV-GN,为患儿早期治疗创造机会。雷晓燕等[11]研究显示,C基因型患者存在较早出现肝功能损害及肝酶增高的现象,且在肝脏损伤较重的患者中,C基因型患儿所占比例较高。但有关这种基因分布与肾脏损伤病情轻重的关系却尚未见报道。本研究对HBV-GN患儿的基因型与临床特点的分析发现,HBV-GN C基因型患儿临床肝损害程度和ALT升高发生率显著高于B基因型组的患儿,以上结果提示HBV基因型与疾病的活动性、病情的轻重和HBV-GN的发生可能有一定关系。
HBV cccDNA存在于肝细胞核内,是病毒成功感染肝细胞的标志,也是患者体内持续病毒复制的标志。孙永红等[7]的研究表明,随着乙肝患者病情加重,HBV cccDNA检出率增加;C基因型患儿HBV cccDNA检出率高于B基因型,说明乙肝病毒复制和基因型呈相关性,然而,HBV-GN 患者中是否存在类似关系尚无研究报道。已研究证明HBV-GN的发病机制是HBV抗原抗体形成的免疫复合物,在肾小球某些部位沉积而致病[16]。最近还有研究显示,HBV可能直接感染肾脏而致病,并证实HBV在肾组织,特别是在肾小管上皮细胞中存在并复制[17]。本研究发现,C基因型HBV-GN患儿cccDNA阳性率高于B基因型,表明C基因型加上HBV-DNA高复制的患儿更易发生HBV-GN。提示临床上对于儿童期乙肝患儿,如果是C基因型,病毒高复制,应尽早抗病毒治疗,以防HBV-GN的发生。
本研究还表明,HBV-GN患儿B、C基因型与肝组织炎症及纤维化之间无相关性,因HBV-GN患儿肝损伤主要原因为HBV长期复制引发了针对病毒抗原的一系列免疫应答;肝脏损伤是多因素影响的结果,包括病毒异质性、复制水平、宿主感染时间及免疫功能、免疫遗传的异质性、非特异性炎症应答的强度和广度等。因此尽管B、C基因型患儿在病情轻重、病毒复制方面有差异,但它们在反映肝细胞的损伤程度方面无差异,可能缘于肝纤维化的程度与肝细胞坏死程度及肝脏炎症持续时间有关,它是继发于各种形式慢性肝损伤之后组织修复过程中的代偿反应。
| [1] | Hepatitis B vaccination coverage among adults-United States 2004. Centers for Disease Control and Prevention (CDC)[J]. MMWR Morb Mortal Wkly Rep, 2006, 55(18): 509-511. |
| [2] | Cacoub P, Saadoun D, Bourliere M, et al. Hepatitis B virus genotypes and extrahepatic manifestations[J]. J Hepatol, 2005, 43(5): 764-770. |
| [3] | 孙利, 徐虹, 周利军, 等. 接种乙型肝炎疫苗对儿童乙型肝炎病毒相关性肾炎患病的影响[J]. 中华儿科杂志, 2003, 41(8): 666-669. |
| [4] | Xu G, Huang T. Hepatitis B virus-associated glomerular nephritis in East Asia progress and challenges[J]. Eur J Intern Med, 2011, 22(2): 161-166. |
| [5] | 中华医学会肝病学分会, 中华医学会感染病学分会. 慢性乙肝防治指南[J]. 中国医学前沿杂志, 2011, 3(1): 66-82. |
| [6] | 周万忠, 张瓦利. 乙型肝炎病毒相关性肾炎[J]. 中华内科杂志, 1990, 29(9): 530-533. |
| [7] | 孙永红, 雷晓燕, 杨菊兰, 等. 儿童乙型肝炎血清HBV cccDNA 及病毒基因型研究[J]. 中华流行病杂志, 2011, 32(12): 1247-1249. |
| [8] | Zeng CH, Chen HM, Wang RS, et al. Etiology and clinical characteristics of membranous nephropathy in Chinese patients[J]. Am J Kidney Dis, 2008, 52(4): 691-698. |
| [9] | 何平, 冯国和. 乙型肝炎病毒相关性肾炎中病毒直接损伤肾组织作用机制研究现状[J]. 中华传染病杂志, 2012, 30(2): 123-125. |
| [10] | 孙永红, 陈青锋, 袁宏, 等. 乙型肝炎病毒基因型与临床病理分级分期的关系[J]. 临床荟萃, 2008, 23(8): 566-568. |
| [11] | 雷晓燕, 孙永红, 杨菊兰, 等. 儿童乙型肝炎病毒基因型与临床分度的关系研究[J]. 中国实用儿科杂志, 2011, 26(4): 296-298. |
| [12] | 徐虹. 儿童乙型肝炎病毒相关性肾炎的流行病学[J]. 实用儿科临床杂志, 2008, 23(5): 323-325. |
| [13] | 党西强, 易著文, 何小解, 等. 乙型肝炎病毒相关性肾炎患儿的肝脏病变[J]. 中国当代儿科杂志, 2006, 8(4): 275-278. |
| [14] | 周建华. 肝炎病毒相关性肾炎的发病机制与病理特点[J]. 临床内科杂志, 2010, 27(9): 581-584. |
| [15] | 雷晓燕, 孙永红, 袁宏, 等. 儿童乙型肝炎T 细胞亚群与病毒复制肝功能及组织病理关系研究[J]. 中国实用儿科杂志, 2012, 27(8): 595-598. |
| [16] | Lin CY, Lin CC, Chang GJ, et al. Defect of cell-mediated immune response against Hepatitis B virus: an indication for pathogenesis of Hepatitis-B-associated membranous nephropathy[J]. Nephron, 1997, 76(2): 176-185. |
| [17] | 王志敏, 李志强, 庞自峰, 等. 乙肝病毒相关性肾炎外周血单个核细胞因子的变化及其对大鼠蛋白尿的影响[J]. 中华儿科学杂志, 2001, 39(8): 489-490. |
 2015, Vol. 17
2015, Vol. 17