2. 杭州市中医院儿科, 浙江 杭州 310007;
3. 浙江大学医学院附属儿童医院消化科, 浙江 杭州 310003
幼年特发性关节炎(juvenile idiopathic arthritis, JIA)是一组以慢性关节滑膜炎为主要特征的最为常见的儿童风湿性疾病,也是儿童残疾的重要原因之一[1]。其确切病因至今未明,可能与遗传、免疫紊乱和环境因素相关[1, 2, 3]。近年来发现维生素D(VitD)不仅可调节体内钙磷代谢,还具有免疫调节作用,与多种自身免疫疾病如系统性红斑狼疮、类风湿性关节炎等相关[4]。25羟维生素D3 [25-hydroxyvitamin D3, 25(OH)D3 ]是VitD的主要产物,可反映体内活性VitD的绝对含量[5]。国外已有VitD参与JIA发病机制的研究报道,关于VitD补充疗法是否对JIA具有治疗作用也是目前临床研究的焦点,但尚存在争议[6, 7]。至今国内未见有关VitD含量与JIA关系的文献。本研究对我院确诊为JIA的53例患儿的临床资料进行回顾性分析,探讨VitD含量与JIA发病、疾病活动度及严重度的关系,旨在为JIA的诊治提供依据。
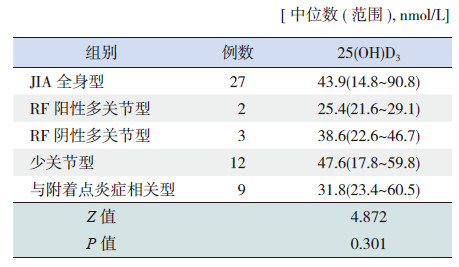
1 资料与方法 1.1 研究对象研究对象为2013年1月至2014年3月在我院风湿免疫变态反应科住院并确诊为JIA的53例患儿,收集其临床资料并进行回顾性分析,包括患儿一般信息及添加VitD和钙剂情况、体重指数、JIA发病季节、临床亚型、疾病活动度等。JIA诊断及分型均符合2001年国际风湿病联盟(ILAR)关于JIA诊断及分型标准[2],并经随访至少6个月确诊。其中JIA全身型27例,类风湿因子(RF)阳性多关节型2例,RF阴性多关节型3例,少关节型12例,与附着点炎症相关型9例。
排除标准[7]:(1)近3个月使用任何剂量的激素、补充VitD和钙剂;(2)伴有其他疾病(1型糖尿病、炎症性肠病、乳糜泻、免疫缺陷);(3)怀孕;(4)近2周有感染史。
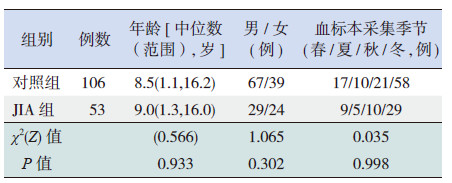
106名同期健康体检儿童作为对照组。对照组儿童与JIA组儿童年龄、性别分布差异无统计学意义(表 1)。
| 表 1 JIA 组和对照组一般资料的比较 |
获研究对象家长知情同意后,JIA组在入院当天、对照组在就诊时抽取静脉血2 mL,离心3 min,收集分离血清置-70℃冰箱保存。两组血标本采集季节分布差异无统计学意义(表 1)。采用酶联免疫法检测血清25(OH)D3 水平,按照说明书进行操作(试剂盒购自英国IDS Ltd公司)。依据血清25(OH)D3 水平评估VitD水平[8, 9, 10]:<25 nmol/L(<10 ng/mL)为严重缺乏; 25 nmol/L~(10 ng/mL~)为缺乏;50 nmol/L~(20 ng/mL~)为不足;≥75 nmol/L(≥30 ng/mL)为充足。
1.3 JIA疾病活动度的评价采用ACR Pediatric 30 进行JIA疾病活动度的评价,评价体系包括6个方面:(1)活动性关节炎的关节数目;(2)活动受限的关节数目;(3)医生通过视觉类比量表(Visual Analogue Scale)对患者疾病总体状况的评分;(4)患儿或家长通过视觉类比量表对目前疾病总体状况的自我评价;(5)采用儿童健康问卷调查(Childhood Health Questionnaire)进行功能性能力评价;(6)实验室炎症指标:红细胞沉降率、C反应蛋白[1, 2]。
1.4 统计学分析采用SPSS 19.0统计软件对数据进行统计学处理与分析。计数资料用例数和百分率表示,组间比较采用χ2检验;计量资料以中位数和范围表示,组间比较采用非参数检验;多因素分析采用多元线性回归分析。P<0.05为差异有统计学意义。
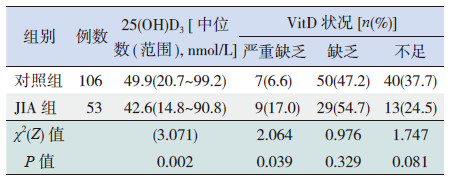
2 结果 2.1 两组间血清25(OH)D3水平及VitD状况的比较与对照组比较,JIA组患儿血清25(OH)D3 水平明显减低,差异有统计学意义(表 2);JIA组VitD严重缺乏儿童比例明显高于对照组,差异有统计学意义(表 2)。
| 表 2 两组血清25(OH)D3 水平及VitD 状况的比较 |
JIA各亚型患儿间血清25(OH)D3 水平比较差异无统计学意义(表 3)。
| 表 3 JIA 组各亚型血清25(OH)D3 水平的比较 |
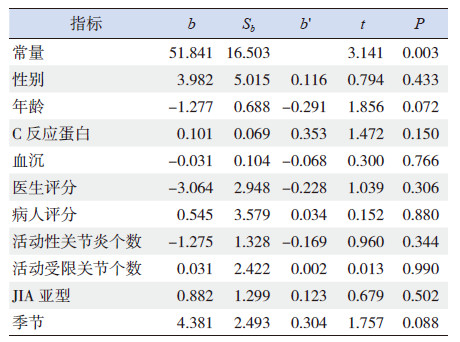
将JIA组患儿的性别、年龄、C反应蛋白、血沉、医生评分、病人评分、活动性关节炎个数、活动受限关节个数、JIA亚型、季节因素纳入,进行多元线性回归分析,模型筛选采用逐步回归法,最后无一个因素进入回归方程(表 4)。
| 表 4 JIA 组患儿血清25(OH)D3 水平影响因素的多元线 性回归分析 |
本研究显示,与对照组比较,JIA组儿童血清25(OH)D3 水平明显减低,JIA组VitD严重缺乏儿童比例明显高于对照组。儿童是VitD缺乏的高危人群,VitD缺乏可致骨性和非骨性并发症。近年研究发现VitD不仅影响钙磷代谢,而且具有广泛的生理作用,是维持人体健康发育必不可少的物质[4, 5, 10, 11, 12]。VitD影响免疫炎症,参与免疫性疾病致非骨性并发症,如VitD抑制多发性硬化相关自身免疫反应,骨化三醇预防给药可以使大鼠实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis, EAE)发病高峰延迟,出现症状后给药则能减轻EAE病情,其作用可能通过改变共刺激分子表达、增加调节性T细胞(Treg)的比例以及增强IL-4的分泌能力等实现[13]。还有研究发现,VitD可影响多种免疫细胞及细胞因子,尤其是减少Th17细胞产生细胞因子,阻止Th1,促进Th2细胞因子产生,促进Th1向Th2转化;阻止B细胞的增殖分化来增加凋亡等,进而可能与类风湿性关节炎的发生发展相关[14, 15, 16, 17]。关于儿童JIA与VitD水平相关性研究相对较少,二者的相关性至今尚无统一结论。尽管Munekata等[18] 的研究结果未能显示JIA患儿存在血清25(OH)D3水平下降,但是,Nisar等[6]对19篇文献的JIA患儿血清25(OH)D3水平进行Meta分析,显示82%患儿存在VitD不足。Pelajo等[8]对154例JIA儿童研究发现其中VitD缺乏为13%,VitD不足为42%。Bouaddi等[19]的研究也显示,JIA患儿血清25(OH)D3水平低于正常儿童,VitD 缺乏占30%,VitD 不足占45%。
全身型、多关节型(RF阳性或阴性)、少关节型和与附着点炎症相关型是JIA常见亚型,关于VitD水平与JIA各亚型之间的差异,Nisar等[6]显示VitD水平以全身型JIA最低,多关节型与少关节型之间差异无统计学意义。Szymanska等[7]研究发现VitD与JIA亚型无相关性。本研究结果显示,血清25(OH)D3 水平从低到高依次为RF阳性多关节型、与附着点炎症相关型、RF阴性多关节型、全身型、少关节型,但各型之间差异无统计学意义。Gibson 等[20]研究显示VitD结合蛋白(vitamin D binding protein isoforms)可作为预测儿童关节炎进展的指标。
关于VitD水平是否与JIA严重度及疾病活动性相关,虽然也是研究者关注的热点,但至今尚无统一定论。Bouaddi等[19]研究显示VitD水平与多关节型及单关节型患儿DAS28评分呈负相关。Pelajo等[8]对154例JIA患儿研究采用JADAS-27评价,发现VitD水平与JADAS-27无相关性。本研究采用用多元线性回归分析,未发现VitD水平与JIA分型、严重度及疾病活动性等相关。由于相关文献较少,病例数有限,而且评价标准不同,故结论尚有待统一标准进一步临床研究、尤其是临床多中心研究。
综上所述,JIA患儿存在VitD水平缺乏或不足,低水平VitD与JIA的发生有一定相关性,推测VitD补充可能有助于疾病的恢复。VitD含量的检测可能有助于JIA的诊断,但与JIA亚型、疾病严重度及活动性无相关性。
| [1] | 郭莉, 卢美萍, 汤永民, 等. 新发活动期全身型幼年特发性关节炎血清细胞因子水平分析[J]. 中国当代儿科杂志, 2014, 16(12): 1241-1244. |
| [2] | Petty RE, Southwood TR, Manners P, et al. International League of Associations for Rheumatology classification of juvenile idiopathic arthritis: second revision, Edmonton, 2001[J]. J Rheumatol, 2004, 31(2): 390-392. |
| [3] | 中华医学会儿科学分会免疫学组,《中华儿科杂志》编辑委员会. 幼年特发性关节炎(多/少关节型)诊疗建议[J]. 中华儿科杂志, 2012, 50(1): 20-26. |
| [4] | Arnson Y, Amital H, Shoenfeld Y. Vitamin D and autoimmunity: new aetiological and therapeutic considerations[J]. Ann Rheum Dis, 2007, 66(6): 1137-1142. |
| [5] | Misra M, Pacaud D, Petryk A, et al. Vitamin D deficiency in children and its management: review of current knowledge and recommendations[J]. Pediatrics, 2008, 122(2): 398-417. |
| [6] | Nisar MK, Masood F, Cookson P, et al. What do we know about juvenile idiopathic arthritis and vitamin D? A systematic literature review and meta-analysis of current evidence[J]. Clin Rheumatol, 2013, 32(6): 729-734. |
| [7] | Szymanska KJ, Biernacka ZM, Stanczyk J. Vitamin D level in children with juvenile idiopathic arthritis and its correlation with clinical picture of the disease[J]. Reumatologia, 2013, 51(4): 271-276. |
| [8] | Pel a jo CF, Lopez-Beni t e z JM, Ken t DM, et a l . 25-Hydroxyvitamin D levels and juvenile idiopathic arthritis: Is there an association with disease activity?[J]. Rheumatol Int, 2012, 32(12): 3923-3929. |
| [9] | Dawson-Hughes B, Heaney RP, Holick MF, et al. Estimates of optimal vitamin D status[J]. Osteoporos Int, 2005, 16(7): 713- 716. |
| [10] | Holick MF. Resurrection of vitamin D deficiency and rickets[J]. J Clin Invest, 2006, 116(8): 2062-2072. |
| [11] | Holick MF. Vitamin D deficiency[J]. N Engl, 2007, 357(3): 266- 281. |
| [12] | 王晓燕, 金春华, 吴建新, 等. 血清25- 羟维生素D 在佝偻病诊断中的应用价值[J]. 中国当代儿科杂志, 2012, 14(10): 767-770. |
| [13] | 焦卓敏, 富羽弘, 张凤, 等. 1,25二羟基维生素D3 缓解急性实验性自身免疫性脑脊髓炎的机制[J]. 中华神经科杂志, 2008, 88(33): 2350-2354. |
| [14] | Dankers W, van Hamburg JP, Mus AM, et al. 1,25(OH)2D3 inhibits Th17 cytokine production and ROR gamma t expression through GATA3/IL4-dependent and -independent mechanisms[J]. Arthr Rheumat, 2013, 65(10): S302-S302. |
| [15] | Ranganathan P, Khalatbari S, Yalavarthi S, et al. Vitamin D deficiency, interleukin 17, and vascular function in rheumatoid arthritis[J]. J Rheumatol, 2013, 40(9): 1529-1534. |
| [16] | Reed A, Haugen M, Pachman LM. Abnormalities in serum osteocalcin values in children with chronic rheumatic disease[J]. J Pediatr, 1990, 116(4): 574-580. |
| [17] | Drozdenko G, Heine G, Worm M. Oral vitamin D increases the frequencies of CD38+ human B cells and ameliorates IL-17- producing T cells[J]. Exp Dermatol, 2014, 23(2): 107-112. |
| [18] | Munekata RV, Terreri MT, Peracchi OA, et al. Serum 25-hydroxyvitamin D and biochemical markers of bone metabolism in patients with juvenile idiopathic arthritis[J]. Braz J Med Biol Res, 2013, 46(1): 98-102. |
| [19] | Bouaddi I, Rostom S, El Badri D, et al. Vitamin D concentrations and disease activity in Moroccan children with juvenile idiopathic arthritis[J]. BMC Musculoskel Dis, 2014, 15: 115. |
| [20] | Gibson DS, Newell K, Evans AN, et al. Vitamin D binding protein isoforms as candidate predictors of disease extension in childhood arthritis[J]. J Proteomics, 2012, 75(17): 5479-5492. |
 2015, Vol. 17
2015, Vol. 17