新生儿呼吸窘迫综合征(neonatal respiratory distress syndrome, NRDS)又称肺透明膜病,是由于肺表面活性物质(pulmonary surfactant, PS)缺乏及肺结构发育不成熟所致,多见于早产儿,临床表现为进行性呼吸困难的综合征象,是严重威胁新生儿生命的常见急重症。既往认为早产是PS缺乏的最主要因素,但是临床上发现一些足月新生儿也会发生致死性NRDS。最近越来越多的研究证实ABCA3基因缺陷而引起的PS失衡是致死性NRDS的一个重要致病因素[1, 2, 3]。现已发现多种与NRDS相关的ABCA3突变,由于不同的ABCA3突变通过不同的途径影响ABCA3蛋白的功能,而且其对疾病发展和预后的影响也存在差异,因此研究不同突变体的功能及其对疾病发展和转归的影响意义重大。构建突变体的真核表达载体,建立突变基因表达的细胞模型是研究突变体功能的一种重要方法,同时可以在此基础上进行药物研究,为个体化治疗提供依据。本研究选择了ABCA3基因的两个错义突变E292V和M723I为研究对象,构建E292V和M723I两个突变体的真核表达载体,并使其在人肺腺癌(A549)细胞株中进行表达,以期为NRDS相关基因功能研究建立细胞模型,并为从基因水平探讨NRDS的发病机制奠定基础。
1 材料与方法 1.1 材料质粒PEGFP-C2和菌种E.coliDH5α由本实验室保存,感受态细菌自行制备。引物自行设计,由上海生工公司合成,DNA测序由上海生工测序部完成。EcoRI、SalI和T4 DNA连接酶购于Fermantas公司(立陶宛)。质粒抽提试剂盒是OMEGA公司(中国)产品,胶回收试剂盒购于TAKARA公司(日本)。A549细胞株购于江阴齐氏生物技术有限公司。DMEM细胞培养基和胎牛血清(FBS)购于昕泰生物科技公司。Lipofectamine 2000购于Invitrogen公司(美国)。
1.2 引物设计根据重叠延伸PCR定点诱变技术的原理,每个待突变位点需要合成4条引物,两条为引入突变所需引物,两条为外侧正、反向引物,分别引入限制性酶切位点EcoRI和SalI,因此共设计合成了6条引物,序列如下:E292V突变的邻近引物:F:5'-GAAGGAAAG
GAGGCTGAAGGTGTACATGCGC-ATGATGGGGCTCAGCAGCTGGCT-3',R:5'-CCC-CATCATGCGCATGTACACCTTCAGCC
TCCTTTCCT-TCTCCTGCACGACAG-3';M723I突变的邻近引物:F:5'-TGCTGACCACCCACTTCATAGACGAGGCT-GACCTGC
TGGGAGACCGCATCGC-3',R:5'-AGC-AGGTCAGCCTCGTCTATGAAGTGGGTGGTCAG-CACGATGGTGCGGTCACTT-3';外侧端引物:f:5'-GACTCAGATCTCGAGCTCAAGCTTCGAATTCA-TGGCTGTGCTCAGGCAGC-3',r:5'-CGGTGGAT-CCCGGGC
CCGCGGTACCGTCGACTCATCGCCCCT-CCTCTGCG-3'。
构建一个突变位点需要进行3次PCR反应。首先以外侧正向引物f与突变反向引物R作为上下游引物,以已构建的基础质粒pcDNA3.1-ABCA3为模板进行PCR扩增,扩增突变位点及上游DNA序列,同时以突变正向引物F与外侧反向引物r为上下游引物进行PCR扩增,扩增突变位点及下游DNA序列。PCR产物用琼脂糖凝胶电泳分离、胶回收试剂盒回收,分别获得DNA片段1和DNA片段2。第3次PCR反应以获得的DNA片段1和DNA片段2为模板,以外侧正、反向引物f和r为上下游引物进行扩增,得到含有突变点的ABCA3基因序列。对获得产物进行回收纯化,并测序。
1.4 克隆载体及绿色荧光表达载体的构建用EcoRI和SalI分别双酶切纯化的目的片段和绿色荧光载体PEGFP-C2,回收并提纯目的片段和PEGFP-C2载体的大片段,用T4DNA连接酶将其连接,涂布含卡那青霉素的LB固体平板培养基。14 h后,挑取菌落,过夜摇菌,提取质粒。用琼脂糖凝胶电泳及限制性酶切鉴定,然后将重组载体质粒送上海生工测序。
1.5 转染及转染后鉴定A549细胞用高糖DMEM(含10%FBS)培养,转染前1 d将A549细胞以适当的密度接种至6孔板中,待细胞达到80%~90%汇合。用250 μL Opti-MEM稀释4 μg质粒DNA,轻轻混合,取10 μL Lipofectamine 2000用250 μL Opti-MEM稀释并混合,室温孵育5 min;将Lipofectamine 2000混合物加入质粒DNA中混合,室温孵育20 min;将6孔板中的培养基以2 mL Opti-MEM取代,把Lipofectamine 2000和质粒DNA的混合物加入6孔板中,轻轻混匀,培养6 h后更换培养液,于转染48 h观察转染情况。
为了观察融合蛋白在细胞内的表达和定位,将A549细胞接种于预先经赖氨酸处理的盖玻片上,转染48 h后,弃去DMEM,PBS洗3遍,4%多聚甲醛固定20 min,PBS洗3次,用DIPA染核,将盖玻片置于载玻片上,用碳酸甘油封片,然后在激光共聚焦显微镜下观察蛋白的表达和定位。
2 结果 2.1 定点诱变结果重叠延伸PCR反应的片段长度测定结果与设计一致。其中ABCA3-E292V 的前2次PCR扩增DNA片段1和DNA片段2的长度分别为925 bp和4 292 bp,扩增产物经1%琼脂糖凝胶电泳显示如图 1A;ABCA3-M723I 的前2次PCR扩增DNA片段1和DNA片段2的长度分别为2 217 bp和2 997 bp,扩增产物经1%琼脂糖凝胶电泳显示如图 1B。第3次PCR扩增片段长度为5 177 bp,扩增产物经0.5%琼脂糖凝胶电泳显示如图 1C。
 |
图 1 PCR 扩增片段电泳图 A:构建突变点E292V 的前2 次PCR 结果:泳道1 为DNA 片段 1(f/R 扩增),泳 道2 为DNA 片段 2(F/r 扩增),泳道3 为5 000 bp DNA ladder。B:构建突变点M723I 的前2 次PCR 结果:泳道1 为DNA 片段 1(f/R 扩增),泳道2 为DNA 片段 2(F/r 扩增),泳道3 为5 000 bp DNA ladder。 C:泳道1 为E292V 的第3 次PCR 结果,泳道2 为M723I 的第3 次PCR 结果,均为f/r 扩增,泳道3 为10 000 bp DNA ladder。 |
构建的突变型目的基因的绿色荧光表达载体大小应为9.8 kb。用EcoRI和SalI对含目的基因的重组绿色荧光载体进行双酶切鉴定,经0.5%琼脂糖凝胶电泳显示如图 2,获得了长度为4.7 kb(载体片段长度)和5.1 kb(目的基因片段长度)的两条条带,初步证实成功获得含目的基因的重组子。对重组绿色荧光表达载体进行测序,显示成功获得了所需的点突变,且其他序列均无改变,见图 3。
 |
图 2 重组绿色荧光载体双酶切电泳结果 1:PEGFPC2- E292V 的限制性酶切结果;2:PEGFP-C2-M723I 的限制性酶切 结果;3:10 000 bp DNA ladder。 |
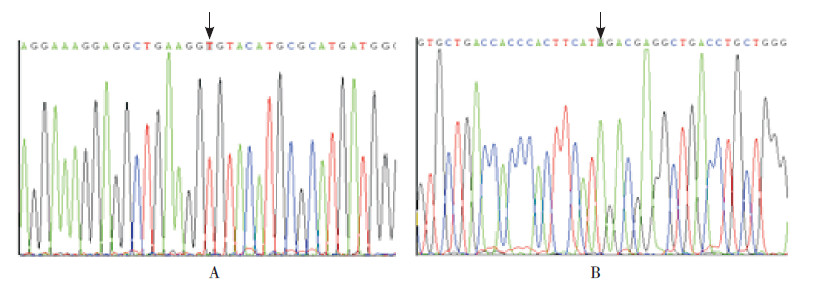 |
图 3 含突变位点的真核表达载体测序结果 A:E292V 突变体测序图,ABCA3 基因875 位碱基A 已突变为T; B:M723I 突变体测序图,ABCA3 基因2169 位碱基G 已突变为A。箭头指向为突变点位置。 |
重组真核表达载体PEGFP-C2-E292V和PEGFP-C2-M723I转染A549细胞后,培养48 h,在倒置荧光显微镜下可见细胞内绿色荧光信号,说明重组子在A549细胞内表达,转染效率在40%左右。见图 4。
 |
图 4 荧光显微镜下观察转染48 h 后的A549 细胞(×200) A~D 分别表示A549 细胞株未转染、转染 pcDNA3.1-ABCA3、PEGFP-C2-E292V 和PEGFP-C2-M723I 质粒48 h 后的观察结果。A、B 图未见绿色荧光,C、D 图可见融合 绿色荧光蛋白成功表达于A549 细胞。 |
在激光共聚焦显微镜下观察融合蛋白GFP-ABCA3的表达(图 5),野生型WT-GFP蛋白呈现小的环状,而突变蛋白E292V-GFP和M723I-GFP则以点状多见。观察结果初步提示c.875A>T和c.2169G>A突变对蛋白在A549细胞内的表达量影响甚微, E292V和M723I突变改变了蛋白的形态。
 |
图 5 激光共聚焦显微镜下观察转染48 h 后的A549 细胞(×1 000) |
ABCA3蛋白特异性地表达于人体肺泡Ⅱ型细胞,定位于溶酶体和板层小体膜上,研究提示它参与内源性脂质跨膜转运,在板层小体的形成、PS的合成及维持PS动态平衡过程中发挥重要作用[2, 4]。ABCA3基因缺陷可导致致死性NRDS和儿童间质性肺疾病[1, 3, 5, 6]。欧洲新生儿呼吸窘迫综合征防治指南2010版指出,呼吸支持和外源性PS替代疗法仍是目前主要的治疗措施[7]。ABCA3基因突变导致的NRDS常见于足月儿,对常规的治疗无明显效果,除了肺移植至今还没有任何特异的治疗[8]。
为了寻求有效的治疗靶点,国外研究者已从ABCA3基因突变导致NRDS的机制入手开始研究,并针对具体突变点的致病机制,在细胞水平筛选可能有治疗效果的药物。
ABCA3基因片段相对较大,发生突变的位点及种类多样,已发现的ABCA3基因突变有150多种,突变类型主要包括无义、插入、错义、移码和剪切位点突变[5]。Agrawal等[9]发现ABCA3内含子突变也可能导致呼吸相关疾病。不同的突变致病机制不同,现阶段研究提示主要的致病机制涉及功能缺失和转运障碍以及由其引起的内质网应激反应[10, 11]。
Cheong等[2]对ABCA3基因的3个错义突变L101P、N568D和G1221S进行研究结果显示,某些单个碱基突变可以改变ABCA3蛋白的定位,使其滞留于内质网,推测这与突变导致的蛋白质折叠转运障碍有关。应用药物分子伴侣4-苯基丁酸钠辅助蛋白质折叠,可以在细胞模型中纠正G1221S的定位,这为NRDS的治疗提供了新的方向。Weichert等[10]在对ABCA3突变体的研究中发现突变蛋白在内质网的滞留可以引起细胞凋亡增加,这可能与突变蛋白堆积引起的内质网应激,激活下游的凋亡通路有关,改善内质网应激从而预防凋亡的发生,可能作为疾病治疗的着手点。
M723I是本课题组在1例生后13 h死亡的NRDS患儿中发现的ABCA3基因第17号外显子错义突变,导致第723位蛋氨酸被异亮氨酸代替[3]。该点突变位于第一个核苷酸结合域,其所处的位点氨基酸序列高度保守,且氨基酸替代之后极性发生改变,推测该点突变对蛋白功能影响较大。为研究该点突变对蛋白功能的影响,在实验中构建了含M723I突变点的ABCA3基因绿色荧光表达载体,这也是该突变被发现以后首次被进一步研究。E292V是已经发现较常见的ABCA3基因的点突变,位于第9外显子,由第292位谷氨酸突变为缬氨酸,因为该突变已有过研究报道[12],故选择其作为对照进行研究。通过脂质体转染的方法将野生型和突变型基因转染至A549细胞进行表达,结果初步提示野生型和突变型蛋白都在细胞内表达,但突变影响了蛋白在细胞内的形态。在后续实验中需要对M723I突变致病机制进行探讨,根据相应致病机制,选择相关药物在细胞水平进行功能纠正研究,以期找到疾病治疗的有效药物。
综上所述,本研究应用重叠延伸PCR法构建了ABCA3基因的两个点突变E292V和M723I及其绿色荧光表达载体,使其在A549细胞株成功表达,为后续研究野生型与突变型ABCA3基因在细胞上的功能差异奠定基础。
| [1] | Shulenin S, Nogee LM, Annilo T, et al. ABCA3 gene mutations in newborns with fatal surfactant deficiency[J]. N Eng J Med, 2004, 350(13): 1296-1303. |
| [2] | Cheong N, Madesh M, Gonzales LW, et al. Functional and trafficking defects in ATP binding cassette A3 mutants associated with respiratory distress syndrome[J]. J Biol Chem, 2006, 281(14): 9791-9800. |
| [3] | 周熙惠, 惠智艳, 李媛, 等. 新生儿呼吸窘迫综合征abca3 基因遗传缺陷的研究[J]. 中华儿科杂志, 2012, 50(2): 111-116. |
| [4] | Cheong N, Zhang H, Madesh M, et al. Abca3 is critical for lamellar body biogenesis in vivo[J]. J Biol Chem, 2007, 282(33): 23811-23817. |
| [5] | Gonçalves JP, Pinheiro L, Costa M, et al. Novel ABCA3 mutations as a cause of respiratory distress in a term newborn[J]. Gene, 2014, 534(2): 417-420. |
| [6] | Flamein F, Riffault L, Muselet-Charlier C, et al. Molecular and cellular characteristics of ABCA3 mutations associated with diffuse parenchymal lung diseases in children[J]. Hum Mol Genet, 2012, 21(4): 765-775. |
| [7] | Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants - 2010 update[J]. Neonatology, 2010, 97(4): 402-417. |
| [8] | Hamvas A. Evaluation and management of inherited disorders of surfactant metabolism[J]. Chin Med J (Engl), 2010, 123(20): 2943-2947. |
| [9] | Agrawal A, Hamvas A, Cole FS, et al. An intronic ABCA3 mutation that is responsible for respiratory disease[J]. Pediatr Res, 2012, 71(6): 633-637. |
| [10] | Weichert N, Kaltenborn E, Hector A, et al. Some abca3 mutations elevate er stress and initiate apoptosis of lung epithelial cells[J]. Respir Res, 2011, 12: 4. |
| [11] | Matsumura Y, Ban N, Ueda K, et al. Characterization and classification of ATP-binding cassette transporter ABCA3 mutants in fatal surfactant deficiency[J]. J Biol Chem, 2006, 281(45): 34503-34514. |
| [12] | Matsumura Y, Ban N, Inagaki N. Aberrant catalytic cycle and impaired lipid transport into intracellular vesicles in ABCA3 mutants associated with nonfatal pediatric interstitial lung disease[J]. Am J Physiol Lung Cell Mol Physiol, 2008, 295(4): L698-L707. |
 2015, Vol. 17
2015, Vol. 17


