新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy, HIE)是围产期窒息缺氧导致的缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)性疾病。HIE不仅威胁着新生儿的生命,而且存活者可表现出运动发育障碍、脑瘫、癫癎等中枢神经系统异常表现[1, 2, 3]。其中海马位于大脑的缺血易感区,在缺血早期即可受到影响。
HIBD涉及复杂的病理过程,主要包括能力代谢障碍、细胞内钙超载、兴奋性氨基酸神经毒性、氧自由基的损伤、细胞凋亡[4]。针对这些发病机制的研究给临床治疗HIBD带来了重大进展,但仍缺乏特效治疗手段。研究表明,自噬在帕金森综合征、阿尔茨海默病、脑缺血再灌注损伤等方面起保护神经元的作用。而关于自噬在HIBD中的研究甚少,其在HIBD中的水平变化仍没有得到很好的认识。本实验拟通过构建大鼠HIBD模型,采用western blot法检测自噬相关蛋白的动态水平变化及雷帕霉素对自噬相关蛋白表达情况的影响,从而进一步了解缺氧缺血的发病机制,为HIE下一步临床治疗方案带来新的方向。
1 材料与方法 1.1 实验动物及分组取7日龄无特定病原体(Specific Pathogen Free, SPF)Sprague-Dawley大鼠108只,雌雄不限,体重11~14 g,由上海斯莱克实验动物有限责任公司购入[许可证SCXK(沪)2012-0002]。所有仔鼠均由母鼠自由哺乳。采用随机数字法分为假手术组、HIBD组和雷帕霉素组,每组36只。
1.2 实验试剂Beclin-1多克隆一抗(美国Cell Signal公司)、微管结合蛋白轻链3(microtubule-associated protein light chain 3, LC3)多克隆一抗(美国Cell Signal公司)、β-actin多克隆一抗(美国Santa Ctuz公司)、雷帕霉素(美国Selleckchem公司)、山羊抗鼠二抗(美国Santa Ctuz公司)、山羊抗兔二抗(联科生物技术公司)。
1.3 实验模型制备按照改良Rice法[5]制作HIBD大鼠模型:新生大鼠乙醚吸入麻醉后,行颈正中切口游离左侧颈总动脉并行双层永久性结扎,缝合切口,每只大鼠手术时间约3~5 min。手术结束后将大鼠放在37℃恒温箱中恢复2 h,然后置于37℃水浴箱中的密闭常压低氧舱,给予湿化的8%氮氧混合气(8%O2、92%N2)2 h。模型制作结束的时间点设为0 h,并放回母鼠身边自由哺喂。假手术组分离左侧颈总动脉但不予结扎,不行低氧处理;雷帕霉素组在模型制作前1 h予腹腔注射雷帕霉素(0.5 mg/kg),假手术组和HIBD组造模前予腹腔注射等量灭菌PBS溶液替代。
1.4 标本采集与处理按模型制作结束后的时间设0、6、12、24、48、72 h共6个时间点,各组分别选取6只大鼠取脑,冰上分离结扎左侧的海马组织,放入预冷的EP管后置于-80℃保存,用于western blot测定。
1.5 Western blot蛋白印记从-80℃超低温冰箱中取出保存的海马组织,裂解后取上清液,沸水浴中加热使蛋白变性;等量(10 μL)蛋白样本上样,采用70 V电压电泳,待蛋白到浓缩胶和分离胶交界处时改为90 V电压,使要检测蛋白到达最佳分辨区。转膜槽置于碎冰中降温,90 V恒压转膜1 h,取下膜后,5%脱脂奶粉封闭2 h,分别孵育Beclin-1、LC3一抗(1 : 2 000)、β-actin一抗(1 : 3 000),4℃过夜;弃去一抗液,TBST漂洗3次,每次10 min,加入1 : 4 000二抗摇床1 h,TBST洗膜后暗室曝光显影。用扫描仪获取图像,运用Image-Pro Plus 6.0图像分析软件分析各目的条带的灰度值。以Beclin-1、LC3-Ⅱ与β-actin的灰度值比值确定Beclin-1、LC3蛋白表达的相对水平。
1.6 统计学分析应用SPSS 17.0统计软件对数据进行统计学分析。正态分布计量资料用均数±标准差( x±s)表示,多组比较行单因素ANOVA分析,组间两两比较采用SNK-q检验;计数资料采用百分率(%)表示,多组比较采用卡方检验,P<0.05为差异有统计学意义。
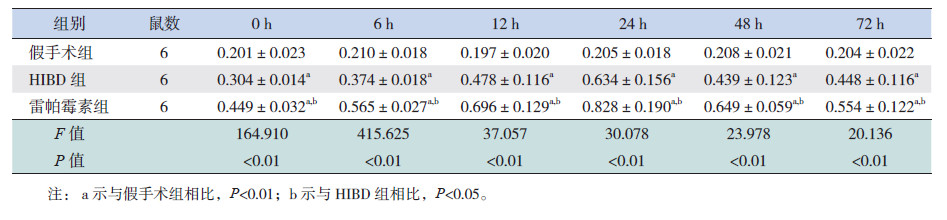
2 结果 2.1 大鼠海马组织Beclin-1表达的变化Beclin-1出现1条条带,位于60 kD。结果显示,各组在6个时间点的Beclin-1蛋白表达水平差异均有统计学意义(P<0.01)。与假手术组相比,HIBD组和雷帕霉素组在6个时间点的Beclin-1蛋白表达均明显升高,且均在24 h达到高峰(P<0.01);与HIBD组相比,雷帕霉素组在6个时间点的Beclin-1蛋白表达均明显升高(P<0.05)。见图 1,表 1。
 |
图 1 Western blot 法定量检测各组大鼠海马组织中Beclin-1 蛋白表达 |
| 表 1 各组大鼠海马组织Beclin-1 蛋白表达水平比较 |
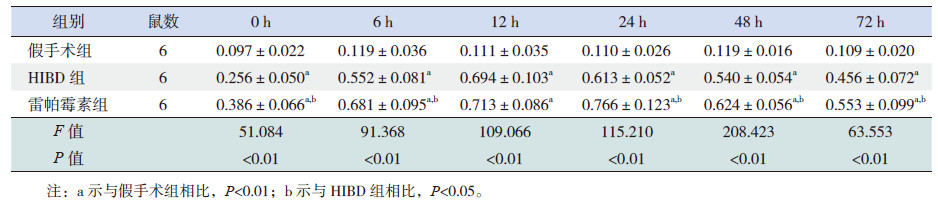
LC3出现2条条带,分别为14 kD(LC3-Ⅱ)和16 kD(LC3-Ⅰ),因LC3-Ⅱ蛋白检测在免疫印记试验中更加敏感,故选择LC3-Ⅱ蛋白水平代表LC3水平。结果显示:各组在6个时间点的LC3-Ⅱ蛋白表达水平差异均有统计学意义(P<0.01)。与假手术组相比,HIBD组和雷帕霉素组在6个时间点的LC3-Ⅱ蛋白表达均明显升高,HIBD组在12 h达到高峰,雷帕霉素组在24 h达到高峰(P<0.01);与HIBD组相比,除12 h时间点外,LC3-Ⅱ在雷帕霉素组的其余5个时间点表达均明显升高(P<0.05)。见图 2,表 2。
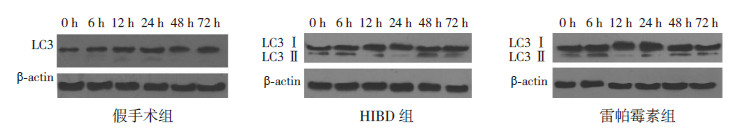 |
图 2 Western blot 法定量检测各组大鼠海马组织中LC3 蛋白表达 |
| 表 2 各组大鼠海马组织LC3-Ⅱ蛋白表达水平比较 |
HIE是临床围产期窒息缺氧导致的严重新生儿疾病,致残率及死亡率极高。HIE发病机制主要是脑血流量改变和脑组织代谢改变,可以引起大脑任何部位的损伤,而海马作为主要负责记忆和学习的功能区域,却位于大脑的缺血易感区,在缺血早期即可受到影响,故海马的保护至关重要。缺氧缺血损伤涉及复杂的病理过程,其中各个环节、各种影响因素的相互作用尚未完全阐明,故研究此类疾病的机制对进一步的临床治疗具有重要意义,近几年自噬被发现为缺氧缺血后的另一病理生理学改变。
Beclin-1和LC-3作为自噬相关蛋白,可在一定程度上反映自噬表达与强烈程度。Beclin-1是酵母自噬基因6(Ap96/Vps30)在哺乳动物中的同源物,它是自噬重要的正调节因子,其主要通过控制自噬体的形成,调节其他的自噬蛋白定位到前自噬体膜上,控制自噬体的形成,从而调节自噬活性,可以说在自噬起始阶段起重要作用[6, 7]。本实验显示假手术组6个时间点的Beclin-1蛋白在组织内表达水平较平稳,不存在明显差异;而HIBD组Beclin-1蛋白含量的表达却出现显著动态变化,在缺氧缺血模型制成后0 h起,Beclin-1蛋白表达即开始出现升高,至24 h达到峰值,且每个时间点与假手术组相比,差异均有统计学意义,表明HIBD组大鼠在接受缺氧缺血刺激后,机体处于应激状态并激发神经系统发生自噬。
LC3-Ⅱ也是自噬检测过程中常用的一种蛋白。LC-3是哺乳动物细胞中酵母ATG8基因的同源物,是自噬体膜的标记物。LC3有LC3-Ⅰ和LC3-Ⅱ两种形式,分别定位于前自噬体和自噬体膜表面,LC3-Ⅱ含量的多少在某种程度上反映了细胞的自噬活性,在免疫印记试验中,LC3-Ⅱ较LC3-Ⅰ更加敏感一些[8]。本实验在假手术组内各个时间点均有LC3-Ⅱ的低水平表达,趋势较稳定,且无显著性差异;而HIBD组LC3-Ⅱ蛋白表达自0 h起出现升高趋势,在12 h达到高峰,随后维持在较高水平,与假手术组的每个时间点相比,差异均有统计学意义。该数值的动态变化可以认为是自噬启动后胞质型LC3转位至自噬体膜并结合成为膜型LC3(即LC3-Ⅱ)的转变过程,是自噬活性增强的指标之一。以上结果表现与Carloni等[9]和Ginet等[10]的报道结果相吻合。
近年来发现哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种重要的信号转导分子,mTOR作为自噬的主要负调控者在蛋白合成以及自噬抑制中占据着中心的位置[11, 12],当细胞接受到外界刺激或营养缺乏时,mTOR活性受到抑制而自噬被激活。本实验应用雷帕霉素进行预干预,并对反映自噬活性的相关蛋白进行检测,实验结果发现,HIBD组与雷帕霉素组的Beclin-1蛋白自0 h起表达迅速升高,至24 h达到高峰,虽然两组表达趋势较一致,但雷帕霉素组在每个时间点的蛋白表达均高于HIBD组,差异有统计学意义。在LC3蛋白检测上,雷帕霉素组相比HIBD组在每个时间点均升高,除12 h这一点外,其他时间点差异均有统计学意义,这些都提示雷帕霉素增强了自噬这一现象。
同时本实验还发现雷帕霉素组的LC3-Ⅱ表达高峰相比HIBD组推迟至24 h,Beclin-1表达在HIBD组与雷帕霉素组只有表达量上的差别,而时间没有发生推迟。针对这种表达现象,可能原因考虑:(1)Beclin-1作为自噬的启动点,雷帕霉素在自噬起始后在每个时间点增强了自噬活性,从而导致后面的自噬标志物LC3表达量的增加。(2)雷帕霉素经腹腔注射后进入血液循环,再透过血脑屏障对神经细胞产生预刺激;雷帕霉素与mTOR受体结合后,产生抑制作用并激活自噬,从而使神经细胞自噬水平处于“高阈值”状态,故缺氧缺血改变引起自噬的刺激强度累积时间要长于正常自噬“阈值”状态,由此出现雷帕霉素组LC3-Ⅱ蛋白高峰推迟现象。
有报道自噬是细胞自我保护、自我更新的一种重要机制[13]。自噬发生时细胞如果应激不很强烈,细胞将试图通过激活自噬挽救途径来处理,细胞可能恢复,反之自噬持续循环进行,自噬水平超过细胞所承受的范围,细胞会严重“抽干”最终死亡。可以说自噬既可以作为一种防御机制来抵御环境变化对细胞造成的损伤,又可以诱导细胞主动性的死亡[14, 15]。这给我们一定提示:在病变早期激活自噬是否能在一定程度上上调自噬水平,发挥部分神经细胞保护作用,从而改善缺氧损伤后神经细胞的预后?这也是我们进一步要研究的问题。
总之,自噬参与到新生大鼠缺氧缺血的病理过程,并发生动态改变,雷帕霉素能增强这一过程,但是自噬早期是否对HIE起保护作用,或者通过干预自噬而减轻细胞死亡率,仍是下一步需待研究和解决的问题。
| [1] | Lai MC, Yang SN. Perinatal hypoxic - ischemic encephalopathy[J]. J Biomed Biotechnol, 2011, 2011: 609813. |
| [2] | 石晶, 熊英, 母得志. 新生儿缺氧缺血性脑病药物治疗临床证据[J]. 中国当代儿科杂志, 2009, 11(9): 740-744. |
| [3] | Perlman M, Shah PS. Hypoxic-ischemic encephalopathy: challenges in outcome and prediction[J]. J Pediatr, 2011, 158(2 Suppl): e51-e54. |
| [4] | Allen KA, Brandon DH. Hypoxic-ischemic encephalopathy: pathophysiology and experimental treatments[J]. Newborn Infant Nurs Rev, 2011, 11(3): 125-133. |
| [5] | Vannueei RC, Vannucci SJ. Perinatal hypoxic-isehemic brain damage: evolution of an animal model[J]. Dev Neurosci, 2005, 27(2-4): 81-86. |
| [6] | Deatrick KB, Luke CE, Elfline MA, et al. The effect of matrix metalloproteinase 2 and matrix metalloproteinase 2/9 deletion in experimental post-thrombotic vein wall remodeling[J]. J Vasc Surg, 2013, 58(5): 1375-1384. |
| [7] | Rami A, Langhagen A, SteigerS. Focal cerebral ischemia induces upregulation of Beclin 1 and autophagy-like cell death[J]. Neurobiol Dis, 2008, 29(1): 132-141. |
| [8] | Kabeya Y, Mizushima N, Yamamoto A, et al. LC3, GABARAP and GATE16 localize to autophagosomal membrane depending On form-II formation[J]. J Cell Sci, 2004, 117(13): 2805-2812. |
| [9] | Carloni S, Girelli S, Scopa C, et al. Activation of autophagy and Akt/CREB signaling play an equivalent role in the neuroprotective effect of rapamycin in neonatal hypoxiaischemia[ J]. Autophagy, 2010, 6(3): 366-377. |
| [10] | Ginet V, Puyal J, Clarke PGH, et al. Enhancement of autophagic flux after neonatal cerebral hypoxia-ischemia and its regionspecific relationship to apoptotic mechanisms[J]. Am J Pathol, 2009, 175(5): 1962-1974. |
| [11] | Jung CH, Ro SH, Cao J, et al. mTOR regulation of autophagy[J]. FEBS Lett, 2010, 584(7): 1287-1295. |
| [12] | 张秀春, 李丹妮, 李丰. 自噬的调控通路和肿瘤[J]. 生命科学, 2011, 23(1): 19-25. |
| [13] | Coto-Montes A, Boga JA, Rosales-Corral S, et al. Role of melatonin in the regulation of autophagy and mitophagy: a review[J]. Mol Cell Endocrinol, 2012, 361(1/2): 12-23. |
| [14] | 邱冬梅, 陈莉. 细胞自噬: 病理学研究的新热点[J]. 临床与实验病理学杂志, 2012, 28(3): 309-313. |
| [15] | Uchiyama Y, Koike M, Shibata M. Autophagic neuron death in neonatal brain ischemia/hypoxia[J]. Autophagy, 2008, 4(4): 404- 408. |
 2015, Vol. 17
2015, Vol. 17