新生儿败血症是新生儿时期严重疾病,出生体重越轻,发病率越高,极低出生体重儿败血症发生率可高达16.4%,长期住院者更可高达30%[1]。在新生儿感染性疾病中革兰阳性球菌是重要病原菌,国外资料显示新生儿血行感染凝固酶阴性葡萄球菌所致者呈增多趋势,居新生儿细菌感染首位[2]。万古霉素是治疗耐甲氧西林葡萄球菌的首选药物[3]。利奈唑胺(linezolid)是第一个应用于临床的新型噁唑烷酮类抗生素,由于其独特的作用部位和方式,细菌对其不易产生耐药性,临床主要用于治疗多重耐药的革兰阳性球菌感染,特别是对万古霉素耐药的肠球菌、多重耐药的肺炎球菌、对甲氧西林耐药的金黄色葡萄球菌(MRSA)及表皮葡萄球菌引起的医院内感染[4]。自利奈唑胺上市10余年来,其疗效已经得到了临床的研究证实,但其在儿科特别是新生儿科应用的报道较少[5]。本研究回顾性分析了近2年来我院应用利奈唑胺治疗万古霉素治疗无效的14例新生儿败血症的有效性及安全性,现报道如下。
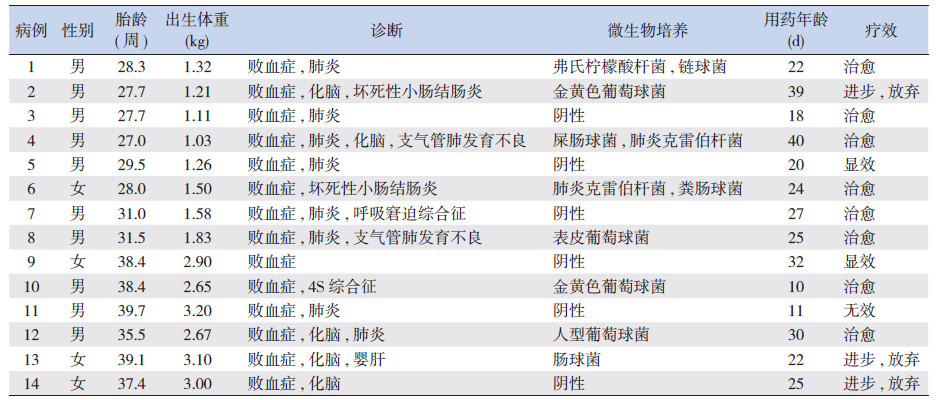
1 资料与方法 1.1 研究对象选择2012年6月至2014年3月我院新生儿科住院的新生儿败血症患儿14例,其中男10例,女4例,平均胎龄33±5周 (范围27.0~39.7周),出生体重2.0±0.8 kg(范围1.03~3.2 kg)。其中早产儿9例(64%),极低出生体重儿5例。使用利奈唑胺时平均年龄为25±6 d(范围10~40 d)。14例败血症患儿中,合并化脓性脑膜炎5例,重症肺炎8例,坏死性小肠结肠炎2例,4S综合征1例,无合并症的单纯败血症1例。痰培养或血培养阳性8例,主要为革兰阳性球菌感染。14例患儿一般资料见表 1。
| 表 1 患儿一般资料 |
纳入标准包括:(1)符合新生儿败血症临床诊断标准[6];(2)使用万古霉素治疗无效后改用利奈唑胺治疗。
1.3 治疗方法所有患儿均采用针对革兰阳性菌和阴性菌的联合治疗,开始均使用万古霉素和美洛培南或头孢哌酮舒巴坦抗感染,在使用万古霉素无效(平均用药4~10 d,感染症状和炎性指标无改善)或血培养为耐万古霉素革兰阳性菌后改用利奈唑胺[商品名为斯沃,美国辉瑞制药有限公司生产,规格包括注射液(600 mg/瓶)和片剂(100 mg/片)],剂量为10 mg/kg,q8h。10例采用口服给药,4例先采用静脉注射给药,3~5 d后改为口服序贯给药。总疗程为7~21 d。同时继续使用前述抗阴性菌为主的抗生素,并辅以营养补液和对症支持治疗。片剂分装成每份20 mg,使用前稀释成混悬液(20 mg/5 mL)。
1.4 疗效判定标准根据《抗菌药物临床研究指导原则》[7]分为4个等级:治愈、显效、进步、无效。(1) 治愈:病情好转,临床症状基本消失,检查未见异常;(2)显效:病情好转,临床症状大部分消失,检查中有1 项未完全恢复正常;(3) 进步:病情得到控制,但效果不明显,临床症状依然存在;(4) 无效:病情无明显变化或者有加重趋势。痊愈和显效合计为有效,进步和无效判定为无效。总有效率=(治愈+显效)/总例数×100%。
1.5 安全性评价在用药期间,检测血常规、肝肾功能、皮疹、呕吐、腹泻等发生情况,按照不良反应发生及与药物因果关系分为有关、很可能有关、可能有关、可能无关及无关,前三者计为药物不良反应。
1.6 统计学分析采用SPSS 17.0 统计软件对所得数据进行统计学分析,计量资料用均数±标准差( x±s) 表示,治疗前后的比较采用配对t检验;计数资料以率(%)表示。P<0.05 为差异有统计学意义。
2 结果 2.1 临床疗效单纯败血症及合并非化脓性脑膜炎患儿使用利奈唑胺治疗的疗程为7~14 d,合并化脓性脑膜炎者疗程为14~21 d,平均疗程12±4 d。8例治愈(57%),显效2例(14%),治疗进步后自动出院3例(21%),无效1例(伴重症肺炎,后诊断为巨细胞病毒感染,相应治疗后恢复出院),总有效率为71%(表 1)。细菌培养转阴率为75%(2例痰培养未转阴)。
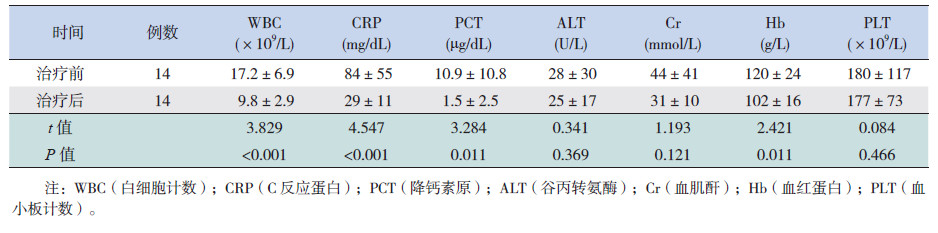
利奈唑胺疗程结束后,患儿血C反应蛋白(CRP)、降钙素原(PCT)水平及白细胞计数均显著下降,与治疗前比较差异有统计学意义(P<0.01),见表 2。
| 表 2 治疗前后炎性指标及肝肾功能等的变化 |
利奈唑胺用药期间,14例患儿中2例出现贫血,2例贫血较治疗前加重,未见血小板减少、肝肾功能损害加重、皮疹及听神经病变等不良反应,见表 2。
3 讨论有研究回顾性调查了108例(其中早产儿27 例)德国和奥地利的儿童患者使用利奈唑胺治疗革兰阳性菌感染的情况,调查显示70% 的患者可达到较满意的疗效[8],国内目前仅见王晓雷等[9]报道使用利奈唑胺成功治疗30例新生儿耐药革兰阳性球菌败血症。本研究选择我院住院的严重感染新生儿,初始选用万古霉素治疗无效后改用利奈唑胺针剂抗革兰阳性菌感染治疗,总有效率达71%,细菌培养转阴率达75%,说明利奈唑胺对于治疗耐药革兰阳性球菌感染导致新生儿败血症临床疗效好,细菌清除率高。本组14例患儿中早产儿9例,极低出生体重儿5例,合并化脓性脑膜炎5例,绝大多数病人的感染被成功控制。文献报道,利奈唑胺具有强大的组织穿透性,能快速分布至不同的脏器组织,在几乎全身器官都能达到有效的治疗浓度[10, 11],新生儿特别是早产儿的脑脊液中可能有较高的药物浓度[12]。
Langgartner等[12]荟萃文献,提出有12 个案例报道总共26 例新生儿患者使用利奈唑胺成功控制了感染,均为糖肽类药物治疗失败的革兰阳性菌感染。Deville等[8]前瞻性研究分析利奈唑胺和万古霉素治疗新生儿耐药或疑似耐药革兰阳性菌感染的临床疗效,结果显示利奈唑胺在疗效方面等同于万古霉素,并且药物不良反应发生少。本研究中14例新生儿均为使用万古霉素疗效不佳,改用利奈唑胺抗革兰阳性菌感染,结果显示10例新生儿的严重感染得到了有效控制。
利奈唑胺是唯一具有100%口服生物利用度和高度的组织穿透力的抗革兰阳性菌药物,口服给药也能有效控制敏感菌引起的各种感染[11],但目前国内尚未见在新生儿中使用口服利奈唑胺的报道。本组新生儿患者大多采用片剂口服,或短期静脉给药后口服序贯给药至疗程结束,结果显示其疗效不亚于王晓蕾等[9]报道的静脉给药疗效。
文献报道,细菌对利奈唑胺耐药的自然发生率很小,同时具有较小的肾毒性[8]。也有报道其不良反应较万古霉素重[13],其不良反应包括皮疹、恶心、腹泻、神经症状、血液毒性如胆红素升高及贫血和血小板减少症等。本组病例中8例患儿为早产低出生体重儿,在用药中仅有3例患儿出现贫血或原有贫血加重,没有观察到其他血液学、生化检验及临床症状相关的不良反应,显示出新生儿对该药有较好的耐受性;而贫血原因考虑主要与感染严重及早产或出生低体重有关。
综上所述,利奈唑胺对新生儿感染的临床疗效好,不良反应少,是治疗新生儿严重感染,特别是对万古霉素耐药或合并肾功能不全的严重感染新生儿的较好选择。
| [1] | 邵肖梅, 叶鸿瑁, 丘小汕, 等. 实用新生儿学[M]. 北京: 人民卫生出版社, 2012: 340-347. |
| [2] | Kocher S, Muller W, Resch B. Linezolid treatment of nosocomial bacterial infection with multiresistant Gram-positive pathogens in preterm infants: a systematic review[J]. Int J Antimicrob Agents, 2010, 36(2): 106-110. |
| [3] | Welsh KJ, Abbott AN, Lewis EM. Clinical characteristics, outcomes, and microbiologic features associated with methicillin-resistant Staphylococcus aureus bacteremia in pediatric patients treated with vancomycin[J]. J Clin Microbiol, 2010, 48(3) : 894-899. |
| [4] | 崔向丽, 赵志刚. 新型噁唑烷酮类抗生素利奈唑胺[J]. 中国新药杂志, 2008, 17(6): 530-532. |
| [5] | Garazzino S, Tovo PA. Clinical experience with linezolid in infants and children [J]. J Antinicrob Chemother, 2011, 66 (S4): 23-41. |
| [6] | 中华医学会儿科学分会新生儿学组, 中华医学会中华儿科杂志编辑委员会. 新生儿败血症诊疗方案[J]. 中华儿科杂志, 2003, 41(12): 897-899. |
| [7] | 卫生部抗生素临床药理基地. 抗菌药物临床研究指导原则[J]. 中国临床药理学杂志, 1987, 3(2): 126-130. |
| [8] | Deville JG, Adler S, Azimi PH, et al. Linezolid versus vancomycin in the treatment of known or suspected resistant Grampositive infections in neonates[J]. Pediatr Infect Dis J, 2003, 22(9): S158-S163. |
| [9] | 王晓蕾, 孙海滨, 陈桃英, 等. 利奈唑胺治疗新生儿耐药革兰氏阳性球菌败血症临床分析[J]. 中国儿童保健杂志, 2013, 21(2): 213-214. |
| [10] | Boselli EP. Pharmacokinetics and intrapulmonary concentrations of linezolid administered to critically ill patients with ventilator associated pneumonia[J]. Crit Care Med, 2005, 33(7) : 1529- 1534. |
| [11] | Dryden MS. Linezolid pharmacokinetics and pharmacodynamics in clinical treatment[J]. J Antimicrob Chemother, 2011, 66 (Suppl 4): iv7-iv15. |
| [12] | Langgartner M, Mutenthaler A, Haiden N, et al. Linezolid for treatment of catheter-related cerebrospinal fluid infections in preterm infants[J]. BMJ Case Rep, 2009, 11(5): 1217. |
| [13] | Falagas ME, Siempos II, Vardakas KZ. Linezolid versus glycopeptides or beta-lactam for treatment of Gram-positive bacterial infections: meta-analysis of randomized controlled trials [J]. Lancet Infect Dis, 2008, 8 (1) : 53-66. |
 2015, Vol. 17
2015, Vol. 17