新生儿呼吸窘迫综合征(NRDS)是新生儿 期危重症之一,也是新生儿尤其是早产儿死亡的 重要原因之一[1]。近年来,随着医疗技术的逐渐 提高、机械通气的普遍开展及肺泡表面活性物质 (PS)的广泛使用,大大提升了极低出生体重儿 的存活率[2-3]。然而,持续机械通气及给氧成为 NRDS 进展为支气管肺发育不良(BPD)的危险 因素[4]。目前使用PS 作为替代治疗已取得一定疗 效。但是,仍有相当部分患儿发展为BPD,肺功 能不同程度受损,生存质量严重下降。近年来研 究证实,血清中的炎症因子、细胞因子、蛋白和 酶的变化,对早期预测和评估早产儿NRDS 的预 后有一定意义[5]。转化生长因子-β1(transforming growth factor-β1,TGF-β1) 与骨形态发生蛋白-7 (bone morphogenetic protein -7,BMP-7) 同属于 TGF-β 超家族的成员,二者在多种炎症中均参与了 疾病的发生发展,可通过体内一系列信号转导影 响并导致急慢性肺损伤[6]。富建华等[7] 研究发现 TGF-β1 能够上调肺成纤维细胞中结缔组织生长因 子(connective tissue growth factor,CTGF)基因表达, 从而导致肺纤维化的发生。有研究认为,BMP-7 在肺的过敏性炎症反应中起着积极的作用,可以 拮抗TGF-β1 的致纤维化作用[8]。目前有关TGF-β1 及BMP-7 与NRDS 的相关关系研究甚少。本研究 对NRDS 患儿血清中TGF-β1 及BMP-7 的表达与 NRDS 的关系及其预后进行分析,以期为临床早期 防治提供线索。 1 资料与方法 1.1 研究对象
收集2012 年3 月至2014 年2 月我院住院治 疗的胎龄28~32 周存活的早产儿,排除宫内感染、 湿肺、吸入性肺炎及致死性先天畸形如中枢神经 系统畸形、膈疝、呼吸系统畸形、严重先天性心 脏病(室间隔缺损、房间隔缺损或动脉导管未闭 除外)、染色体异常。入选条件为:(1)胎龄 ≤ 32 周,生后12 h 内住院;(2)符合NRDS 诊 断标准[9],并具有以下特征:①早产儿,生后6 h 内出现进行性呼吸困难;②胸片变化,选择Ⅱ级 及以上改变者;③血气分析为低氧血症和(或) 高碳酸血症;(3)需要机械通气者。
本研究共纳入60 例NRDS 患儿,其中32 例 出生后12 h 内给予PS 的NRDS 患儿作为PS 组, 28 例因家庭经济条件困难未接受PS 治疗的NRDS 患儿作为非PS 组,其他治疗均无差异。另取同期 30 例无NRDS 早产儿作为对照组。
PS 组中男22 例,女10 例;胎龄30.6±1.4 周; 体重1.3±0.3 kg;入院时平均出生时间3.5±1.0 h; 自然分娩8 例,剖宫产24 例。非PS 组中男20 例, 女8 例;胎龄31.2±0.8 周;体重1.3±0.5 kg;入 院时平均出生时间4.2±1.2 h;自然分娩10 例, 剖宫产18 例。对照组中男21 例,女9 例;胎龄 32±0.5 周;体重1.6±0.4 kg;入院时平均出生时 间4.6±1.4 h;自然分娩6 例,剖宫产24 例。3 组 之间性别、胎龄、年龄、体重及出生方式差异均 无统计学意义(P>0.05)。本研究获得医院医学伦 理委员会批准及家长书面知情同意。 1.2 标本采集
所有患儿分别于生后 0、1、3、7 d 各抽取静 脉血3 mL,分别用于检测TGF-β1 和BMP-7 含量。 1.3 血清BMP-7 和TGF-β1 的检测
采用酶联免疫吸附法(ELISA),标本储存和 检测步骤严格按照试剂盒说明书操作。TGF-β1 试 剂盒购自上海富众生物科技发展有限公司,BMP-7 试剂盒均购自上海研晶科技有限公司。 1.4 统计学分析
采用SPSS 17.0 统计软件进行分析。数据以 均数± 标准差(x±s)表示,多组间比较采用单 因素方差分析(ANOVA),组间两两比较采用 SNK-q 检验。P<0.05 为差异有统计学意义。 2 结果 2.1 各组血清TGF-β1 的含量
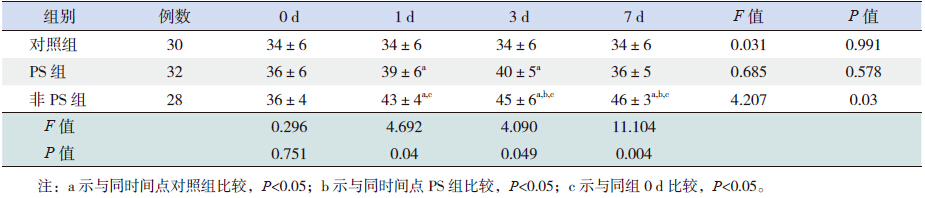
对照组各时间点TGF-β1 有轻度表达,组内各 时间点比较差异无统计学意义(P>0.05);PS 组 TGF-β1 含量生后1、3 d 高于对照组(P<0.05), 生后7 d 较前下降,与对照组相比差异无统计学意 义(P>0.05);非PS 组TGF-β1 含量随着日龄的增加, 表达逐渐增加,在生后1、3、7 d 明显高于对照组 (P<0.05),生后3、7 d 明显高于PS 组(P<0.05)。 见表 1。
| 表 1 各组患儿不同时间点血清中TGF-β1 的表达 |
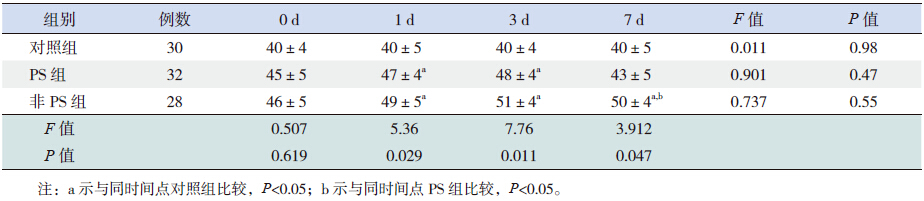
对照组各时间点BMP-7 有轻度表达,组内各 时间点比较差异无统计学意义(P>0.05);PS 组 BMP-7 生后3 d 达高峰,7 d 较前有明显恢复,生 后1、3 d 高于对照组(P<0.05); 非PS 组生后 3 d BMP-7 表达达高峰,生后7 d 较前稍有恢复, 但恢复较慢,生后1、3、7 d 高于对照组(P<0.05), 生后7 d 高于PS 组(P<0.05)。见表 2。
| 表 2 各组患儿不同时间点血清中BMP-7 的表达 |
NRDS 表现为出生后不久即出现进行性呼吸 困难和呼吸衰竭。国外资料显示BPD 的发生率约 占NRDS 患儿的20% [10],因此,为了尽可能减少 BPD 的发生,早期预测和评估NRDS 对临床有针 对性的治疗非常重要。多种损伤因素如机械通气、 高浓度氧、感染等均可干扰不成熟肺的正常程序 性发育[11],从而可引起一系列炎症反应并导致急 慢性肺损伤。
TGF-β1 主要来源于巨噬细胞、上皮细胞、内 皮细胞和成纤维细胞,是一组多功能调节细胞生 长和分化的细胞因子[12]。TGF-β1 参与了急慢性肺 损伤的发生发展已得到证实。刘冬云等[13] 在BPD 患儿肺灌洗液中检测到有IL-8、SPA 及TGF-β1 的 过高表达。TGF-β1 不仅自身在肺炎发生和肺纤维 化过程中具有重要作用,而且能诱导肺脏高水平 表达结缔组织生长因子,加快肺纤维化的发生[7]。 本研究显示,对照组各时间点TGF-β1 有轻度表达, 提示在正常肺组织内存在分泌TGF-β1 的细胞;PS组患儿TGF-β1 表达量在生后3 d 达高峰,生后7 d 较前有所恢复,提示PS 可以调节体内炎症反应, 减少炎症因子的产生;而非PS 组TGF-β1 表达持 续上升,到生后7 d 时表达明显增高,提示炎症反 应持续存在,由于TGF-β1 的持续高表达,可通过 体内一系列信号转导造成机体严重失衡,从而极 易导致BPD 的发生。然而,由于PS 价格昂贵, 几乎近一半的患儿由于家庭经济困难而放弃使用 PS。因此,积极找寻一种替代物来控制炎症反应 已非常必要。
BMP-7 与TGF-β1 同属于TGF-β 超家族的成 员,目前BMP-7 在肺损伤中的作用研究资料甚 少。BMP-7 对细胞的增殖分化具有调控作用,它 具有广泛而重要的生物学功能[14]。有研究认为, BMP-7 在肺的过敏性炎症反应中起着积极的作 用,可以拮抗TGF-β1 的致纤维化作用,给予重组 BMP-7 后支气管肺泡灌洗液中的TGF-β1 明显降低, 且有剂量依赖性[8]。本研究中,对照组各时间点 BMP-7 有轻度表达,提示在正常肺组织内存在表 达BMP-7 的细胞,在正常状态下,这些细胞处于无活性或低活性状态,所以表达量少且稳定;PS 组BMP-7 的表达量在生后1、3 d 高于对照组,生 后7 d 较前有明显恢复,与对照组相比差异无统计 学意义,提示疾病趋于恢复状态;非PS 组BMP-7 的表达量在生后1、3、7 d 高于对照组,生后7 d BMP-7 表达量较前有所下降,但仍高于PS 组。由 于BMP-7 具有拮抗TGF-β1 的作用,在炎症反应 初期,随着TGF-β1 表达的增加,BMP-7 代偿性增 加,从而维持机体自身的平衡,但随着炎症的继 续,TGF-β1 表达量持续增加,由于分泌BMP-7 的 细胞功能受限,故表达量较前有所下降。因此, 在炎症初期,TGF-β1 和BMP-7 的表达均增加,在 炎症后期,随着TGF-β1 表达的增加,BMP-7 的 表达呈下降趋势,提示给予外源性BMP-7 可能降 低TGF-β1 的表达,这可能成为治疗NRDS 的途径 之一。设想在炎症初期给予重组BMP-7 治疗拮抗 TGF-β1 的致炎作用,可能有助于降低炎症反应的 发生,从而可以减少并发症的发生,降低BPD 的 风险。
综上,了解炎症反应及多种炎症介质在NRDS 中的表达变化趋势,有助于尽早进行临床防治, 改善患儿预后。本组临床研究局限性在于样本小, 观察时间短,范围局限,还需进一步对患儿进行 出院后随访,或进行多中心研究有助于更加详细 准确地了解NRDS 患儿体内血清TGF-β1 和BMP-7 的变化趋势,定期监测肺功能,了解患儿的远期 预后和转归。
| [1] | Kamath BD, Macquire ER, McClure EM, et al. Neonatal mortality from respiratory distress syndrome: lessons for low-resource countries[J]. Pediatrics, 2011, 127(6): 1139-1146. |
| [2] | Ma L, Liu C, Wang Y, et al. Mortality of neonatal respiratory failure related to socioeconomic factors in Hebei province of China[J]. Neonatology, 2011, 100(1): 14-22. |
| [3] | Ruegger C, Hegglin M, Adams M, et al. Swiss Neonatal Network. Population based trends in mortality, morbidity and treatment for very preterm-and very low birth weight infants over 12 years[J]. BMC Pediatr, 2012, 12: 17. |
| [4] | 早产儿支气管肺发育不良调查协作组. 早产儿支气管肺发育不良发生率及高危因素的多中心回顾调查分析[J]. 中华儿科杂志, 2011, 49(9): 655-662. |
| [5] | Sezer RG, Aydemir G, Bozaykut A, et al. The relationship between the first episode of wheezing and matrix metalloproteinases-9 and MMP-2 and tissue inhibitors of MMP-1 levels in preterm infants[J]. Ann Thorac Med, 2013, 4(8): 209-213. |
| [6] | Patel AS, Song JW, Chu SG, et al. Epithelial cell mitochondrial dysfunction and PINK1 are induced by transforming growth factor-beta1 in pulmonary fibrosis[J]. PLoS One, 2015, 10(3): e0121246. |
| [7] | 富建华, 杨海萍, 潘丽, 等. TGF-β1影响肺成纤维细胞结缔组织生长因子基因表达的研究[J]. 中国当代儿科杂志, 2011, 13(1): 36-39. |
| [8] | Stumm CL, Halcsik E, Landgraf RG, et al. Lung remodeling in a mouse model of asthma involves a balance between TGF-β1 and BMP-7[J]. PLoS One, 2014, 9(4): e95959. |
| [9] | 邵晓梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第四版. 北京: 人民卫生出版社, 2004: 421-427. |
| [10] | Sharon LP. Prolonged mechanical ventilation in children[J]. Pediatr Clin North Am, 1994, 41(3): 473-512. |
| [11] | Britt RD Jr, Velten M, Tipple TE, et al. Cyclooxygenase-2 in newborn hyperoxic lung injury [J]. Free Radic Biol Med, 2013, 61C(8): 502-511. |
| [12] | Gaede KI, Amicosante M, Schurmann M, et al. Function associated transforming growth factor-beta gene polymorphism in chronic beryllium disease[J]. J Mol Med, 2005, 83(5): 397-405. |
| [13] | 刘冬云, 吴静, 张小英,等. 支气管肺发育不良新生儿支气管肺泡灌洗液IL-8、SPA 和TGF-β1的表达[J]. 中国当代儿科杂志, 2010, 12(6): 444-446. |
| [14] | Shimasaki S, Moore RK. Ootsuka F, et al. The bone morphogenetic protein system in mammalian reproduction[J]. Endocrine Rev, 2004, 25(1): 72-101. |
 2015, Vol. 17
2015, Vol. 17