骨龄评分法是将每块骨的发育过程划分为 若干发育等级,依据发育等级评分,再将各骨得 分相加得到骨发育总分,最后通过查找各年龄组 标准儿童骨成熟度得分曲线得到被测儿童骨龄。 目前得到国际上广泛认可的是Tanner-Whitehouse (TW)骨龄评分法,该方法涵盖了左手、腕部骨 共20 个,将其分为3 个系列,即含桡、尺、掌、 指骨共13 个骨块的R 系列,含7 个腕骨的C 系列 以及二者综合的T 系列,其准确性优于Greulich- Pyle(G-P)图谱法[1]。TW 骨龄评分法在国内应用 尚不广泛,相关研究较少,尤其是在各种生长发 育障碍性疾病中相关研究甚少。有研究报道,不 同病因导致的矮身材具有不同的骨龄特征[2, 3],如 特发性矮小骨龄落后1~2 岁,小于胎龄儿所致矮 小骨龄落后约1 岁,但缺乏关于不同病因矮身材 患儿TW2 各序列骨龄特点的研究。本研究旨在探 讨不同病因导致的矮身材儿童TW2-R、C、T 各序 列骨龄特点,为骨龄评分法的临床应用及不同病 因矮身材患儿的骨发育评估提供参考。 1 资料与方法 1.1 研究对象
研究对象为2009 年1 月至2012 年12 月于我 院儿科内分泌门诊就诊且未经治疗的矮身材儿童 363 例,其中男童236 例(年龄10.1±3.6 岁,身 高125±18 cm),女童127 例(年龄9.9±3.1 岁, 身高124±15 cm)。
矮身材的诊断依据为:身高低于同种族、 同性别和同年龄身高第3 百分位数[4],标准参照 2009 年《0~18 岁儿童青少年身高体质量标准化生 长曲线》[5]。
排除标准:(1)存在全身器质性疾病、遗传 代谢病及体质性青春发育延迟;(2)存在颅脑肿 瘤或其他中枢神经系统疾病。
研究对象依据病因分为4 组:生长激素缺乏 症(GHD)组、特发性矮小(ISS)组、小于胎龄 儿(SGA)组、Turner 综合征(TS)组。此4 种疾 病的诊断标准分述如下。
(1)GHD[6]:① 身高低于同年龄、同性别正 常人群平均身高2 SD;② 除外其他内分泌性、全 身性、营养性疾病及染色体异常导致的矮身材;③生长缓慢,年身高增长<4 cm;④ 应用2 种药 物行生长激素激发试验(本研究中使用胰岛素激 发试验及心得安激发试验),生长激素峰值均 <10 μg/L。
(2)ISS[7]:① 身高低于同年龄、同性别正常 人群平均身高2 SD;② 未发现全身性、内分泌、 营养性疾病及染色体异常导致的矮身材;③ 生长 激素激发试验中生长激素峰值>10 μg/L。
(3)SGA[8]:① 出生体重低于同胎龄新生儿 的第10 百分位;② 生长激素激发试验中生长激素 峰值>10 μg/L;③ 除外全身性、内分泌性疾病及 染色体异常导致的宫内发育迟缓。
(4)TS:通过染色体核型分析确诊。
根据患儿是否进入青春期,分为青春期和 青春期前亚组。男童Prader 模具测量睾丸容积 >3 mL,女童乳腺Tanner 分期B2 期及以上,为青 春期组,否则为青春期前组[9]。男女GHD 组、TS 组及女童SGA 组因样本量较小,且较少患儿进入 青春期,未按青春期分亚组。
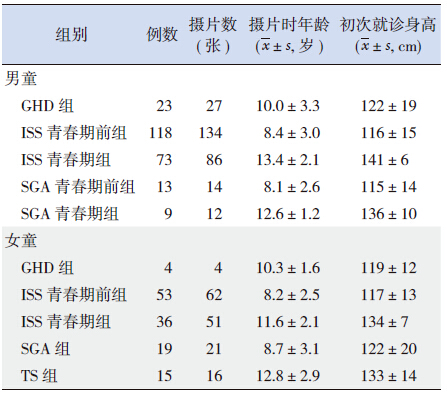
各组患儿年龄、初次就诊时身高及摄片数、 摄片时年龄见表 1。
| 表 1 各组一般情况 |
拍摄左手腕骨骨龄片,多次摄片患儿两次骨 龄片间隔至少超过6 个月,共计摄片427 张,包 括GHD 组31 张,ISS 组333 张,SGA 组47 张, TS 组16 张。 1.3 骨龄测定方法
去除所有入选患儿的骨龄X线片的识别信息, 保留片号并随意排序,由2 名有经验的放射科医 生独立阅片(盲法读片)。采用TW2 骨龄评分法 中国南方人骨龄及骨龄百分位标准[10],先后对R 序列13 块管状骨及C 系列7 块腕骨分别分期评分, 最后记录T 序列各骨评分,查找骨龄百分位标准 第50 百分位对应的骨龄,得到患儿R、C、T 各序 列骨龄。 1.4 统计学分析
采用SPSS 16.0 软件包进行统计学分析。计 量资料以均数± 标准差(x±s)表示,组间比较 采用方差分析,组间两两比较采用LSD-t 检验, P<0.05 为差异有统计学意义。 2 结果 2.1 男童各组骨龄与年龄的比较
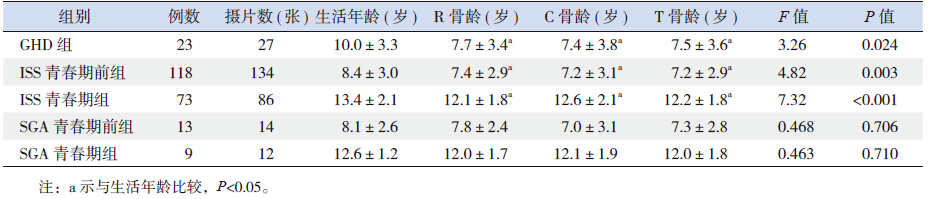
GHD 组、ISS 青春期前组及ISS 青春期组男童 其R 骨龄、C 骨龄及T 骨龄均显著小于生活年龄, 其中GHD 组R 骨龄、C 骨龄及T 骨龄比生活年龄 落后2.3~2.6 岁,ISS 组R 骨龄、C 骨龄及T 骨龄 比生活年龄落后0.8~1.3 岁,而SGA 组各序列骨龄 与生活年龄差异无统计学意义(表 2)。
| 表 2 男童各组骨龄与年龄的比较 (x±s) |
ISS 青春期组 C 骨龄与R 骨龄及T 骨龄比较 差异有统计学意义,但三序列骨龄均与生活年龄 比较差异均无统计学意义。TS 组R 骨龄及T 骨龄 较生活年龄落后,差异有统计学意义,C 骨龄与生 活年龄比较差异无统计学意义。GHD 组、ISS 青春 期前组及SGA 组C 骨龄、R 骨龄及T 骨龄与生活 年龄比较差异均无统计学意义。各组骨龄、年龄 情况见表 3。
| 表 3 女童各组骨龄与年龄的比较 (x±s) |
骨龄是对儿童发育年龄或生理成熟度的检测, 较生活年龄更真实反映了个体发育水平[11]。骨龄 是矮身材患儿诊断和疗效观察的一项不可缺少的 指标[1]。2009“国际骨发育研究组”成员认为骨成 熟度的评估对于矮身材儿童首次就诊是一项常规 检查,可帮助诊断和判断预后[2]。TW2 骨龄评分 法为全世界最常用的骨龄评分法。该法将手腕部 骨分为3 个序列:含桡、尺、掌、指骨共13 个管 状骨的R 序列,代表长骨的发育水平;含7 个腕 骨的C 序列,代表短骨骨龄;二者综合的T 序列代表骨骼整体发育水平。
本研究中GHD 组患儿,男童及女童均表现为 R 骨龄、C 骨龄及T 骨龄明显落后于年龄,可能因 女童样本量小,差异未达到统计学意义。GHD 是 由于各种病因导致垂体前叶分泌的生长激素不足 而导致儿童生长发育障碍的疾病。本研究中GHD 组患儿均为原发性GHD。大多数原发性GHD 患儿 病变位于下丘脑,由于生长激素释放激素(GHRH) 分泌频率及分泌量均减少,垂体的生长激素细胞 接收不到足够的信号,以致生长激素细胞发育不 良,生长激素的分泌与储存减少。生长激素是一 种以剂量依赖性方式刺激长骨纵向生长的全身性 调节骨代谢因子,其促进骨生长主要有3 种方式[12]: (1)生长激素刺激肝脏及肝外组织产生胰岛素样 生长因子1(IGF-1),然后将其释放至循环系统, 再藉由内分泌作用至靶器官的IGF-1 受体起作用。 IGF-1 是引起骺软骨细胞分化和再生、促进骨形成 的重要激素。IGF-1 对于长骨有直接促生长作用, IGF-1 可以刺激成骨细胞增殖,提高成骨细胞的成 骨作用,促进骨质矿化。(2)生长激素对骨细胞 有直接作用,可以促进前软骨细胞分化为软骨细 胞,同时刺激软骨组织分泌IGF-1,后者通过自分 泌及旁分泌的方式促进软骨细胞增殖。(3)生长 激素可刺激肝脏产生胰岛素样生长因子结合蛋白3 (IGFBP3),IGFBP3 可提高IGF-1 在靶器官的半 衰期及生物学活性。在GHD 患儿中,由于患儿生 长激素缺乏,长骨及短骨骨发育均受到明显影响, 一般认为,GHD 患儿骨龄通常落后2 岁以上。本 研究GHD 患儿R 序列、C 序列及T 序列骨龄落后 2.3~2.6 岁,与文献资料相符[13, 14]。有文献表明, 在GHD 患儿中,C 序列诸骨骨龄延迟更明显[15], 但本次研究中,GHD 患儿R 序列、C 序列及T 序 列骨龄均明显落后。
本研究ISS 组患儿中,男童表现为R 骨龄、C 骨龄及T 骨龄明显落后于年龄;女童表现为R 骨龄、 C 骨龄及T 骨龄与年龄比较无显著差异。ISS 是儿 童矮身材最常见的原因,其发病率占整个矮身材 患儿的60%~80%[7],本次研究中ISS 儿童占所有矮 身材患儿的77%。ISS 是指目前尚无明确原因引起 的身材矮小,其发病机制尚未明确,患儿可能存 在GH/IGF 轴的异常,已发现IGF-1 受体基因单核 苷酸多态性是ISS 发病的危险因素[16]。患儿临床表现为身高低于同年龄同性别2 SD,但无全身性、 内分泌性或营养性疾病及染色体异常。出生时身 长及体重正常,GH 激发试验结果峰值>10 μg/L。 ISS 实质上是一个排除性诊断,是一组异质性疾病 的统称[17]。由于ISS 患儿包含多种疾病,其中包 括生长激素不敏感及家族性矮小。生长激素不敏 感患儿可出现骨龄延迟,而家族性矮小则无骨龄 延迟情况出现。本研究ISS 组患儿中男童表现为各 序列骨龄明显落后于年龄,而女童各序列骨龄与 生活年龄比较无显著差异,考虑与组内ISS 患儿包 含多种疾病,男童与女童疾病组成不同有关。
本研究中SGA 组各序列骨龄与年龄无显著差 异。其中青春期前男童组R 骨龄、C 骨龄及T 骨 龄比生活年龄小,以C 骨龄减小更明显,可能由 于样本量较小,差异无统计学意义。SGA 是指出 生体重在同胎龄平均出生体重第10 百分位以下的 新生儿[8]。SGA 生后常合并体格发育落后,大多数 SGA 生后出现自发性的追赶生长,但约10%~15% SGA 在儿童期和成年后身高仍低于同年龄第3 百 分位。SGA 儿童年龄>3 岁时,身高<2 SD,是发 生矮身材的高风险人群。国外研究显示SGA 儿童, 青春期前骨龄通常相对延迟,约延迟1~2 岁,SGA 儿童进入青春期年龄在正常范围,但较适于胎龄 儿略早,青春期起始时骨龄略落后,进入青春期 后骨龄增速快于适于胎龄儿,身高突增发生于青 春早期,且持续时间较短,之前的骨龄延迟会突 然消失,生长板较早闭合,导致矮身材[18]。本研 究中SGA 患儿平均年龄较大,因此未发现明显的 骨龄延迟,仅青春期前男童组R 骨龄、C 骨龄及 T 骨龄比生活年龄小,但可能由于样本量较小,差 异无统计学意义。
本研究中TS 组R 骨龄及T 骨龄明显落后, C 骨龄与年龄比较无显著差异。TS 又称先天性卵 巢发育不全综合征,是由于全部或者部分体细胞 中1 条X 染色体完全或者部分缺失或结构畸变所 致,临床表现为身材矮小、颈蹼、肘外翻、马德 隆畸形等骨骼畸形,青春期缺乏第二性征或者第 二性征发育不良[19]。对于TS 患儿出现矮小及骨龄 延迟的原因,目前主要有SHOX 基因学说。SHOX 基因定位于X、Y 的拟常染色体区域,分别编码 292 和225 个氨基酸组成的两种蛋白:SHOXa 和 SHOXb。SHOX 蛋白在双拷贝剂量表达下,可以促进四肢骨远端软骨细胞分化、调节细胞增殖与凋 亡间平衡,又可抑制青春期大剂量雌激素使生长 板加速成熟的作用,故有利于线性生长。在TS 患 儿中,由于SHOX 基因发生突变或者缺失,呈单 拷贝剂量表达,SHOX 蛋白不足,导致软骨细胞增 殖分化紊乱,失去生长板增殖层与终末期细胞凋 亡间的平衡,亦丧失抑制雌激素对于生长板的负 性生长作用而影响终身高。TS 患儿与孤立SHOX 单拷贝体(isolated SHOX deficiency)患儿在骨形态、 骨密度、骨总面积及骨强度指数等指标无差异[20], 证实了TS 患儿中矮小及骨发育延迟与SHOX 蛋白 单拷贝剂量表达有关。由于SHOX 基因主要作用 于四肢管状骨中的软骨组织,因此R 序列诸骨发 育,尤其是桡骨、尺骨受到更为明显的影响,其 骨龄延迟以R 骨龄更为明显。另一方面,TS 患儿 由于性染色体缺失或畸形,导致卵巢发育不全, 多数患儿最终呈现卵巢衰竭,其雌激素水平较低, 无明显青春期发育突增。R 序列所代表的长骨对于 性激素水平的升高最为敏感,C 序列骨龄代表短骨 骨龄,对于性激素的敏感性较差。因此TS 患儿R 骨龄及T 骨龄受影响较大,表现为明显落后于生 活年龄,C 骨龄受影响较小,与生活年龄比较无显 著差异。
本研究结果提示不同病因的矮身材患者具 有不同的R、C、T 各序列骨龄特点。骨龄评估 对矮身材患者的诊治至关重要,了解不同疾病的 TW2-R、C、T 骨龄特征,将有助于矮小症患者病 因的诊断。
| [1] | Spadoni GL, Cianfarani S. Bone age assessment in the workup of children with endocrine discorders[J]. Horm Res Paediatr, 2010, 73(1): 2-5. |
| [2] | Martin DD, Wit JM, Hochberg Z, et al. The use of bone age in clinical practice[J]. Horm Res Paediatr, 2011, 76(1): 1-9. |
| [3] | De Sanctis V, Di Maio S, Soliman AT, et al. Hand X-ray in pediatric endocrinology: Skeletal age assessment and beyond[J]. Indian J Endocrinol Metab, 2014, 18(Suppl 1): S63- S71. |
| [4] | 中华医学会儿科学分会内分泌遗传代谢学组.矮身材儿童诊治指南[J].中华儿科杂志, 2008, 46(6): 428-430. |
| [5] | 李辉, 季成叶, 宗心南. 中国0-18岁儿童、青少年身高、体重的标准化生长曲线[J].中华儿科杂志, 2009, 47(7): 487-491. |
| [6] | Webb EA, Dattani MT. Diagnosis of growth hormone deficiency[J]. Endocr Dev, 2010, 18: 55-66. |
| [7] | Cohen P, Rogol AD, Deal CL, et al. Consensus statement on the diagnosis and treatment of children with idiopathic short stature:a summary of the Growth Hormone Research Society, the Lawson Wilkins Pediatric Endocrine Society and the European Society for Paediatric Endocrinology Workshop [J]. J Clin Endocrinol Metab, 2008, 93(11): 4210-4217. |
| [8] | Boguszewski MC, Mericq V, Bergada I, et al. Latin American consensus: children born small for gestational age[J]. BMC Pediatr, 2011, 19(11): 66. |
| [9] | 颜纯, 王慕逖. 小儿内分泌学[M]. 第2版. 北京: 人民卫生出版社, 2006: 78-79. |
| [10] | 叶义言. 中国儿童骨龄评分法[M]. 北京: 人民卫生出版社, 2005: 84-151. |
| [11] | Rogol AD, Hayden GF. Etiologies and early diagnosis of short stature and growth failure in children and adolescents[J]. J Pediatr, 2014, 164 (5 Suppl): S1-S14. |
| [12] | Alatzoglou KS, Webb EA, Tissier PL, et al. Isolated growth hormone deficiency (GHD) in childhood and adolescence: recent advances[J]. Endocr Rev, 2014, 35: 376-432. |
| [13] | Garg MK, Pakhetra R, Dutta MK, et al. Response to growth hormone therapy in Indian patients[J]. Indian J Pediatr, 2010, 77(6): 639-642. |
| [14] | Cantu G, Buschang PH, Gonzalez JL. Differential growth and maturation in idiopathic growth-hormone-deficient children[J]. Eur J Orthod, 1997, 19(2): 131-139. |
| [15] | Even L, Andersson B, Kristrom B, et al. Role of growth hormone in enchondroplasia an chondral osteogenesis: evaluation by X-ray of the hand[J]. Pediatr Res, 2014, 76(1): 109-114. |
| [16] | 黄慧, 杨玉, 王伟, 等.特发性矮小患儿胰岛素样生长因子受体基因单核苷酸多态性研究[J]. 中国当代儿科杂志, 2011, 13(12): 955-958. |
| [17] | Wit JM, Clayton PE, Rogol AD, et al. Idiopathic short stature: definition, epidemiology, and diagnostic evaluation[J]. Growth Horm IGF Res, 2008, 18(2): 89-110. |
| [18] | Verkauskiene R, Petraitiene I, Albertsson Wikland K. Puberty in children born small for gestational age[J]. Horm Res Paediatr, 2013, 80(2): 69-77. |
| [19] | Milbrandt T, Thomas E. Turner syndrome[J]. Pediatr Rev, 2013, 34(9): 420-421. |
| [20] | Soucek O, Zapletalova J, Zemkova D, et al. Prepubertal girls with Turner syndrome and children with isolated SHOX deficiency have similar bone geometry at the radius[J]. J Clin Endocrinol Metab, 2013, 98(7): E1241-1247. |
 2015, Vol. 17
2015, Vol. 17