先天性类脂质性肾上腺皮质增生症(lipoid congenital adrenal hyperplasia,LCAH)是先天性肾上 腺皮质增生症中最罕见和最严重的类型,由于类固 醇生成急性调节蛋白(steroidogenic acute regulatory protein,StAR)基因突变导致肾上腺及性腺类固醇 激素生成障碍,临床上表现为肾上腺皮质功能低下 及性激素合成障碍,皮质激素替代治疗可获得良好 预后。本病呈常染色体隐性遗传,上海新华医院 曾报道1 例[1]。本文对2 例经StAR 基因分析确诊 为LCAH 的女性外表患儿的临床特点及StAR 基因 突变结果进行分析,旨在提高儿科医生对本病的认 识,以便早期诊断及早期干预。 1 资料与方法 1.1 研究对象
选取2013 年4 月于广州市妇女儿童医疗中心 遗传与内分泌科就诊的2 例女性表型“原发性肾 上腺皮质功能减低症”患儿为研究对象,经StAR 基因突变分析确诊为LCAH。该2 例患儿分别来自 无血缘家庭,例1 患儿父母为3 代内近亲结婚。 另随机选取50 例健康儿童外周血DNA 为对照。 本研究获得患儿家长知情同意。 1.2 DNA 提取
采集患儿及其父母外周静脉血2 mL,采用 美国Innovogen 公司生产的Blood gDNA Magentic Beads Purification Kit 提取基因组DNA。 1.3 StAR 基因突变分析
参照NCBI 数据库中StAR 基因序列及相关文 献[1, 2, 3, 4],合成5 对引物(表 1),扩增StAR 基因 7 个外显子及其两侧侧翼序列。PCR 反应体系为 25 μL:含10×Taq 缓冲液2.5 μL,dNTPs(2.5 mM) 2.0 μL,BTA(5 M)2.5 μL,Taq 聚合酶(5 U/L) 0.15 μL,DNA 模板(20~30 ng)2.0 μL,上、下游引 物(5 mmol/L)各0.5 μL,加去离子水至25 μL。 PCR 反应条件为:94℃预变性5 min;94℃变性 30 s,57~65 ℃ 退火30 s,72 ℃ 延伸40 s,共35 个循环;72℃再延伸7 min。PCR 产物纯化后用 ABI3730 测序仪系统(ABI 公司)完成测序,测序 结果应用DNAMAN 软件与标准序列进行比对分析。 对于检出的突变,于人类基因突变数据库(HGMD) 及千人基因组数据库(1 000 Genomes)检索是否为已报道突变和多态性。
| 表 1 StAR 基因PCR 引物及扩增片段长度 |
对新错义突变进行10 种不同物种间保守性分 析;并采用PolyPhen-2 软件对新错义突变进行蛋 白功能预测,评分越接近1,突变致病性可能性越 大。 1.5 限制性片段长度多态性分析
对新剪接突变IVS4+2T>A 进行限制性片段长 度多态性(RFLP)分析,取外显子4~5 的PCR 产 物10 μL,加入限制性内切酶HphI 10 U 及酶切缓 冲液至总体积20 μL,37℃水浴过夜,酶切产物经 2% 琼脂糖凝胶电泳30 min,并行对照分析,进一 步排除单核苷酸多态性的可能性。 2 结果 2.1 临床表现
2 例患儿确诊年龄分别为生后4 个月及2 岁 4 个月,长期给予氢化可的松及9α- 氟氢可的松 替代治疗,专科门诊随访1 年6 个月。2 例患儿 初诊时具有如下临床特征:(1)婴儿早期出现 不同程度的肾上腺皮质功能减退表现,如生长迟 缓、皮肤色素沉着、电解质紊乱,促肾上腺皮质 激素(ACTH)显著增高,皮质醇正常或降低; (2)不伴有各类雄性激素增高;(3)女性外 表,染色体核型46,XX;(4)肾上腺超声提示 双侧肾上腺增大或正常(表 2)。2 例患儿出院 诊断均为原发性肾上腺皮质功能减低症,经生理 剂量糖皮质激素及盐皮质激素替代治疗,随访1 年余,生长发育正常,肾上腺大小无明显变化。
| 表 2 两例LCAH 患儿初诊时临床表现 |
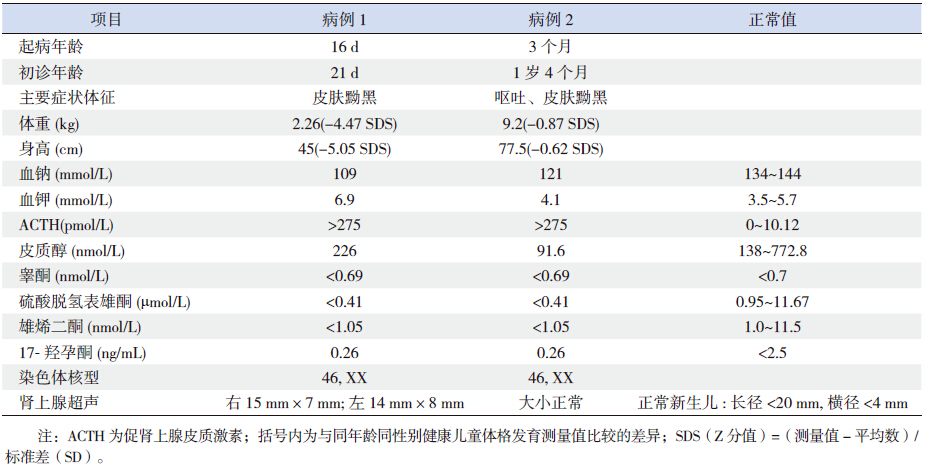
病例1 为外显子7 的 p.Q258X 纯合无义突 变( 图 1A),其父母均为该突变携带者( 图 1B~C),该突变为已知致病突变;病例2 为p.E123K/ IVS4+2T>A 复合杂合突变(图 2A~B),母亲为外 显子4 的p.E123K 携带者(图 2C),父亲为内含子 4 的IVS4+2T>A 携带者(图 2D),突变p.E123K 及 IVS4+2T>A 在HGMD 及1 000 Genomes 数据库中均 未见报道,为新突变。
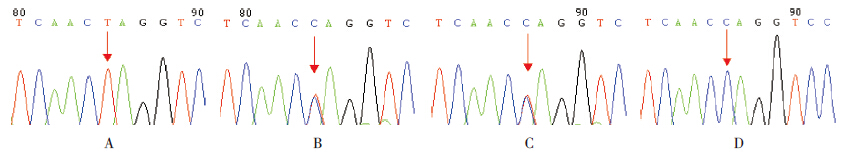 |
图 1 StAR 基因外显子7 的p.Q258X 纯合无义突变测序图A:病例1 外显子7 的p.Q258X 纯合无义突变; B~C:病例1 父母均为该位点杂合突变;D:正常对照。箭头所指为突变位点。 |
 |
图 2 StAR 基因p.E123K/IVS4+2T>A 复合杂合新突变测序图A~B:病例2 p.E123K/IVS4+2T>A 复合杂合 新突变;C:病例2 母亲外显子4 的p.E123K 杂合新错义突变;D:病例2 父亲内含子4 的IVS4+2T>A 杂合新剪接突变; E~F:正常对照。箭头所指为突变位点。 |
对新错义突变p.E123K 进行10 种不同物种相 应位点保守性分析,提示该位点在多个物种间高 度保守(图 3);同时用PolyPhen-2 软件进行蛋白 功能预测,评分为0.99,提示该位点氨基酸突变 影响蛋白质功能,致病突变可能性大。
 |
图 3 StAR 基因123 号氨基酸E 保守性分析氨基 酸E 为谷氨酸,红色方框内所示。 |
对新剪接位点突变IVS4+2T>A 进行RFLP 分 析显示,酶切前病例2、其父母及正常人结果中仅 出现670 bp 条带,经HphI 酶切后,病例2 及其父 亲结果中同时出现670、423、247 bp 3 条条带,而 其母亲及正常人结果中均仅出现423 bp 和247 bp 2 条条带,见图 4。 3 讨论
StAR 的功能是将胆固醇从胞浆内转运至线粒 体内膜,在P450scc 酶的作用下将胆固醇转化为孕 烯醇酮,是合成类固醇激素的起始和限速步骤。 StAR 基因突变导致StAR 蛋白酶活性下降,影响 肾上腺及性腺类固醇激素合成,表现为不同程度 的肾上腺皮质功能低下及男性性发育异常。根据肾上腺皮质功能不全发病年龄及性腺发育情况,临 床上分为经典型LCAH 及非经典型LCAH。经典型 患儿常于婴儿早期出现失盐型肾上腺皮质功能低下 表现,男性胎儿因雄激素合成障碍表现为不同程度 的男性化不全或完全女性外表,女性胎儿性分化正 常。非经典型患儿常于2~4 岁发病,男性出生时 外生殖器正常或出现隐睾、尿道下裂等,青春期 可伴有睾丸功能低下,生精异常等[5, 6, 7]。StAR 基因 定位于8p11.2,全长8.38 kb,包含7 个外显子。 至2014 年2 月HGMD 数据库已报道StAR 基因突 变63 种。多为错义、无义及移码突变,剪接位点 突变占10%,尚有1 例StAR 基因完全缺失的报 导[8]。极少数LCAH 是由于CYP11A1 基因突变导 致P450scc 酶活性降低所致[9]。
本文2 例患儿均在婴儿期出现失盐、皮肤色 素沉着等肾上腺皮质功能低下表现,无男性化等 雄激素增高表现,肾上腺超声排除出血、感染及 肿瘤等继发性损伤,亦未提示肾上腺发育不良。 染色体核型分析证实为女性,临床高度疑似StAR 基因突变所致的LCAH,尤其是例1 患儿肾上腺 超声提示双侧肾上腺肿大。病例1 StAR 基因分析 结果为p.Q258X 纯合已知致病突变,从分子水平 确诊为LCAH。p.Q258X 为日本、韩国LCAH 患者 StAR 基因最常见的突变类型[4]。p.Q258X 基因型 的临床表型特点是生后2 个月内即出现严重的肾 上腺皮质功能减退症状。
病例2 临床表现相对较轻,生后2 个月体检 曾发现轻微低钠血症,未引起重视,体格发育基 本正常。1 岁时因感染诱发逐渐出现皮肤色素沉着、 呕吐等肾上腺皮质功能低下表现,确诊后经氢化 可的松替代治疗,皮肤色素正常。其StAR 基因分 析发现p.E123K/IVS4+2T>A 复合杂合突变,均为 新突变,分别来自于患儿的母亲、父亲。错义突 变p.E123K 是由于突变c.367G>A 导致第123 号碱 性的谷氨酸变为酸性的赖氨酸,经物种保守分析及 “PolyPhen-2”软件蛋白功能预测,结果均高度提 示该突变为致病性突变。剪接突变IVS4+2T>A 经 RFLP 分析排除单核苷酸多态性可能。结合文献资 料,推测该突变可能的异常剪接方式为:(1)外 显子4 跳跃(丢失53 个氨基酸);(2)丢失部分 外显子序列或残留部分内含子序列;(3)内含子 4 残留,导致mRNA 转录本插入141 个核苷酸,移 码突变破坏了蛋白的活性而致病;(4)上述所有转录本均存在的嵌合体型[10]。2014 年Camats 等[8] 进行了13 例剪接位点突变分析,结果提示IVS3 至 IVS6 剪接位点突变均导致了严重的临床表型,发 病年龄从生后1 d 至生后1 年,其中46% 于生后 7~10 d 出现临床症状。因此,我们推测该剪接突变 为致病性突变。
LCAH 临床表现缺乏特异性,容易误诊为原 发性肾上腺皮质功能减退症或Addison 氏病,主要 依赖StAR 基因分析明确诊断。对于婴儿早期出现 的肾上腺皮质功能低下伴/ 或不伴性发育异常,应 注意与下列疾病相鉴别:(1)各种类型的先天性 肾上腺皮质增生症,尤其是罕见的3β- 羟类固醇脱 氢酶缺乏症。(2)先天性肾上腺发育不良,男性 患儿首先考虑为DAX-1 基因突变所致的X- 连锁肾 上腺发育不良,而女性患者应注意与极其罕见的 SF-1 基因突变所致肾上腺发育不良鉴别,染色体 核型及肾上腺超声检查有助鉴别[11]。本组病例均 为46,XX 女性,肾上腺超声提示双侧肾上腺增大 或正常,不支持先天性肾上腺发育不良,亦可排 除出血、肿瘤、感染等继发性肾上腺病变。
LCAH 患者通常因胆固醇及胆固醇酯在肾上 腺组织细胞胞浆聚集,导致类脂质性肾上腺增大, 但尚有部分LCAH 患者肾上腺超声正常[12]。本组 例1 患儿生后24 d 超声提示双侧肾上腺增大,经 规范的激素替代治疗,多次超声复查提示双侧肾 上腺体积较前稍缩小,其原因可能与早期诊断, 早期替代治疗,避免了肾上腺在ACTH 长期刺激 下加重胆固醇等类脂质物质聚集有关。例2 多次 检查肾上腺超声未提示明显异常,可能与该患儿 病情稍轻,诊断及治疗及时有关。
综上所述,LCAH 是一种罕见的失盐型先天 性肾上腺皮质增生症,同时伴有肾上腺及性腺类 固醇激素合成障碍。对女性表型的肾上腺皮质功 能低下者,应警惕StAR 基因突变所致LCAH,常 规进行染色体核型分析及肾上腺超声检测有助鉴 别,StAR 基因突变分析可明确诊断。新突变p.E123K 及IVS4+2T>A 为致病性突变。对于基因诊断明确 的高危家庭,可进行遗传咨询及产前诊断,预防 疾病再发风险。
| [1] | 邱文娟, 叶军, 韩蓓, 等. 先天性类脂质性肾上腺增生症分子遗传学分析[J].中华儿科杂志, 2004, 42(8): 585-588. |
| [2] | Eiden-Plach A, Nguyen HH, Schneider U, et al. Alu Sx repeat-induced homozygous deletion of the StAR gene causes lipoidcongenital adrenal hyperplasia[J]. J Steroid Biochem Mol Biol, 2012, 130(1-2): 1-6. |
| [3] | Gonzalez AA, Reyes ML, Carvajal CA, et al. Congenital lipoid adrenal hyperplasia caused by a novel splicing mutation in the gene for the steroidogenic acute regulatory protein[J]. J Clin Endocrinol Metab, 2004, 89(2): 946-951. |
| [4] | Chen X, Baker BY, Abduljabbar MA, et al. A geneticisolate of congenital lipoid adrenal hyperplasia with atypical clinical findings[J]. J ClinEndocrinol Metab, 2005, 90(2): 835-840. |
| [5] | Baker BY, Lin L, Kim CJ, et al. Nonclassic congenitallipoid adrenal hyperplasia: a new disorder of the steroidogenic acute regulatory protein with very late presentation and normal male genitalia[J]. J Clin Endocrinol Metab, 2006, 91(12): 4781-4785. |
| [6] | Sahakitrungruang T, Soccio RE, Lang-Muritano M, et al. Clinical, genetic, and functional characterization of four patients carrying partial loss-of-function mutations in the steroidogenic acute regulatory protein (StAR)[J]. J Clin Endocrinol Metab, 2010, 95(7): 3352-3359. |
| [7] | Fluck CE, Pandey AV, Dick B, et al. Characterization of novel StAR (steroidogenic acute regulatory protein) mutations causing non-classic lipoid adrenal hyperplasia[J]. PLoS One, 2011, 6(5): e20178. |
| [8] | Camats N, Pandey AV, Fernandez-Cancio M, et al. STAR splicing mutations cause the severe phenotype of lipoidcongenital adrenal hyperplasia: insights from a novel splicemutation and review of reported cases[J]. Clin Endocrinol (Oxf), 2014, 80(2): 191-199. |
| [9] | King SR, Bhangoo A, Stocco DM. Functional and physiological consequences of StAR deficiency: role in lipoid congenital adrenal hyperplasia[J]. Endocr Dev, 2011, 20: 47-53. |
| [10] | Lekarev O, Mallet D, Yuen T, et al. Congenital lipoid adrenal hyperplasia (a rare form of adrenal insufficiency and ambiguous genitalia) caused by a novel mutation of the steroidogenic acute regulatory protein gene[J]. Eur J Pediatr, 2012, 171(5): 787-793. |
| [11] | 肖园, 杨军, 张惠杰, 等. 先天性肾上腺发育不良家系中DAX-1新突变的发现[J]. 中华儿科杂志, 2007, 45(12): 937-941. |
| [12] | Hashemipour M, Ghasemi M, Hovsepian S. A case of congenital lipoid adrenal hyperplasia[J]. Int J Prev Med, 2012, 3(7): 510-514. |
 2015, Vol. 17
2015, Vol. 17