2. 广州医科大学附属第一医院儿科, 广东 广州 510120
噬血细胞性淋巴组织细胞增生症 (hemophagocytic lymphohistiocytosis,HLH)是多种 原因造成自然杀伤细胞(natural killer cell,NK)和 T 细胞功能缺陷,引起大量炎症细胞因子释放,造成机体巨噬细胞活化,机体脏器、组织损伤的一 组临床综合征[1]。HLH 病因及发病机制复杂,临 床表现具有特征性但缺乏特异性,易与传染性单 核细胞增多症(IM)、脓毒症、自身免疫性疾病、 病毒感染和造血系统恶性疾病相混淆,并且病情 进展迅猛而凶险,如不及时给予诊断及治疗,则 预后差,病死率极高,因此如何提高HLH 的早期 诊断,实施有效的治疗,是临床工作中亟待解决 的问题。
CD163 是一种仅仅在单核细胞- 巨噬细胞 系统细胞膜上表达的跨膜糖蛋白分子,可作为一 项反应单核巨噬细胞系统功能状态的临床实用指 标[2]。CD163 存在形式有两种,一种是以膜性形 式(membranous CD163,mCD163) 存在于单核细 胞和巨噬细胞膜上,另一种以可溶性形式(soluble CD163,sCD163)存在于血清、血浆或其他组织液 内。sCD163 是巨噬细胞活化的重要标志物,在一 些疾病中作为标记物监测巨噬细胞活性。Jordan 等[3] 提出把血清中sCD163 的升高作为HLH 的诊 断指标之一。巨噬细胞活化可能在脓毒症炎症失 控反应中起核心作用,其过度活化引起感染相关 性HLH 可能是脓毒症进展甚至引起死亡的原因 之一。因此,本研究通过检测EB 病毒(EBV) 感染患儿CD14+ 细胞膜表面CD163 与血清中相应 sCD163 的水平,分析两种不同存在形式之间的关 系,并探讨其与患儿临床表现、疗效及预后的关系。 1 资料与方法 1.1 研究对象
选取2012 年6 月至2013 年9 月因不同感染 就诊于广州医科大学附属第一医院的患儿94 例为 研究对象,其中男52 例,女42 例,年龄最大16 岁, 最小2 个月,平均年龄4.3 岁。依据EBV 检测结 果将患儿分为EBV 阳性组(n=55)和EBV 阴性组 (对照组,n=39);依据《诸福棠实用儿科学》[4] 以及HLH-2004[5] 诊断标准,进一步将EBV 阳性患 儿分为IM 组(n=47)和HLH 组(n=8)。 1.2 标本和临床资料采集
所有患儿标本在入院时采集,干燥管和EDTA 管分别收集外周静脉血1 mL;3 例HLH 患儿于住 院诊断后的第1、2、3、4 周,其中1 例患儿还于住院诊断后第5 周再次抽取血标本。干燥管收集 的血标本以3 000 rpm 离心15 min,吸取上层血清, 放于-80℃冰箱待测;同步收集患儿住院期间的临 床资料进行回顾性分析。 1.3 酶联免疫法检测血清sCD163 水平
按照美国R&D 公司的人可溶性CD163 ELISA 试剂盒说明书进行操作,试剂盒的检测范围为 0~100 pg/mL。 1.4 流式细胞术检测外周血单核细胞表面CD163表达率
CD14 为单核细胞表面的标记抗原,先以 CD14 荧光强度对侧向角散射(SSC)做散点图, 用门技术圈出CD14+ 的单核细胞群,每份检测 10 000 个细胞。以十字门划定CD14+CD163+ 细胞群, 用该细胞群占CD14+ 的单核细胞群的百分比作为 外周血单核细胞表面CD163 表达水平,所用单克 隆抗体均购买自美国BD 公司。 1.5 统计学分析
采用SPSS 17.0 统计软件对数据进行统计学 分析,符合正态分布的计量资料用均数± 标准差 (x±s)表示,多组比较采用方差分析,组间两两 比较采用LSD-t 检验,两变量间的相关分析采用 Pearson 相关分析;非正态分布计量资料用中位数 (范围)表示,组间比较采用Mann-Whitney 秩和 检验,两变量间的相关分析采用Spearman 相关分 析。P<0.05 为差异有统计学意义。 2 结果 2.1 不同感染患儿入院时血清sCD163 水平
对照组、IM 组和HLH 组血清sCD163 水平分 别为4 190±1 733 ng/mL、7 212±5 814 ng/mL、和 28 369±6 254 ng/mL。三组间血清sCD163 水平比 较差异有统计学意义(F=3.252,P=0.023),其中 HLH 组血清sCD163 水平远高于对照组和IM 组, 差异有统计学意义(P<0.05)。 2.2 EBV 感染患儿血清sCD163 与主要实验室数据相关性分析
将55 例EBV 感染患儿血清sCD163 水平与主 要实验室数据进行相关性分析,结果显示:血清 sCD163 水平与异型淋巴细胞比例、淋巴细胞比例、 单核细胞比例、谷丙转氨酶(ALT)和谷草转氨酶(AST)均无显著相关性(P>0.05);血清sCD163 水平与EBV-DNA 拷贝数(r=0.456,P=0.003)、 乳酸脱氢酶(r=0.301,P=0.032) 和血清铁蛋白 (r=0.853,P=0.001)呈正相关;血清sCD163 水 平与白细胞计数(r=-0.361,P=0.001)、中性粒 细胞计数(r=-0.441,P=0.001)、血红蛋白(r=-0.372, P=0.005)和血小板计数(r=-0.378,P=0.004)呈 负相关。 2.3 HLH 患儿血清sCD163 水平及预后
本研究8 例HLH 患儿血清sCD163 水平均 >10 000 ng/mL,有3 例>30 000 ng/mL; 其中1 例 患儿sCD163 水平>30 000 ng/mL 并伴有 EBV-DNA 拷贝数(9.25×108 copies/mL)明显升高,临床上 呈暴发性经过,迅速死亡;余7 例经HLH-2004 方 案治疗后,好转4 例,死亡3 例。 2.4 HLH 患儿血清sCD163 的动态变化
HLH 患儿中有3 例进行了血清sCD163 水平 的动态观察,第一周依据HLH-2004 方案予化疗后 sCD163 水平均明显降低,且在随后3 周内呈平缓 下降趋势;其中1 例患儿在治疗第5 周时合并真 菌性肺炎,病情重新活动,此时血清sCD163 水平 虽仍呈下降趋势,但下降幅度较前减小(图 1)。
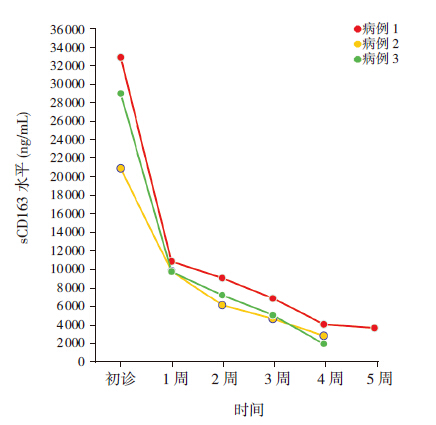 |
图 1 3 例HLH 患儿血清sCD163 动态变化 |
本研究利用流式细胞术检测46 例不同感 染患儿入院时外周血单核细胞表面CD163 表达率,其中对照组24 例,IM 组19 例,HLH 组3 例,外周血单核细胞表面CD163 表达率分别为 34%±15%、37%±19%、45%±34%,3 组CD163 表达率差异无统计学意义(F=0.641,P=0.529)。 2.6 IM 患儿血清sCD163 水平与单核细胞表面
CD163 表达率的相关性分析 将19 例IM 患儿血清sCD163 水平与单核细胞 表面的CD163 表达率进行相关性分析,结果显示 两者之间无明显相关性(r=0.109,P>0.05)。 3 讨论
单核巨噬细胞是机体炎症和天然免疫的关键 效应细胞,CD163 具有单核巨噬细胞系表达特异 性,可作为巨噬细胞活化的标记,而由CD163 分 子胞外段释放的sCD163 也是一种新型巨噬细胞活 化血清标志物。血清sCD163 性能稳定,在-20℃ 下可保持至少7 个月,在-80℃可保持更长时间, 而且实验证明反复冻融至少7 次的血清与新鲜血 清sCD163 水平之间无明显差异[6]。Schaer 等[7] 检 测到可溶性CD163 在反应性HLH、败血症、急性 IM、利什曼虫感染患者及健康对照者血清中的平 均水平分别为39、9.1、8.2、6.7、1.8 mg/L。本研 究将EBV 感染患儿血清sCD163 水平与主要实验 室指标进行相关性分析,结果提示sCD163 水平与 EBV 感染患儿的疾病严重程度相关。本研究结果 显示HLH 组血清sCD163 水平远高于对照组和IM 组,并且本研究中的8 例HLH 患儿血清sCD163 水平均>10 000 ng/mL,与文献报道[8] 一致。
本研究动态观察了3 例HLH 患儿血清 sCD163 水平的变化,结果显示第1 周按照HLH- 2004 方案予化疗后sCD163 水平均明显下降,在 随后的3 周时间里呈平缓下降趋势;其中1 例在 治疗第5 周时合并真菌性肺炎,此时血清sCD163 水平虽仍呈下降趋势,但下降幅度较前减小,考 虑合并的感染有诱发巨噬细胞重新活化的趋势, 但正在使用的免疫抑制剂控制了其活化的程度。 Schaer 等[7] 对1 位EBV 相关HLH 患者进行2 年的 随访发现,每一次病情的复发都伴随sCD163 的突 然异常升高。而另1 位巨细胞病毒相关HLH 患者 经过化疗后,病情明显改善,但随后并发致命的 细菌性败血症,检查发现与细菌感染相关的炎症指标CRP 持续上升,而反映巨噬细胞活化的指标 sCD163 却持续下降。
以上研究结果提示血清sCD163 升高可作为 HLH 的诊断指标之一,并可帮助评估疗效、预 后和及时了解病情变化。与检测血清sCD163 的 ELISA 实验方法比较,细胞表面mCD163 的流式 细胞术检测手段更加操作简捷、所需样本量少且 结果快速精准。Weaver 等[9] 研究显示,sCD163 系 由活化Toll 样受体或炎症因子激活基质金属蛋白 酶,磷酸化mCD163,自单核细胞和巨噬细胞膜表 面脱落形成。那么,细胞表面CD163 在EBV 感染 的患儿体内的表达及其与血清sCD163 的关系又是 如何,目前国内外尚未见相关文献报道。本研究 在前期的预实验中曾经采用肝素管收集血标本, 结果在单核细胞群内检测不到CD163 的表达。文 献报道[10],单核细胞CD163 的表达率在5%~30% 左右,对血标本使用不同的抗凝剂和处理方法对 CD163 的流式细胞术检出率影响很大,EDTA 抗凝 和全血处理法最佳。本研究结果显示CD14+ 单核 细胞表面CD163 表达率在对照组、IM 组和HLH 组差异无统计学意义,并且在IM 患儿中的表达与 血清sCD163 无明显相关性。该结果与Onofre 等 [11] 的研究结果不同:血浆中sCD163 浓度与外周血单 核细胞和组织中的巨噬细胞膜表面mCD163 表达 水平成反比,两者之间的平衡与单核巨噬细胞的 功能状态有关,而与其绝对计数无关。推测其中 原因可能与CD163 在成熟组织(例如肝、脾、骨 髓和淋巴结)中的巨噬细胞的表达要高于外周血 单核细胞[12] 有关,而本研究尚未对组织中的巨噬 细胞膜表面mCD163 的表达水平进行检测。尽管 如此,但因为单核细胞是巨噬细胞的前体,所以 通过检测外周血单核细胞表面CD163 表达率来反 映机体的免疫活化还是有一定意义的。
有研究表明,不同的活化信号激活巨噬细胞, 根据分泌产物以及生物学标志,将活化巨噬细胞 分为经典激活和选择性激活巨噬细胞两群[13]。经 典激活的巨噬细胞主要发挥杀伤效应,而选择性 活化的巨噬细胞倾向免疫调控和机体恢复。在炎 症过程中,巨噬细胞的经典激活与选择性激活互 相协调,达到一个平衡。一旦平衡失调,无论哪 种方式过强,都可能引起病理损伤。本研究HLH患儿数量有限,故HLH 患儿外周血单核细胞尤其 是组织中巨噬细胞表面CD163 的表达水平及其与 病情变化、与血清sCD163 水平关系如何尚待进一 步的研究。
| [1] | Filipovich AH. Hemophagocydc lyrephohistiocytosis (HLH) and related disorders[J]. Hematol Am Soc Hematol Educ Program, 2009: 127-131. |
| [2] | Switala JR, Hendricks M, Davidson A, et al. Serum ferritin is a cost-effective laboratory marker for hemophagocytic lymphohistiocytosis in the developing world[J]. J Pediatr Hematol Oncol, 2012, 34(3): e89-e92. |
| [3] | Jordan MB, Allen CE, Weitzman S, et al. How I treat hemophagocytic lymphohistiocytosis[J]. Blood, 2011, 118(15): 4041-4052. |
| [4] | Henter JI, Horne A, Arico M, et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis[J]. Pediatr Blood Cancer, 2007, 48(2): 124-131. |
| [5] | 胡亚美,江载芳.诸福棠实用儿科学[M].第7版.北京: 人民卫生出版社, 2002: 821-825. |
| [6] | Moller HJ, Hald K, Moestrup SK. Characterization of enzyme-linked immunosorbent assay for soluble CD163[J]. Scand J Clin Lab Invest, 2002, 62(4): 293-299. |
| [7] | Schaer DJ, Schleiffenbaum B, Kurrer M, et al. Soluble hemoglobin-haptoglobin scavenger receptor CD163 as a lineage-specific marker in the reactive hemophagocytic syndrome[J]. Eur J Haematol, 2005, 74(1): 6-10. |
| [8] | Moller HJ. Soluble CD163[J]. Scand J Clin Lab Invest, 2012, 72: 1-13. |
| [9] | Weaver LK, Pioli PA, Wardwell K, et al. Up-regulation of human monocyte CD163 upon activation of cell surface Toll-like receptors[J]. J Leukoc Biol, 2007, 81(3): 663-671. |
| [10] | Moniuszko M, Kowal K, Rusak M, et al. Monocyte CD163 and CD36 expression in human whole blood and isolated mononuclear cell samples: influence of different anticoagulants[J]. Clin Vaccine Immunol, 2006, 13(6): 704-707. |
| [11] | Onofre G, Kolackova M, Jankovicova K, et al. Scavenger receptor CD163 and its biological functions[J]. Acta Medica (Hradec Kralove), 2009, 52(2): 57-61. |
| [12] | Nguyen TT, Schwartz EJ, West RB, et al. Expression of CD163 in normal tissues, lymphomas, carcinomas, and sarcomas is largely restricted to the monocyte/macrophage lineage[J]. Am J Surg Pathol, 2005, 29(5): 617-624. |
| [13] | Kowal K, Silver R, Sławinska E, et al. CD163 and its role in inflammation[J]. Folia Histochem Cytobiol, 2011, 49(3): 365-374. |
 2015, Vol. 17
2015, Vol. 17


