由于机械通气和肺表面活性物质的普遍应用 及早产儿管理技术的改进,危重新生儿存活率显 著提高。然而,由于呼吸障碍需要长时间吸入高 体积分数氧(高氧),可能引起肺部出现氧化应 激反应,继而发展至肺纤维化及支气管肺发育不 良,对患儿生活质量造成影响[1]。
目前研究显示,细胞内产生过量活性氧 (reactive oxygen species,ROS) 是引起高氧肺损 伤的主要途径,而ROS 常通过以下两种途径产 生:一种是还原型烟酰胺腺嘌呤二核苷酸磷酸 (NADPH)途径,另一种是线粒体途径[2, 3]。本课 题组前期研究表明,高氧可激活PKCβ,从而使 胞质内p66Shc 发生磷酸化,随后被Pin1 识别发生 异构化(Pin1 主要作用是介导p66Shc 在线粒体转 位),进而在蛋白磷酸酶2A(protein phosphatase 2A,PP2A)去磷酸化的作用下进入线粒体,活化 后的p66Shc 转移到线粒体呼吸链酶复合体Ⅲ氧化 细胞色素C 产生ROS/H2O2 [4, 5]。因此推测,Pin1 可 在高氧条件下导致ROS 形成,继而在肺损伤中起 到重要作用。本课题组前期实验已成功构建Pin1- shRNA 慢病毒载体,并建立Pin1 稳定低表达的 A549 细胞系[6]。本研究进一步探讨沉默Pin1 表达 是否抑制高氧诱导人肺泡上皮细胞的凋亡,为高 氧肺损伤治疗提供一种新的治疗方法。 1 材料与方法 1.1 细胞培养与分组
体外常规培养的人肺泡上皮细胞株(A549), 随机分为对照组、高氧组、空载体组和Pin1- shRNA 组,对照组置于5% CO2 培养箱中常规培养, 高氧组、空载体组和Pin1-shRNA 组分别给予高体 积分数氧诱导细胞,即通入3 L/min 的95% 氧气和 5% 二氧化碳高纯混合气10 min,并在培养箱中密 闭培养24 h 后检测下述指标。 1.2 细胞形态学观察
各组细胞分别密闭培养24 h 后,在IX71 型倒 置相差显微镜下观察细胞的形态变化。 1.3 流式细胞术检测细胞凋亡率 按照凯基生物Annexin V-FITC 和PI 双染试 剂盒说明书进行细胞凋亡率检测。将上述分组 细胞密闭培养24 h 后,PBS 洗涤3 次,用不含EDTA 的胰酶消化制备单细胞悬液,调整细胞密 度为1×106/mL,取1×106 个细胞加入500 μL 的 Binding Buffer 重悬细胞,再分别加入5 μL Annexin V-FITC 和5 μL PI,混匀后室温下避光孵育反应 15 min。在激发光波长488 nm,发射波长530 nm 的流式细胞仪进行检测。在双变量流式细胞仪 的散点图上,右上象限为晚期凋亡细胞(FITC+/ PI+);右下象限为早期凋亡细胞(FITC+/PI-); 左上象限为机械损伤细胞(FITC-/PI+);左下象限 为正常细胞(FITC-/PI-)。实验结果是以右上象限 和右下象限的细胞数之和与总细胞数之比计算凋 亡率。实验重复3 次,每组共8 个样本。 1.4 免疫组化法检测细胞凋亡相关蛋白的表达
采用SP 免疫组织化学法检测细胞凋亡相关 蛋白X 连锁凋亡抑制蛋白(XIAP)和胱冬肽酶 (Caspase)-9 蛋白的表达情况。实验中XIAP 和 Caspase-9 蛋白抗体的稀释度均为1 : 150。实验步 骤按照说明书进行操作,胞浆染成棕黄色为阳性 表达。实验重复3 次,每组随机选取8 张细胞爬片, 每张爬片任选8 个高倍镜视野,在倒置相差显微 镜下观察细胞,采用Image-Pro 6.0 图象分析软件 对图象进行分析,XIAP 和Caspase-9 表达水平以 其平均光密度值(AOD)表示。 1.5 荧光显微镜检测线粒体ROS 的含量
采用MitoSox Red(Molecular Probes®) 作为 高选择性的线粒体内ROS 荧光染料,能够自由 透过活细胞膜进入细胞内并选择性靶向线粒体, 与线粒体内的超氧阴离子ROS 氧化产生红色荧 光。实验根据说明书步骤进行操作,细胞核采用 DAPI 染色呈蓝色荧光。荧光显微镜下观察并照相 (MitoSOX:510/580 nm,DAPI:340/488 nm), 实验重复3 次,每组随机选取8 张细胞爬片,每 张爬片任选8 个高倍镜视野进行观察,使用Image- Pro 6.0 图像分析软件分析图像,测定AOD 以表示 ROS 含量。 1.6 荧光显微镜检测线粒体膜电位的变化
按照线粒体膜电位检测试剂盒说明书进行 操作。正常细胞中线粒体膜电位较高,JC-1 以 聚合物形式存在于线粒体的基质中,在发射波长 590 nm 下产生红色荧光。但当细胞受损时,线粒 体膜电位下降,JC-1 则不能聚集在线粒体的基质 中,以单体形式存在,在发射波长530 nm 下产生绿色荧光,通过JC-1 从红色荧光到绿色荧光的转 变检测细胞膜电位的下降。JC-1 红色荧光与绿色 荧光的荧光度比值(红/ 绿)反映细胞线粒体膜电 位的高低。实验重复3 次,每组随机选取8 张细 胞爬片,每张爬片任选8 个高倍镜视野进行观察, 使用Image-Pro 6.0 图像分析软件分析图像,测定 AOD,以红/ 绿荧光强度比值表示线粒体膜电位高 低。 1.7 统计学分析
采用SPSS 19.0 统计分析软件对数据进行处 理,计量资料用均数± 标准差(x±s)表示,多 组间比较采用单因素方差分析,组间两两比较采 用SNK-q 检验,P<0.05 为差异有统计学意义。 2 结果 2.1 细胞形态学观察
通过倒置相差显微镜对细胞形态进行观察, 对照组细胞生长状态良好,活细胞数量多,少见 细胞漂浮,细胞呈梭形,细胞间隙较小,连接紧 密。高氧组及空载体组细胞均呈现出生长状态差, 活细胞数量明显减少,培养基中可见大量圆形细 胞漂浮,剩下的活细胞排列松散,间隙明显增宽。 Pin1-shRNA 组细胞生长状态欠佳,贴壁欠佳,但 活细胞数量较高氧组有所增加,悬浮细胞数较高 氧组减少,但是未达到对照组水平。 2.2 各组细胞凋亡率变化
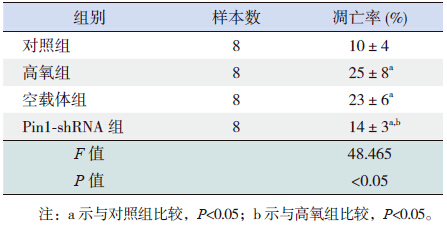
流式细胞术检测结果表明与对照组相比,高 氧组和空载体组细胞凋亡率显著增加(P<0.05), 但两组间凋亡率的差异无统计学意义(P>0.05)。 Pin1-shRNA 组凋亡率较高氧组和空载体组显著降低(P<0.05),但仍高于对照组(P<0.001)。见图 1、表 1。
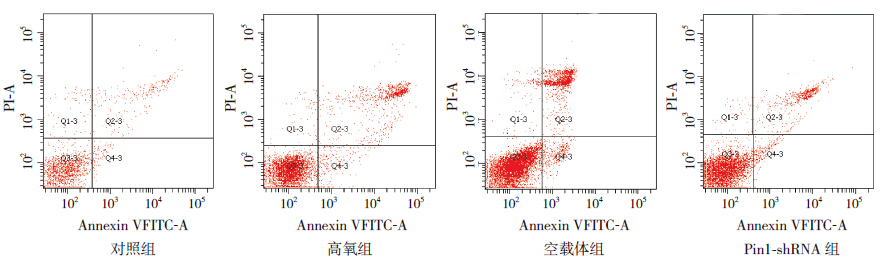 |
图 1 高氧诱导A549 细胞凋亡的影响(流式细胞术双参数图)右上象限与右下象限细胞数之和占总细胞数比 值为细胞凋亡率。 |
| 表 1 各组细胞凋亡率比较 (x±s) |
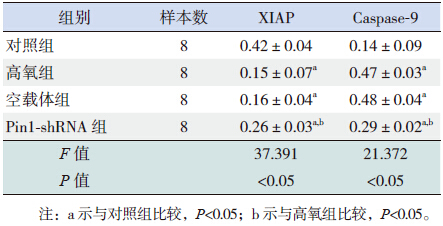
XIAP 和Caspase-9 蛋白阳性表达呈棕黄色。 与对照组比较,高氧组和空载体组A549 细胞 XIAP 表达量明显减少,Caspase-9 表达量明显增加 (P<0.05)。XIAP 和Caspase-9 表达水平在高氧组 和空载体组间比较差异无统计学意义(P>0.05)。 Pin1-shRNA 组细胞XIAP 表达水平明显高于高 氧组和空载体组,但仍低于对照组(P<0.05); Caspase-9 表达水平低于高氧组和空载体组,但仍 高于对照组(P<0.05)。见图 2、表 2。
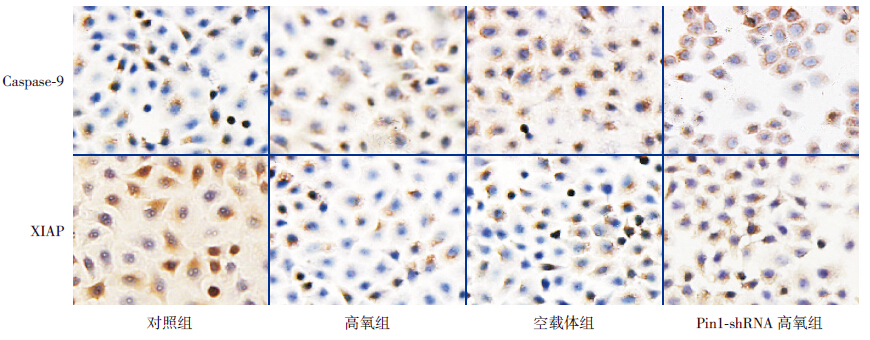 |
图 2 SP 细胞免疫化学方法检测各组细胞中XIAP 和Caspase-9 蛋白的表达(×200) XIAP 和Caspase-9 蛋白阳性表达均呈棕黄色。与对照组相比,高氧组和空载体组XIAP 阳性表达减少,Caspase-9 阳性表达增加;Pin1-shRNA 组 XIAP 和Caspase-9 蛋白阳性表达介于对照组和高氧组间。 |
| 表 2 各组XIAP 和Caspase-9 蛋白表达水平比较 (x±s) |
胞质中ROS 阳性表达呈红色荧光。对照组 ROS 含量最低(1.08±0.05),高氧组(1.47±0.06) 和空载体组(1.48±0.06)ROS 含量显著高于对照 组(分别t=-12.396、-13.402,P<0.05),但两组 间比较差异无统计学意义(t=-0.251,P>0.05)。 Pin1-shRNA 组ROS 含量(1.26±0.04) 较高氧 组和空载体组降低( 分别t=-7.639、-6.710, P<0.05),但仍高于对照组(t=-7.288,P<0.05)。 见图 3。
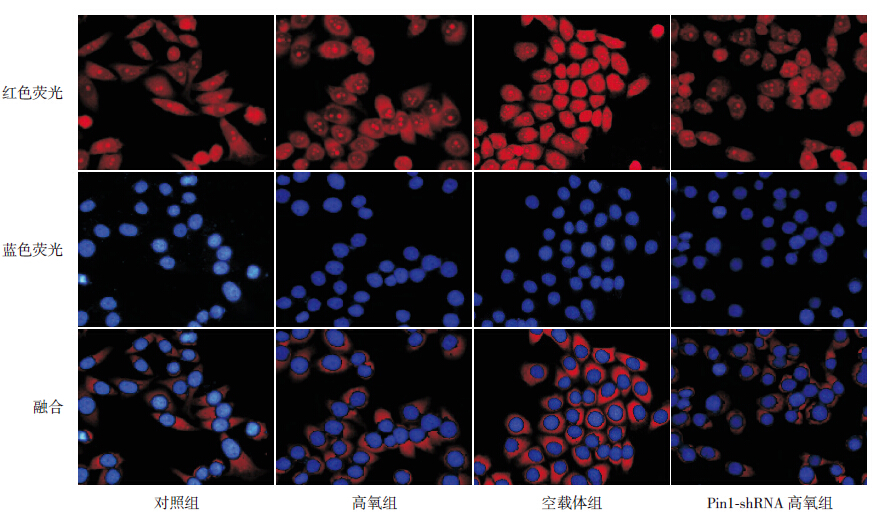 |
图 3 各组细胞线粒体ROS 生成的改变(荧光显微镜,×400) 线粒体ROS 呈红色荧光,蓝色荧光显示为细胞 核。高氧组、空载体组红色荧光明显增多,代表线粒体ROS 显著高于对照组,而Pin1-shRNA 组线粒体ROS 较高氧组显著降低, 但仍高于对照组。 |
对照组中线粒体膜电位最高(0.97±0.06), 而高氧组(0.56±0.03)和空载体组(0.53±0.07) 与之相比均下降( 分别t=10.661、9.612, P<0.05),但两组间比较差异无统计学意义 (t=0.897,P>0.05)。Pin1-shRNA 组(0.71±0.03) 膜电位高于高氧组和空载体组(分别t=6.622、 2.634,P<0.05),但仍高于对照组(t=7.302, P<0.05)。见图 4。
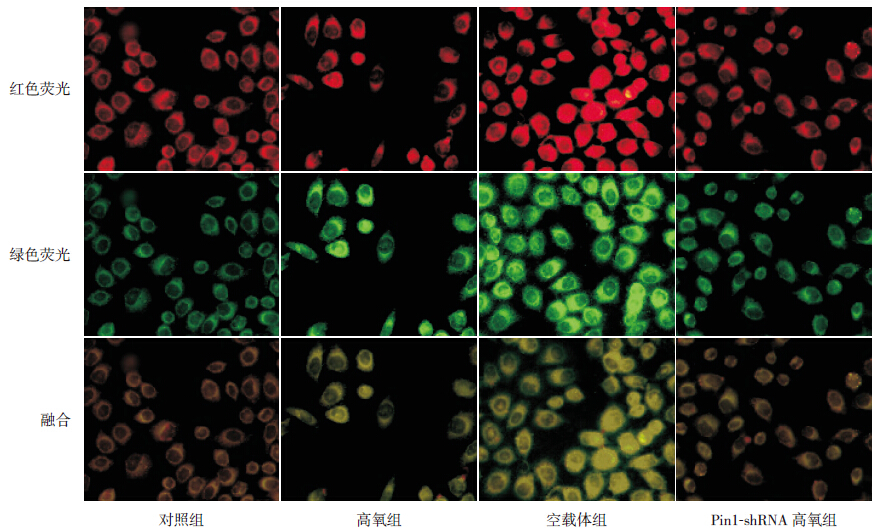 |
图 4 各组细胞线粒体膜电位的改变(荧光显微镜,×400) 正常线粒体膜电位较高,JC-1 呈现红色荧光,线粒 体膜电位下降时,JC-1 呈现绿色荧光。判断线粒体膜电位高低以红、绿荧光的比值来表示。高氧组、空载体组线粒体膜电位 较对照组降低,Pin1-shRNA 组线粒体膜电位较高氧组有所升高,但仍低于对照组。 |
随着医疗技术的不断发展,早产儿救治的成 活率逐年增加。但在救治过程中,大部分患儿均 吸入不同浓度的氧气,由此造成了急、慢性肺损伤, 后者已经成为了早产儿,尤其是极低出生体重儿 的主要死亡原因[7,8]。
越来越多的研究者关注高氧诱导肺泡上皮细 胞的损伤机制,重点仍是氧化应激通路。氧化应 激可产生肿瘤坏死因素α(tumor necrosis factor, TNF-α),后者与细胞膜表面受体特异性结合,通 过死亡受体途径介导细胞凋亡[9]。此外,有研究表 明持续高氧暴露可产生大量ROS,导致Ca2+ 蓄积 并超载,通过线粒体途径介导细胞凋亡,引起线 粒体通透性转换孔开放,从而氧化磷酸化解偶联 与电子传递链下降、线粒体膜电位丧失、细胞色 素C 和凋亡诱导因子释放等[10]。本课题组前期研 究证实,Omi/ HtrA2 是一种线粒体丝氨酸蛋白酶, 作为凋亡蛋白之一[11],正常情况下存在于线粒体 膜膜间隙中,高氧可以诱导线粒体膜通透性改变, 从线粒体膜间隙释放到细胞质中[12],可独立地破 坏核内染色质,经过自身酶切转变成活性形式,与XIAP 相互作用,进而激活凋亡蛋白家族的主要 成员Caspase 并作用于其他Ca2+ 依赖性蛋白,通过 这些变化导致整个细胞的结构破坏、功能紊乱, 最终细胞凋亡[13]。
Pin1 是人类肽基脯氨酰异构酶,能特异地识 别和结合蛋白质磷酸化的丝/ 苏- 脯氨酸基序,催 化磷酸化的丝/ 苏- 脯氨酸肽键发生顺反异构,从 而改变磷酸化蛋白质的功能[14, 15]。目前尚无报道关 于Pin1 参与线粒体氧化应激通路的相关报道。线 粒体作为细胞内唯一供能细胞器,既是细胞产生 氧化应激反应的重要部位,又是发生细胞凋亡的 的中心环节[16]。本实验研究Pin1 所参与的氧化磷 酸化途径是通过线粒体膜通透性的改变,进入胞 质中活化后的p66Shc 转移到线粒体呼吸链酶复合 体Ⅲ氧化细胞色素C 产生ROS/H2O2。当细胞色素 C 等进入胞质中,与d-ATP 结合,激活Apaf-1, Apaf-1 寡聚化使凋亡起始蛋白酶原前体Caspase-9 激活,从而启动了凋亡途径。XIAP 的BIR3 结构 域可与在Asp315 位点酶切活化的Caspase-9 上315 位天冬氨酸能与XIAP-BIR3 结合,产生抑制信号 而阻滞Caspase-9 对下游蛋白激活[17, 18, 19, 20]。如果能够 在早期抑制细胞中Pin1 的表达,就可从根源上减少氧化应激后Pin1 介导的p66shc 在线粒体上转位, 进而阻止线粒体呼吸链复合体Ⅲ氧化细胞色素C 产生的ROS/H2O2,最终减少高氧对细胞的损伤。
本研究检测了抑制Pin1 表达后的A549 细 胞系相关指标。在流式细胞仪检测凋亡中,抑制 Pin1 表达的A549 细胞系给予高氧刺激后能够降低 凋亡率;其在免疫组化检测结果中得到,XIAP 的 表达较高氧组有所增加,Caspase-9 的表达有所下 降;在检测线粒体ROS 的产生中,抑制Pin1 表达 的A549 细胞系中表达活性氧簇的红色荧光较高氧 组明显减少;而在检测线粒体膜电位的变化中, 其线粒体膜电位较高氧组高,但未达到对照组水 平。由此可见,Pin1 通过p66shc 调节细胞氧化应 激反应信号通路,抑制其表达有望成为新的氧化 应激治疗方法,提高早产儿的生存质量。
| [1] | Gien J, Kinsella JP. Pthogenesis and treatment of bronchopulmonary dysplasia[J]. Curr Opin Pediatr, 2011, 23(3): 305-313. |
| [2] | Przybylska D, Mosieniak G. The role of NADPH oxidase NOX4 in regulation of proliferation, senescence and differentiation of the cells[J]. Postepy Biochem, 2014, 60(1): 69-76. |
| [3] | Kardeh S, Ashkani-Esfahani S, Alizadeh AM. Paradoxical action of reactive oxygen species in creation and therapy of cancer[J]. Eur J Pharmacol, 2014, 15(735): 150-168. |
| [4] | Pinton P, Rimessi A, Marchi S, et al. Protein kinase C and prolylisomerase 1 regulate mitochondrial effects of the life span determinant p66Shc[J]. Science, 2007, 315 (5812): 6592-6663. |
| [5] | 车忠丽, 董文斌, 李清平, 等. PKCβ/p66shc氧化应激通路介导高氧诱导人肺泡上皮细胞凋亡的作用[J]. 临床儿科杂志, 2013, 31(11): 1066-1069. |
| [6] | 赵帅, 董文斌, 张婵, 等. 慢病毒介导的shRNA对A549细胞Pin1表达的感染作用[J]. 细胞与分子免疫学杂志, 2013, 30(3): 245-249. |
| [7] | Fridman E, Linder N. Magnesium and bronchopulmonary dysplasia[J]. Harefuah, 2013, 152(3): 158-161. |
| [8] | Agrawal A, Zhuo H, Brady S, et al. Pathogenetic and predictive value of biomarkers in patients with ALI and lower severity of illness: results from two clinical trials[J]. Am J Physiol Lung Cell Mol Physiol, 2012, 303: L634-L639. |
| [9] | Tchikov V,Bertsch U,Fritsch J, et al. Subcellular compartmentalization of TNFreceptor-1and CD95 signaling pathways[J]. Eur J Cell Biol, 2011, 90(6-7): 467-475. |
| [10] | Delavallee L, Cabon L, Galan Malo P, et al. AIF mediateed caspase in dependent necroptosis: A new chance for targeted therapeutics [J]. IUBMB Life, 2011, 63(4): 221-232. |
| [11] | Xu Z, Chen X, Peng C, et al. The expression and clinical significance of Omi/Htra2 in hepatocellular carcinoma[J]. Hepatogastroenterology, 2013, 60(121): 6-13. |
| [12] | Lu MY, Dong WB, KANG L, et al. Protective effect of mitochondrial ATP-sensitive potassium channel on lung injury induced by hyperoxia in premature rats[J]. Am J Appl Clin Pediatr, 2012(27): 1402-1406. |
| [13] | Winkler J, Rand ML, Schmugge M, et al. Omi/HtrA2 and XIAP are components of platelet apoptosis signaling[J]. Thromb Haemost, 2013, 109(3): 532-539. |
| [14] | Lee TH, Pastorino L, Lu KP. Peptidyl-prolyl cis-trans isomerase Pin1 in ageing, cancer and Alzheimer disease[J]. Expert Rev Mol Med, 2011, 13: e21. |
| [15] | Hanes SD. The Ess1 prolyl isomerase: Traffic cop of the RNA polymerase II transcription cycle[J]. Biochim Biophys Acta, 2014, 9399(14): 21-22. |
| [16] | Garcia-Corzo L, Luna-Sanchez M, Doerrier C, et al. Ubiquinol-10 ameliorates mitochondrial encephalopathy associated with CoQ deficiency[J]. Biochim Biophys Acta, 2014, 4439(14): 47-57. |
| [17] | Zhang Z, Falk MJ. Integrated transcriptome analysis across mitochondrial disease etiologies and tissues improves understanding of common cellular adaptations to respiratory chain dysfunction[J]. Int J Biochem Cell Biol, 2014, 2725(14): 55-57. |
| [18] | Verner Z, Cermakova P, Skodová I, et al. Comparative analysis of respiratory chain and oxidative phosphorylation in Leishmania tarentolae, Crithidia fasciculata, Phytomonas serpens and procyclic stage of Trypanosoma brucei[J]. Mol Biochem Parasitol, 2014, 6851(14): 19-25. |
| [19] | Kiss G, Konrad C, Pour-Ghaz I, et al. Mitochondrial diaphorases as NAD+ donors to segments of the citric acid cycle that support substrate-levelphosphorylation yielding ATP during respiratory inhibition[J]. FASEB J, 2014, 5674(45): 452-455. |
| [20] | Oberoi-Khanuja TK, Murali A, Rajalingam K. IAPs on the move:role of inhibitors of apoptosis proteins in cell migration[J]. Cell Death Dis, 2013, 5(4): e784. |
 2015, Vol. 17
2015, Vol. 17