扩张型心肌病(dilated cardiomyopathy,DCM) 是儿童时期以心腔扩大、心功能障碍为主要特征 的原因不明的心肌疾病,至今尚无特异有效的治 疗方法,预后极差。DCM 的发病机制仍然不明, 涉及基因突变及遗传、病毒性心肌炎后遗症、免 疫损害等,DCM 所引起的慢性顽固性心力衰竭是 其预后不佳的主要原因,也是儿科心血管工作者 的一大难题[1, 2]。。
近年来,随着重组人生长激素(recombinant human growth hormone,rhGH)在促进儿童身高增 长的研究及临床上的广泛应用,生长激素(growth hormone,GH)的研究重点进一步深入到心血管系 统。研究发现GH 能通过自分泌和旁分泌等原理, 刺激中枢系统或局部器官产生胰岛素样生长因 子-1(IGF-1)、IGF-2 及IGF 结合蛋白(IGFBP), 心脏中存在GH、IGF-1、IGF-2 的受体,当GH 和 IGF-1 水平上升,直接或间接作用于心脏,增加心 脏收缩力,改善后负荷,减轻心肌纤维化,通过 增加心肌细胞的基因表达使心肌细胞增生,减少 室壁张力,改善心功能,认为 GH/IGF-1 轴在决定 心脏的形态及功能上占有重要的位置[3, 4]。另外GH 及IGF-1 可能通过激活细胞外调节激酶和抑制致炎 细胞因子,影响心衰患者心肌细胞的凋亡过程[5]。 本研究以呋喃唑酮喂食制备的幼年DCM 模型大鼠 为研究对象,探讨rhGH 对幼年DCM 模型大鼠左 心室形态及功能的影响,以及rhGH 对DCM 的改 善效果及安全性。 1 材料与方法 1.1 模型制备及分组两周龄近交系Sprague-Dawley(SD)雄性大鼠 共60 只,体重30~35 g,由第四军医大学实验动 物中心提供[许可证号:SCXK-(军)20071007]。随机分为对照组、DCM 模型组(DCM 组)和生长 激素治疗组(rhGH 组),每组20 只。
DCM 大鼠模型的建立参照文献[6, 7]:将呋喃唑 酮(山西云鹏药业有限公司,批号:B101202)用 生理盐水配成20 mg/mL 的溶液,按0.25 mg/g 给大 鼠灌胃,每日1 次,每周按体重调整用药剂量, 喂饲至12 周,超声检查诊断为DCM;造模成功后 rhGH 组以剂量0.15 u/kg 的rhGH 注射液(长春金 赛药业有限责任公司,批号:S20050025)每日腹 腔注射1 次,共计12 周,DCM 组大鼠以等量生理 盐水行腹腔注射;对照组为空白对照,不采取任何 措施,其他喂养条件相同。 1.2 心脏功能的超声及血流动力学检测
从模型制备开始后第24 周时,各组大鼠用2% 戊巴比妥钠行腹腔麻醉,称重后仰卧固定于操作 台上,8% 硫化钠于胸部脱毛,采用彩色多谱勒诊 断仪(Sequoia 512,日本西门子公司)进行检查, 心脏多谱勒检查由经验丰富的医师专人专机操作。 检测指标包括:左室舒张末期内径(LVDD)、左 室收缩末期内径(LVSD)、室间隔厚度(IVS)、 左室后壁厚度(LVPWT)、缩短分数(FS)、射 血分数(EF)。取左室长轴切面和左乳头肌水平 测量M 型曲线,连续测3 个心动周期,取平均值。
完成超声检测后,分离右侧颈总动脉,置入 PE50 聚乙烯导管,前端插入左室并经玻璃活塞与 Power lab 转换器和多导生理仪相连,测定中心静 脉压(CVP)、左心室压(LVP)、左室舒张末期 压(LVEDP)和心率(HR)。 1.3 血清生化指标测定
各组大鼠行眼眶采血,柠檬酸钠抗凝,混 合10~20 min,静置2 h,2 000~3 000 rpm,离心 10 min,收集上清,-20 ℃ 冻存待测。IGF-1 及 IGFBP-3 采用放射免疫法测定; 肌钙蛋白I、T (cTnI、cTnT)采用改良单克隆夹心酶联免疫法测定;N 末端B 型利钠肽(NT-proBNP)水平检测采 用ELISA 法测定,ELISA 试剂盒购自上海朗卡公司。 1.4 心脏称重及心脏病理组织学检测
完成上述检测后,处死大鼠,迅速取出心脏, 滤纸沾吸血迹后称全心重量,剪去左右心房及右 心室,称左心室重量。取左室心肌经10%甲醛固 定后,常规石蜡包埋、3~5 mm 厚度切片,行苏木精- 伊红(HE)染色及光镜观察;每个标本随机选取 5 张切片,苦味酸- 天狼猩红偏振光法染色,偏振 光显微镜下在非梗死区随机选取4 个不含血管视 野,Image Proplus 6.0 图像分析系统计算每个视野 中心肌胶原蛋白Ⅰ、Ⅲ(Col Ⅰ、Col Ⅲ)所占百分比, 取均数代表Col Ⅰ和Col Ⅲ的容积分数(CVF), 计算Col Ⅰ /Col Ⅲ比值。取左室心肌1 mm3 组织 5~6 块,置于2.5% 的戊二醛固定液中,4℃冰箱保 存,制备电镜切片,透射电镜观察心肌组织超微 结构改变。 1.5 统计学分析
采用SPSS 17.0 统计软件对数据进行统计学分 析,计量资料以均数± 标准差(x±s)表示,多 组间比较采用方差分析,组间两两比较采用SNK-q 检验,P<0.05 为差异有统计学意义。 2 结果 2.1 一般情况
DCM 组和rhGH 组大鼠于造模4 周时出现体 型瘦小、毛色发黄、反应迟钝、进食饮水减少。7 周时出现精神萎靡、进食饮水极少、脱毛、水肿、 站立行走不稳等。10~11 周时两组大鼠各死亡2 只, 均死于心脏功能衰竭、大量腹水,尸体解剖发现口 腔、消化道黏膜均水肿、黄染,心脏扩大呈灯泡状; 余36 只大鼠均表现为喘息、正常爬行不稳、醉酒状、行动缓慢、运动耐量下降,心脏超声检查显示 DCM 改变。对照组大鼠无死亡,心脏超声未见异常。
rhGH 治疗2 周后rhGH 组大鼠活动量较DCM 组大鼠明显增加,较治疗前也有明显改善,表现 为可正常爬行,喘息症状改善,进食饮水增加; 治疗6 周时其行为学表现同对照组,无喘息等症状; 治疗12 周时rhGH 组大鼠活动量较对照组增大, 精神略亢奋。 2.2 各组大鼠心脏超声心动图检查结果
与对照组相比,DCM 组大鼠均表现出明显心 腔扩大,室壁及左室后壁厚度明显变薄,FS 和EF 下降(P<0.05),30% 出现心室壁不同步运动。 经rhGH 治疗12 周后,rhGH 组大鼠心腔容积、室 壁厚度、FS 和EF 等均较DCM 组明显改善(P<0.05), 接近对照组水平(P>0.05)。见表 1。
| 表 1 各组超声心动图检查结果比较 (x±s) |
与对照组相比,DCM 组大鼠IGF-1、IGFBP-3 水平降低(P<0.05),cTnI、cTnT、NT-proBNP 水 平升高(P<0.05);rhGH 组大鼠IGF-1、IGFBP-3 水平较DCM 组和对照组显著升高(P<0.05), cTnI、cTnT、NT-proBNP 水平较DCM 组降低 (P<0.05),与对照组比较差异无统计学意义 (P>0.05)。见表 2。
| 表 2 各组血清生化指标检测结果比较 (x±s) |
因为体重不同,所以采用心脏重量/ 体重(HW/ BW)指标来比较各组心脏重量的差异。与对照组 相比,DCM 组BW、LVP 下降,HW/BW、CVP、 LVEDP 和HR 均升高(P<0.05);rhGH 组大鼠 BW 较DCM 组明显增加(P<0.05),HW/BW 较 DCM 组显著下降(P<0.05),CVP、LVP、LVEDP 和HR 均较DCM 组大鼠有较明显改善(P<0.05), 但上述指标与对照组比较,差异均无统计学意义 (P>0.05),见表 3。
| 表 3 各组体指标及血流动力学指标比较 (x±s) |
DCM 组大鼠光镜下显示心肌小块坏死,肌丝 排列紊乱、粗细不等,心肌细胞肥大和萎缩共存, 可见灶性溶解,不同程度颗粒变性与空泡变性, 核增大,部分分裂、畸形,肌细胞间纤维组织增多。 对照组大鼠心肌细胞排列整齐,无心肌细胞增大、 变性及破坏。rhGH 组大鼠心肌病理改变间于DCM 组和对照组之间。见图 1。
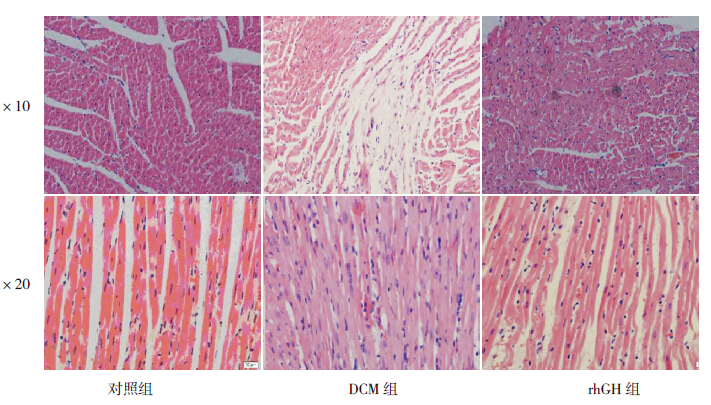 |
图 1 普通光镜下观察各组大鼠心肌组织病理学改变(苏木精- 伊红染色) 对照组心肌细胞排列整齐,无心 肌细胞增大、变性及破坏。DCM 组心肌小块坏死,肌丝排列紊乱、粗细不等,可见灶性溶解,不同程度颗粒变性与空泡变性, 核增大,肌细胞间纤维组织增多。rhGH 组心肌病理改变间于DCM 组和对照组之间。 |
对照组大鼠心肌线粒体大小一致,线粒体嵴 排列规则,滑面内质网排列规则,核膜均匀,染 色质分布均匀,肌丝排列整齐,横纹清楚。DCM 组大鼠心肌线粒体增生肿胀,大小不一,嵴断裂 或消失,核膜增厚,核染色质分布不均匀,可见 吞咽小泡;肌丝分布不均匀,排列紊乱,心肌细 胞肥大和萎缩同时存在,有变性、坏死及纤维化; 肌浆变性,失去收缩成分,胞核增大深染;间质 有淋巴细胞浸润;肌浆网和横管系统扩张。rhGH 组大鼠心肌细胞变性,坏死程度和范围明显减轻, 成局灶改变,可见少量淋巴细胞浸润。见图 2。
 |
图 2 电子显微镜下观察各组大鼠心肌组织病理学改变(电镜,×12 k) 对照组心肌线粒体大小一致,嵴排列 规则,滑面内质网排列规则,染色质分布均匀,肌丝排列整齐。DCM 组心肌线粒体增生肿胀,嵴断裂或消失,核染色质分布 不均匀,可见吞咽小泡,肌丝排列紊乱,心肌细胞有变性、坏死及纤维化。rhGH 组心肌细胞变性,坏死程度和范围明显减轻, 成局灶改变。 |
对照组大鼠心肌间质可见Col Ⅰ、Col Ⅲ均匀 分布于肌丝间,以Col Ⅲ为主(45.1%±2.7%), Col Ⅰ占20.6%±2.3%。DCM 组大鼠心肌胶原蛋白 在心肌间有不同程度的增生,以Col Ⅰ增生为主 (60.1%±2.6%),Col Ⅲ 占28.6±1.7%。rhGH 组 Col Ⅰ、Col Ⅲ分别占39.0±2.0% 和32.5±3.4%。 三组间Col Ⅰ /Col Ⅲ比值比较差异有统计学意 义(F=748.49,P<0.05),其中DCM 组Col Ⅰ / Col Ⅲ比值高于对照组和rhGH 组(P<0.05),而 在对照组和rhGH 组间Col Ⅰ /Col Ⅲ比值差异无统 计学意义(P>0.05)。见图 3。
 |
图 3 各组大鼠心肌胶原蛋白病理学变化(苦味酸- 天狼猩红,×100) Col Ⅰ的阳性表达呈红色,Col Ⅲ的阳 性表达呈蓝色。对照组心肌间质可见Col Ⅰ、Col Ⅲ均匀分布于肌丝间。DCM 组心肌胶原蛋白在心肌间有不同程度的增生, 胶原蛋白融合成大片或环状,排列紊乱。rhGH 组存在Col Ⅰ、Col Ⅲ增生,但程度弱于DCM 组。 |
目前,DCM 的治疗还仅仅停留于通过提高心 肌收缩力、降低心脏的压力和容量负荷,减少肺 循环和体循环静脉淤血,预防血栓栓子形成等并 发症阶段;以改善患儿临床症状、提高生存率和 生活质量,延长生命,争取行心脏移植为目标, 而后者仅仅只有少数患儿有此机会。药物治疗包 括长期应用洋地黄类药物、利尿剂、血管紧张素 转化酶抑制剂(ACEI)、β- 受体阻滞剂、免疫干 预与免疫吸附剂等。外科治疗方法包括部分左心 室切除术(PLV)、动力性心肌成形术、左室辅助装置(LVAD)以及二尖瓣成形术等姑息性手术, 以及心脏移植手术和干细胞移植。有报道直接向 左室壁注射心肌细胞或平滑肌细胞,两者植入后 可在宿主心肌中存活,提高心肌局部收缩能力, 抑制左室扩张和室壁增厚,增加每搏输出量及 LVEF,改善左室功能[8, 9],该方法真正应用于临床 尚需时间。
近年来发现GH/IGF 对人和实验动物的心血管 系统具有特殊效应,即GH 直接或间接通过血浆中 的IGF-1 及IGFBP-3 来起作用。一是GH 对心脏的 直接作用:刺激心肌细胞的生长,减少细胞凋亡、 心室重塑,提高心肌收缩力,提高心肌细胞的能 量利用率和机械效率;二是GH 对心脏的间接作用: 扩张血管,对抗心肌缺血,降低周围血管阻力, 增加血容量,减轻炎症反应[10, 11, 12, 13, 14]。
本研究结果发现rhGH 治疗12 周可使 LVED、LVES 显著缩小,IVS、LVPWT 增厚, EF、FS 明显升高,说明rhGH 可显著改善DCM 大 鼠心脏功能和逆转心室的不良重构。rhGH 主要使 心肌细胞的收缩成分增加,不伴有间质的增生, 从而增加心力衰竭患者的心肌收缩力,缩小扩张 的心腔,改善心功能。研究发现间歇性给予rhGH 治疗对慢性充血性心力衰竭疗效的Ⅱ期和Ⅲ期临 床试验证实,在常规治疗的基础上加用rhGH 可增 加心室壁厚度,进而减少室壁应激,改善心脏收 缩功能[15]。Perrot 等[12] 观察50 例DCM 患者随机 给予rhGH/IGF 皮下注射或安慰剂12 周发现,心 力衰竭的严重性与EF、LVED、血浆去甲肾上腺 素浓度显著相关,rhGH 治疗组患者左室重量显著 增加,EF 显著改善。Jose 等[14] 用rhGH 治疗6 例 DCM 患者,皮下注射2 IU,隔日1 次,分别于基 线水平治疗6 个月、停止治疗后6 个月观察,发 现DCM 患者症状明显改善,左室后壁及室间隔厚 度显著增加,但这些改变在治疗后6 个月有部分 可逆。
近年来,一些血生化指标在DCM 发病和恶 化过程中的作用引起重视。心力衰竭患者症状轻 重、运动耐力下降与IGF-1 和IGFBP-3 生物学效 应有一定关系,当GH 和IGF-1 下降会增加儿茶酚 胺的敏感性并使外周血管阻力增加[16]。交感神经 张力持续增高,血浆去甲肾上腺素浓度升高,使 衰竭心脏中的膜受体-G 蛋白、腺苷环化酶复合物成分下调,β- 受体密度降低,心肌收缩力下降。 而rhGH 作为重要的蛋白合成因子,在许多方面 有拮抗GH/IGF-1 轴紊乱、升高IGF-1 和IGFBP-3 的作用[17]。本组资料表明rhGH 治疗12 周,可升 高DCM 组大鼠血浆IGF-1 和IGFBP-3 水平,降低 cTnI、cTnT 和NT-proBNP 水平,提高运动耐量, 改善肝、肺淤血[6, 7]。GH 是直接和间接地通过 IGF-1 来发挥作用,补充 rhGH 后在分子水平上, 使心脏 IGF-1 mRNA 的表达增加,对心肌细胞有肥 大效应并能增加肌凝蛋白的轻链-α 的基因转录, 而使心肌细胞肥大,增加钙离子势能反应,增加 心肌和骨骼肌重量和力量[18];GH 和IGF-1 的水平 上升能明显的抑制血中去甲肾上腺素的释放,同 时增加了β- 受体向上的调节,β- 受体的数量和 反应性都有所增加能改善心脏的后负荷,增加心 脏的收缩性能,变更心肌纤维的水平,并通过增 加心肌细胞的基因表达而使心肌细胞增生,抑制 凋亡,减少室壁的张力,保存和改善心功能,间 接的降低心力衰竭引起的心率增快,使心排量增 加[19, 20, 21, 22]。cTnI、cTnT 水平降低提示心肌损害修复, 预后好。
DCM 的心肌特征性病理表现为心肌纤维化。 已有证据表明rhGH 可通过多种途径和机制来抑制 心肌胶原增生和逆转心肌纤维化,一方面可直接 抑制I 型、Ⅲ型胶原合成及其mRNA 的表达[23]; 另一方面,rhGH 可通过细胞因子和信号转导通 路的多个环节作用于心脏胶原。本研究结果表明 rhGH 组大鼠心脏非梗死区胶原蛋白增生情况和 Col Ⅰ /Col Ⅲ比值与DCM 组大鼠相比明显降低, 这表明心肌梗死后心肌成纤维细胞合成和分泌胶 原蛋白增加,胶原类型比例改变及心脏胶原网络 空间结构重建;而rhGH 干预能降低非梗死区胶原 含量,同时还能改善胶原类型比例,逆转胶原重构, 此与国外研究一致[24, 25]。
综上所述,rhGH 为DCM 提供了一个新的治 疗方法,其对心肌细胞的肥大效应,对GH/IGF 轴 的调节,抑制、逆转心肌纤维化等作用对DCM 的 远期预后产生有益的影响,但目前对rhGH 用于 DCM 的治疗研究仍处于初级阶段,尚未有大样本 的实验报道,rhGH 合适的剂量、疗程还在探索研 究中,rhGH 对全身的远期的副作用尚不清楚,这 些问题有待于大型临床试验来回答。
| [1] | 杨作成. 小儿扩张型心肌病的诊治[J]. 中华临床医师杂志, 2011, 5(23): 6868-6870. |
| [2] | 蔡小芳, 麦根荣, 徐之良. 小儿扩张型心肌病与病毒性心肌炎的临床研究[J]. 中国当代儿科杂志, 2004, 6(4): 325-327. |
| [3] | Vijayakumar A, Novosyadlyy R, Wu Y, et al. Biological effects of growth hormone on carbohydrate and lipid metabolism[J]. Growth Horm IGF Res, 2010, 20(1): 1-7. |
| [4] | Rasmussen MH. Obesity, growth hormone and weight loss[J]. Mol Cell Endocrinol, 2010, 316(2): 147-153. |
| [5] | Kanashiro-Takeuchi RM, Tziomalos K, Takeuchi LM, et al. Cardioprotective effects of growth hormone-releasing hormone agonist after myocardial infarction[J]. Proc Natl Acad Sci U S A, 2010, 107(6): 2604-2609. |
| [6] | 强欢, 付蓉, 潘凯丽, 等. 不同剂量呋喃唑酮诱导SD大鼠扩张型心肌病模型的实验研究[J]. 现代生物医学进展, 2013, 13(10): 1829-1835. |
| [7] | 强欢, 潘凯丽, 成胜权. 扩张型心肌病动物模型建立的实验研究进展[J]. 医学综述, 2011, 17(19): 2890-2892. |
| [8] | Ohno N, Fedak PW, Weisel RD, et al. Cell transplantation in non-ischemic dilated cardiomyo-pathy: a novel biological approach for ventricular restoration[J]. Jpn J Thorac Cardiovasc Surg, 2002, 50(11): 457-460. |
| [9] | 李彦红, 王风芝. 重组人生长激素和骨髓间质干细胞移植联合治疗阿霉素性心肌病心力衰竭的实验[J]. 中华心血管病杂志, 2008, 36(9): 794-798. |
| [10] | Osterziel KJ, Ranke MB, Strohm O, et al. The somatotrophic system in patients with dilated cardiomyopthy:relation of insulin-like growth factor-1 and its alterations during growth hormone therapy to cardiac function[J]. Clin Endocri, 2000, 53(1): 61-68. |
| [11] | Dreifuss P. Dilated cardiomyopathy and growth hormone[J]. Z Kardiol, 2002, 91 (12): 973-977. |
| [12] | Perrot A, Ranke MB, Dietz R, et al. Growth hormone treatment in dilated cardiomyopathy[J]. J Cardiac Surg, 2001, 16(2): 127-131. |
| [13] | Adamopoulos S, Parissis JT, Georgiadis M, et al. Growth hormone administration reduces circulating proinflammatory cytokines and soluble fas/souble fas ligand system in patients with chronic heart failure secondary to idiopathic dilated cardiomyopathy[J]. Am Heart J, 2002, 144(2): 359-364. |
| [14] | Jose VJ, Zechariah TU, George P, et al. Growth hormone therapy in patients with dilated cardiomyopathy: preliminary observations of a pilot study[J]. Indian Heart J, 1999, 51(2): 183-185. |
| [15] | 牛云枫, 程文俊. 生长激素治疗扩张性心肌病前后心电图及激素水平变化[J].实用心电学杂志, 2010, 3(19): 166-168. |
| [16] | Wu Y, Tobias AH, Bell K, et al. Cellular and molecular mechanisms of systolic and diastolic dysfunction in an avian model of dilated cardiomyopathy[J]. J Mol Cell Cardiol, 2004, 15(37): 111-119. |
| [17] | Marin-Garcia J, Goldenthal MJ, Ananthakrishnan R, et al. The complete sequence of mtDNA genes in idiopathic dilated cardiomyopathy shows novel missense and tRNA mutations[J]. J Card Fail, 2000, 6(4): 321-329. |
| [18] | 曹蘅, 蔚有权. 大鼠体内IGF-I水平改变与心肌梗死的关系[J]. 放射免疫学杂志, 2006, 19(5): 355-358. |
| [19] | Borgarelli M, Tarducci A, Tidholm A, et al. Canine idiopathic dilated cardiomyopathy. Part II: pathophysiology and therapy[J]. Vet J, 2001, 162(3): 182-195. |
| [20] | Morrisey EE. Rewind to recover: dedifferentiation after cardiac injury[J]. Cell Stem Cell, 2011, 4(9): 387-389. |
| [21] | 裴汉军, 吴永健, 惠汝太, 等. 阿托伐他汀干预对糖尿病心肌梗死后大鼠左室重构和心功能的影响[J]. 中国分子心脏病学杂志, 2010, 10(1): 23-26. |
| [22] | Sukumaran V, Watanabe K, Veeraveedu PT, et al. Beneficial effects of olmesartan,an angiotensin II receptor type 1 antagonist, in rats with dilated cardiomyopathy[J]. Exp Biol Med, 2010, 235(11): 1338-1346. |
| [23] | Patel R, Nagueh SF, Tsybouleva N, et al. Simvastatin induces regression of cardiac hypertrophy and fibrosis and improves cardiac function in a transgenic rabbit model of human hypertohic cardiomypathy[J]. Circulation, 2001, 104(3): 317-324. |
| [24] | Li TS, Takahashi M, Suzuki R, et al. Pravastatin improves remodeling and cardiac function after myocardial infarction by an antiinilammatory mechanism rather than by the induction of angiogenesis[J]. Ann Thorac Surg, 2006, 81(6): 2217-2225. |
| [25] | Martin J, Denver R, Bailey, et al. In vitro inhibitory effects of atorvastatin on cardiac fibmblasts:implications for ventrieular remodeling[J]. Clin Exp Pharnuwol Physiol, 2005, 32(9): 697-701. |
 2015, Vol. 17
2015, Vol. 17



